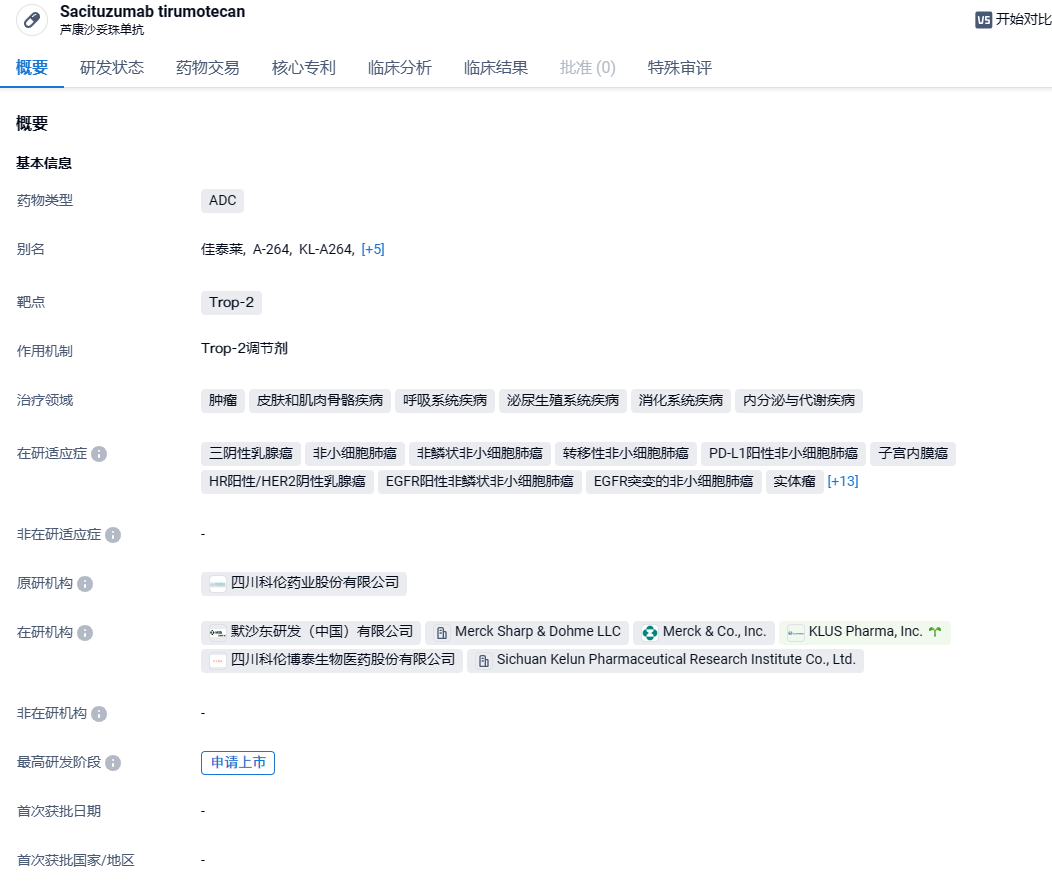
科伦博泰靶向TROP2 ADC新药注射用芦康沙妥珠单抗申报上市,针对非小细胞肺癌
8月20日,中国国家药监局药品审评中心(CDE)官网公示,科伦博泰注射用芦康沙妥珠单抗递交新药上市申请并获得受理。根据科伦博泰公告,本次申请上市的适应症为:治疗接受EGFR-TKI疗法和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)患者。该适应症几日前已经获CDE拟纳入优先审评。同时,这也是芦康沙妥珠单抗获中国国家药监局(NMPA)受理的第二项新药上市申请。
芦康沙妥珠单抗是由科伦博泰拥有自主知识产权的靶向TROP2的人源化单克隆抗体、可酶促裂解的Linker和新型拓扑异构酶I抑制剂组合而成的新一代抗体偶联药物(ADC),结合了单抗对肿瘤细胞表面靶抗原的特异性和细胞毒性药物的高效性。该产品已经先后4次被CDE纳入突破性治疗品种,分别针对:局部晚期或转移性三阴乳腺癌、局部晚期或转移性EGFR突变非小细胞肺癌、局部晚期或转移性HR阳性/HER2阴性乳腺癌、PD-L1阴性三阴性乳腺癌。 在国外,科伦博泰已有偿独家许可默沙东在大中华区(包括中国大陆、香港、澳门和台湾)以外开发、使用、制造及商业化SKB264(MK-2870),海外临床研究正在美国、加拿大、澳大利亚、法国、比利时和波兰有序开展或准备开展中。 多项全球多中心注册性临床研究在筹备中。
根据科伦博泰公告,本次上市申请是基于OptiTROP-Lung03多中心、随机、关键临床研究,评估了芦康沙妥珠单抗单一疗法每两周(Q2W)5mg/kg静脉注射对比多西他赛治疗接受表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)疗法和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)患者的结果。在预设的分析中,与多西他赛相比,芦康沙妥珠单抗单一疗法在客观缓释率(ORR)和无进展生存期(PFS)方面具有显著统计学意义和临床意义的改善。
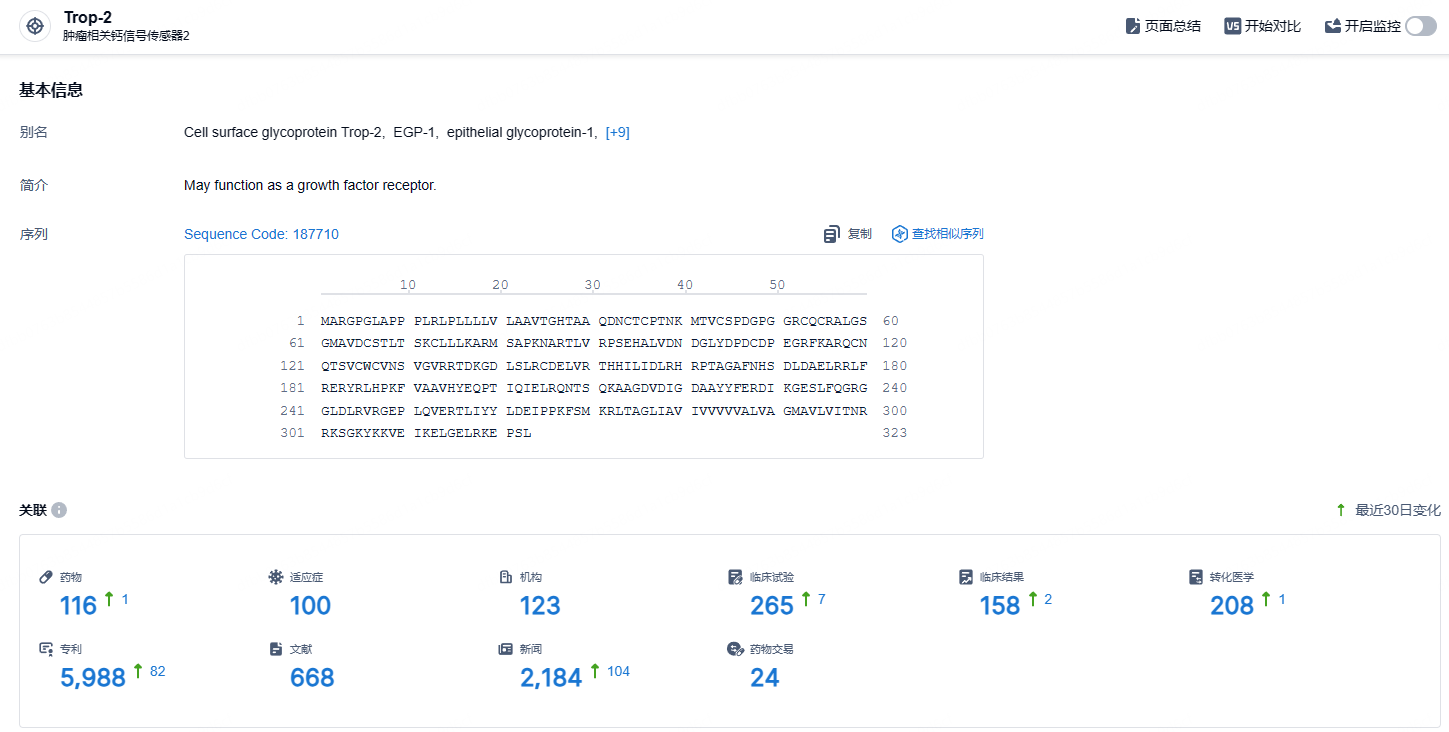
根据智慧芽新药情报库所披露的信息 (点击下方图片直达TROP2 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年8月21日,TROP2 靶点共有在研药物116个,包含的适应症有100种,在研机构123家,涉及相关的临床试验265件,专利多达5988件……芦康沙妥珠单抗是科伦博泰拥有自主知识产权的核心产品之一,该药在乳腺癌、胃癌、肺癌等领域展现出优秀的治疗潜力,期待该药早日成功上市。