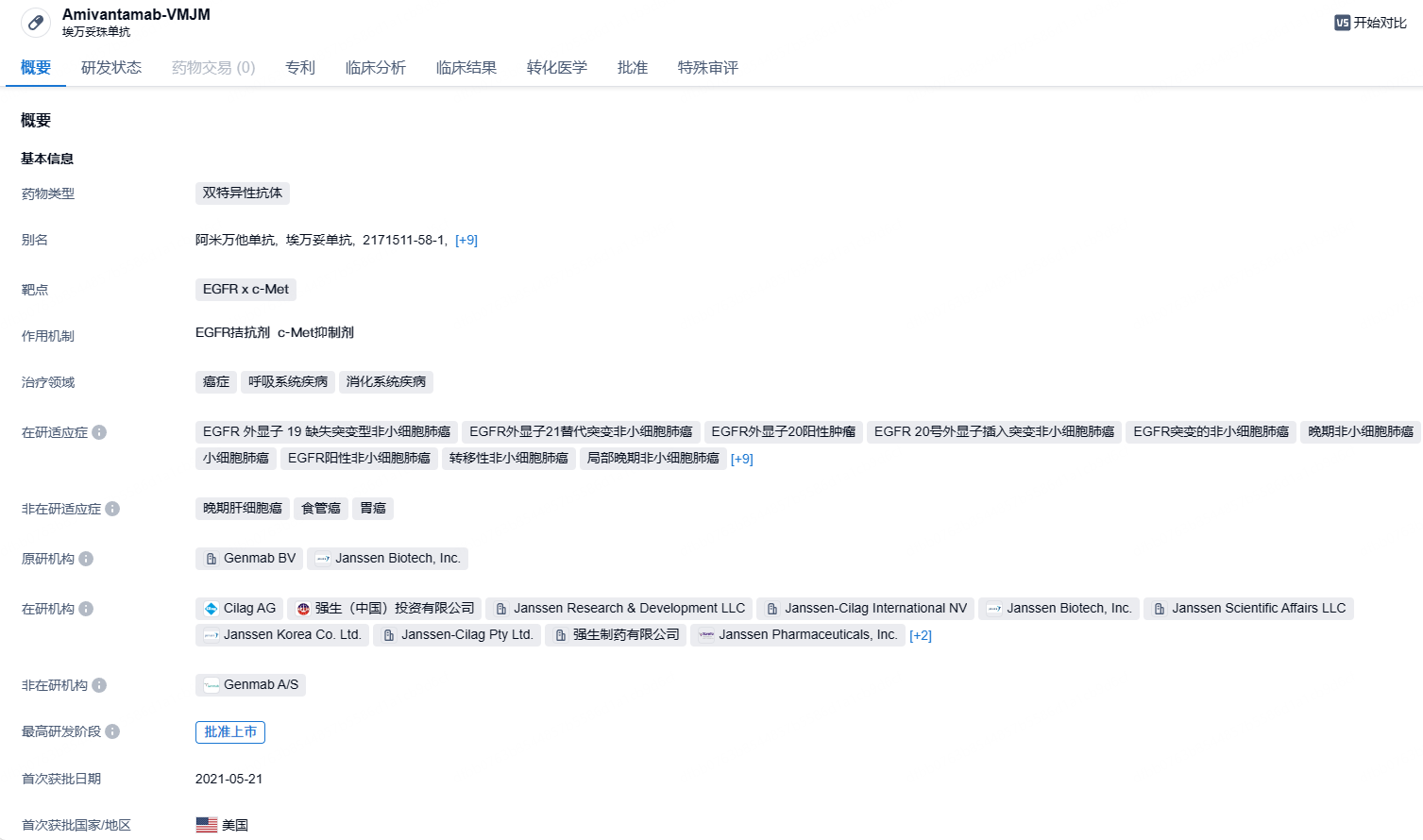
强生EGFR/c-Met双抗埃万妥单抗联合化疗获批二线治疗NSCLC
9月20日,强生宣布FDA已批准其EGFR/c-Met双抗Rybrevant(amivantamab-vmjw,埃万妥单抗)与标准化疗(卡铂+培美曲塞)联合治疗EGFR外显子19缺失(ex19del)或L858R替代突变的、在接受EGFR-TKI治疗期间或之后进展的局部晚期或转移性NSCLC成年患者。
埃万妥单抗(amivantamab)是一种人源化EGFR x c-Met双特异性抗体药物。抗癌作用机制复杂,既可以阻断EGFR和MET所介导的信号传导,又能引导免疫细胞靶向携带激活性和抗性EGFR/MET突变和扩增的肿瘤。2021年5月,amivantamab在美国FDA获得了上市批准,主要用以治疗在铂类化疗期间或之后进展的EGFR外显子20插入突变NSCLC患者。2020年3月,美国FDA授予埃万妥单抗突破性疗法认定,用于治疗特定NSCLC患者。2023年8月,该产品还向FDA递交了补充生物制品许可申请(sBLA),与化疗联用一线治疗携带EGFR外显子20插入突变的局部晚期或转移性NSCLC患者。此次是Rybrevant获批的第3个适应症,前两项分别为:1)联合化疗一线治疗EGFR外显子20插入突变的局部晚期或转移性NSCLC,获批于今年3月;2)联合第三代EGFR抑制剂Lazcluze(lazertinib,兰泽替尼)一线治疗伴有EGFR外显子19缺失或外显子21 L858R置换突变的局部晚期或转移性NSCLC。
此次批准基于III期MARIPOSA-2(NCT04988295)研究的结果,该研究评估了Rybrevant联合化疗治疗奥希替尼进展后伴有EGFR ex19del或L858R替代突变的局部晚期或转移性的NSCLC成人患者的疗效和安全性。结果显示,Rybrevant联合化疗的中位PFS为6.3个月,而只接受化疗的患者中位PFS为4.2个月,即将疾病进展或死亡的风险降低了52%,这是该研究的主要终点。此外,Rybrevant联合化疗的客观缓解率(ORR)为 53%,而化疗组为29%。
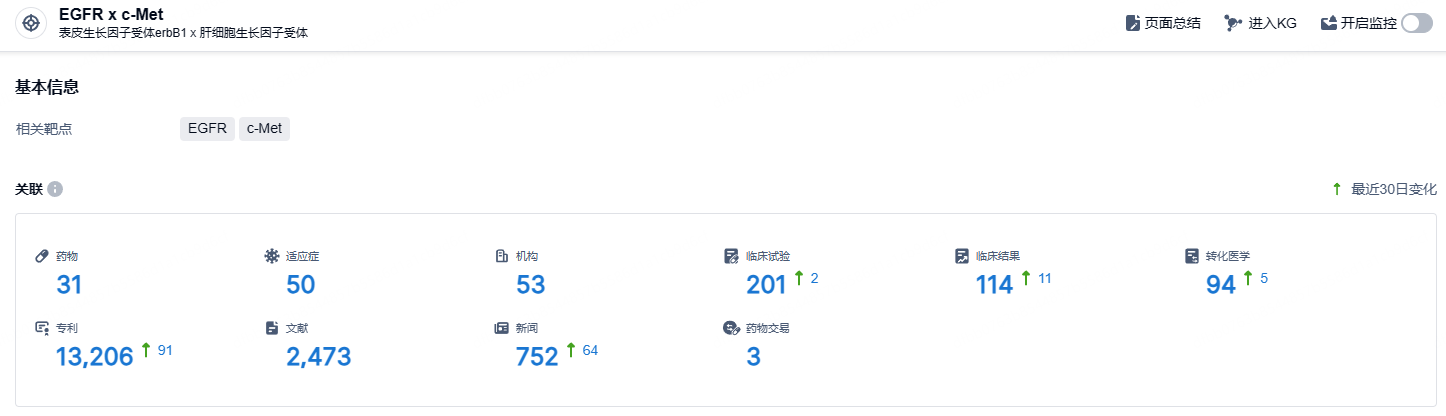
根据智慧芽新药情报库所披露的信息 (点击下方图片直达EGFR x c-Met靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年9月22日,EGFR x c-Met靶点共有在研药物31个,包含的适应症有50种,在研机构53家,涉及相关的临床试验201件,专利多达13206件……由于Amivantamab优异的数据,预期EGFR/c-Met双抗药物有可能成为EGFR领域下一代的主要产品。在国内,多家公司如岸迈生物、贝达药业、嘉和生物、和翰森制药等都在EGFR/c-Met领域进行布局,期待它们的新药在未来能有好的表现。