恒瑞医药PD-1卡瑞利珠单抗组合疗法重新在美申报上市,一线治疗肝癌
10月15日,恒瑞医药发布一则公告宣布已收到FDA的确认函,重新提交的PD-1单抗注射用卡瑞利珠单抗联合甲磺酸阿帕替尼片用于不可切除或转移性肝细胞癌患者的一线治疗的生物制品许可申请(BLA)获FDA受理。根据《处方药用户付费法案(PDUFA)》,FDA对注射用卡瑞利珠单抗的目标审评日期为2025年3月23日。
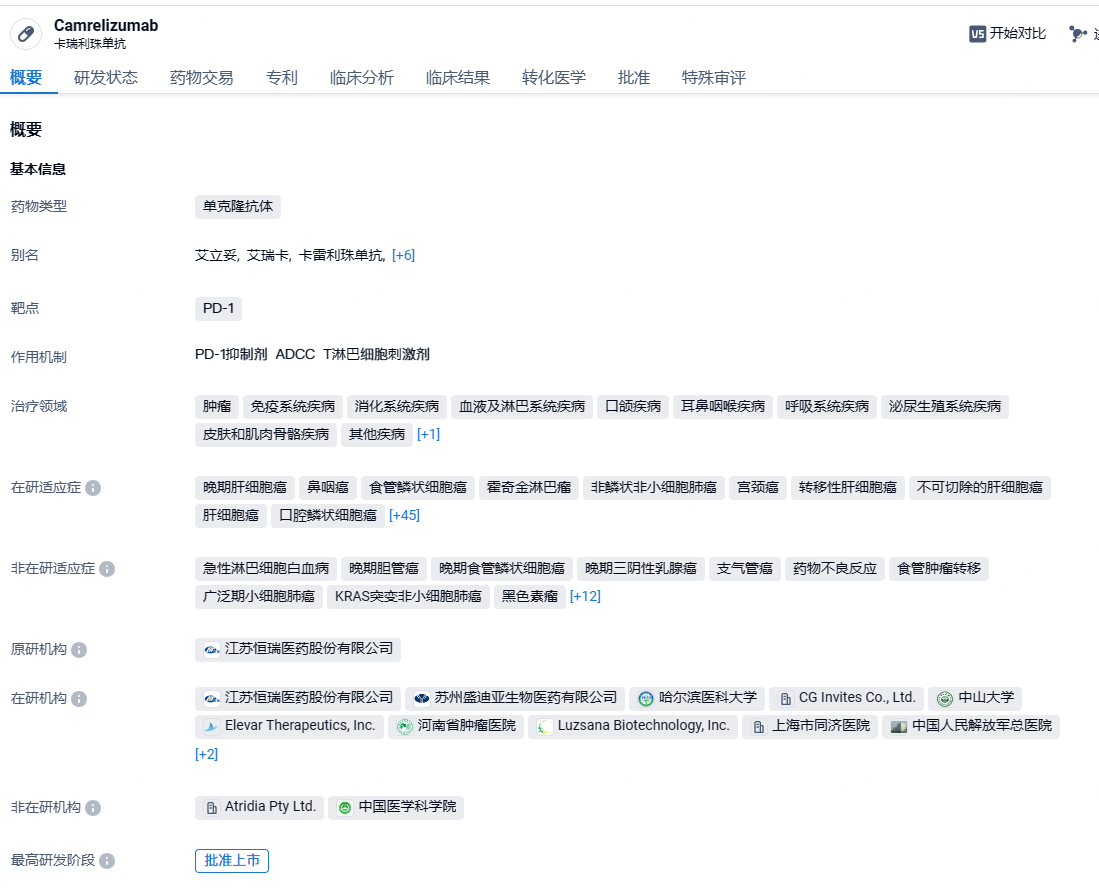
卡瑞利珠单抗为恒瑞医药自主研发的一款人源化抗PD-1单克隆抗体,已获批9个适应症,涉及经典型霍奇金淋巴瘤、肝细胞癌、鳞状/非鳞状非小细胞肺癌、食管鳞癌、鼻咽癌等不同肿瘤。卡瑞利珠单抗是中国首个获批肝癌、肺癌及食管癌,全球首个获批一线鼻咽癌适应症的PD-1单抗,新适应症扩展迅速,仅2021年就有4项新适应症获批。
目前注射用卡瑞利珠单抗医保适应症:
1、本品用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。
2、本品用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。
3、本品联合培美曲塞和卡铂适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。
4、本品用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。
5、本品用于既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者的治疗。
6、本品联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗。
7、本品联合紫杉醇和卡铂用于局部晚期或转移性鳞状非小细胞肺癌患者的一线治疗。
8、本品联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗。
9、本品联合甲磺酸阿帕替尼⽤于不可切除或转移性肝细胞癌患者的⼀线治疗。
2023年10月,恒瑞医药与Elevar Therapeutics达成许可协议,授予后者卡瑞利珠单抗肝癌联合疗法在除大中华区和韩国以外的全球开发和商业化独家权利。进入商业销售阶段以后,Elevar Therapeutics将在达到一定累计净销售额后向恒瑞医药支付累计6亿美元的销售里程碑款,并在超过一定累计净销售额后额外付款;此外,Elevar Therapeutics将向恒瑞医药支付达到实际年净销 售额20.5%的销售提成。
2024年5月17日,Elevar Therapeutics的母公司HLB-LS宣布收到FDA就卡瑞利珠单抗联合阿帕替尼用于一线治疗不可切除肝细胞癌(HCC)患者的新药申请(NDA)发出的完整回复函(CRL)。FDA在CRL中主要强调了两项内容:①化学、制造和控制(CMC)问题;②FDA对在俄罗斯和乌克兰的关键临床试验中心的检查尚未完成。
该NDA主要是基于III期CARES-310研究的积极结果。该研究是一项国际多中心、随机、开放标签临床试验,纳入了543例既往未接受过系统治疗的晚期HCC患者,评估了卡瑞利珠单抗+阿帕替尼对比索拉非尼治疗这类患者的安全性和有效性。研究的主要终点为无进展生存期(PFS)和总生存期(OS)。结果显示,与索拉非尼组相比,卡瑞利珠单抗+阿帕替尼组患者的PFS显著延长(5.6 vs. 3.7个月,HR=0.52,单侧p值<0.0001),OS亦显著延长(22.1 vs. 15.2个月,HR=0.62,单侧p值<0.0001)。此外,卡瑞利珠单抗+阿帕替尼组经确认的客观缓解率(ORR)为25.4%,而索拉非尼组这一数据为5.9%。
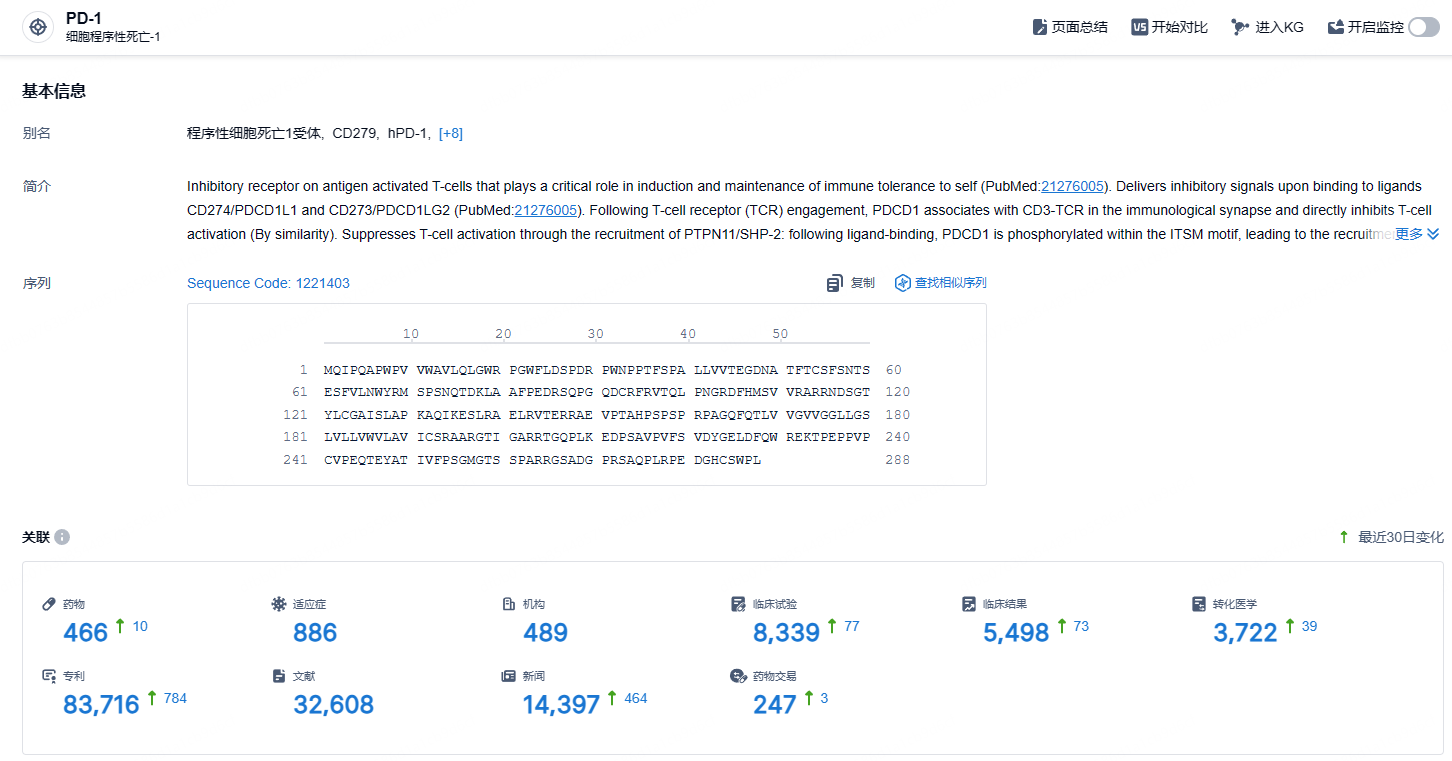
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年10月16日,PD-1 靶点共有在研药物466个,包含的适应症有886种,在研机构489家,涉及相关的临床试验8339件,专利多达83716件……PD-1靶点是研发非常火热的领域,恒瑞的卡瑞利珠单抗是国产新药的明星产品。根据相关统计,该药在国内预计年销售额峰值超过50亿元,期待其联合疗法在不同癌种中的优秀表现。