Checkpoint公布PD-L1抑制剂cosibelimab最新临床试验数据,治疗恶性皮肤癌
近日,Checkpoint Therapeutics公布了其在研PD-L1抑制剂cosibelimab在针对局部晚期和转移性皮肤鳞状细胞癌(cSCC)的关键性研究中获得的长期数据。最新结果表明,随着时间的推移,病情的缓解程度加深,完全缓解率大幅高于先前的报道。
cosibelimab是Checkpoint Therapeutics开发的一种高亲和力的全人类IgG1亚型单克隆抗体,可直接与PD-L1结合;该药剂可阻断PD-L1与PD-1和B7.1受体的互动。该药的主要作用机制是基于抑制PD-L1与这些受体之间的相互作用,从而根除PD-L1对抗肿瘤CD9阳性T细胞的抑制作用,恢复细胞毒性T细胞反应。cosibelimab与目前上市的PD-1和PD-L1抗体的潜在差异在于它具有持续性、超过99%的目标肿瘤占位率(tumor occupancy),可以重新激活抗肿瘤免疫反应,此外它还具有能够诱导抗体依赖性细胞介导的细胞毒性(ADCC)的功能性Fc结构域,从而在某些肿瘤类型中发挥更为强大的疗效。2023年1月4日,Checkpoint Therapeutics宣布向FDA递交Cosibelimab用于不适合接受治愈性手术或放射治疗的转移性皮肤鳞状细胞癌(CSCC)或局部晚期CSCC的生物制品许可申请(BLA)。2023年3月,美国FDA接受了该BLA申请,PDUFA目标日期设定为2024年1月3日。
此前,2022年1月,Checkpoint Therapeutics宣布评估cosibelimab(固定剂量800mg,每2周一次)治疗转移性CSCC的注册临床试验取得积极结果:采用实体瘤疗效评价标准1.1版(RECISTv1.1),对转移性CSCC队列入组的78例患者进行独立中心审查,Cosibelimab治疗的ORR为47.4%。在数据截止时,76%的缓解仍在持续,中位缓解持续时间(DOR)尚未达到。基于该实验积极结果,Checkpoint Therapeutics递交了cosibelimab的上市申请。
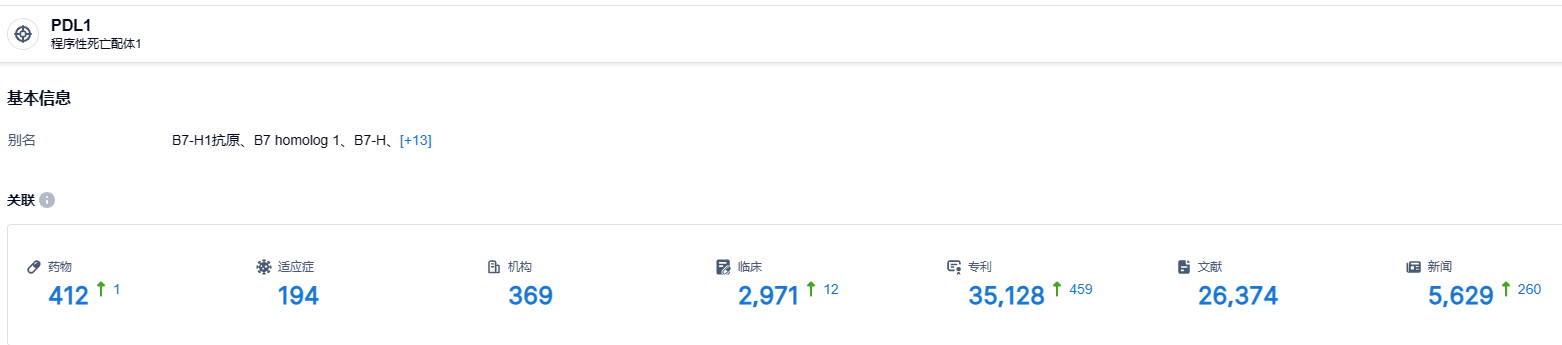
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PDL1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月1日,PDL1 靶点共有在研药物412个,包含的适应症有194种,在研机构369家,涉及相关的临床试验2971件,专利多达35128件……期待cosibelimab能够早日上市,给患者带来新的治疗选择。





