预约演示
最新资讯
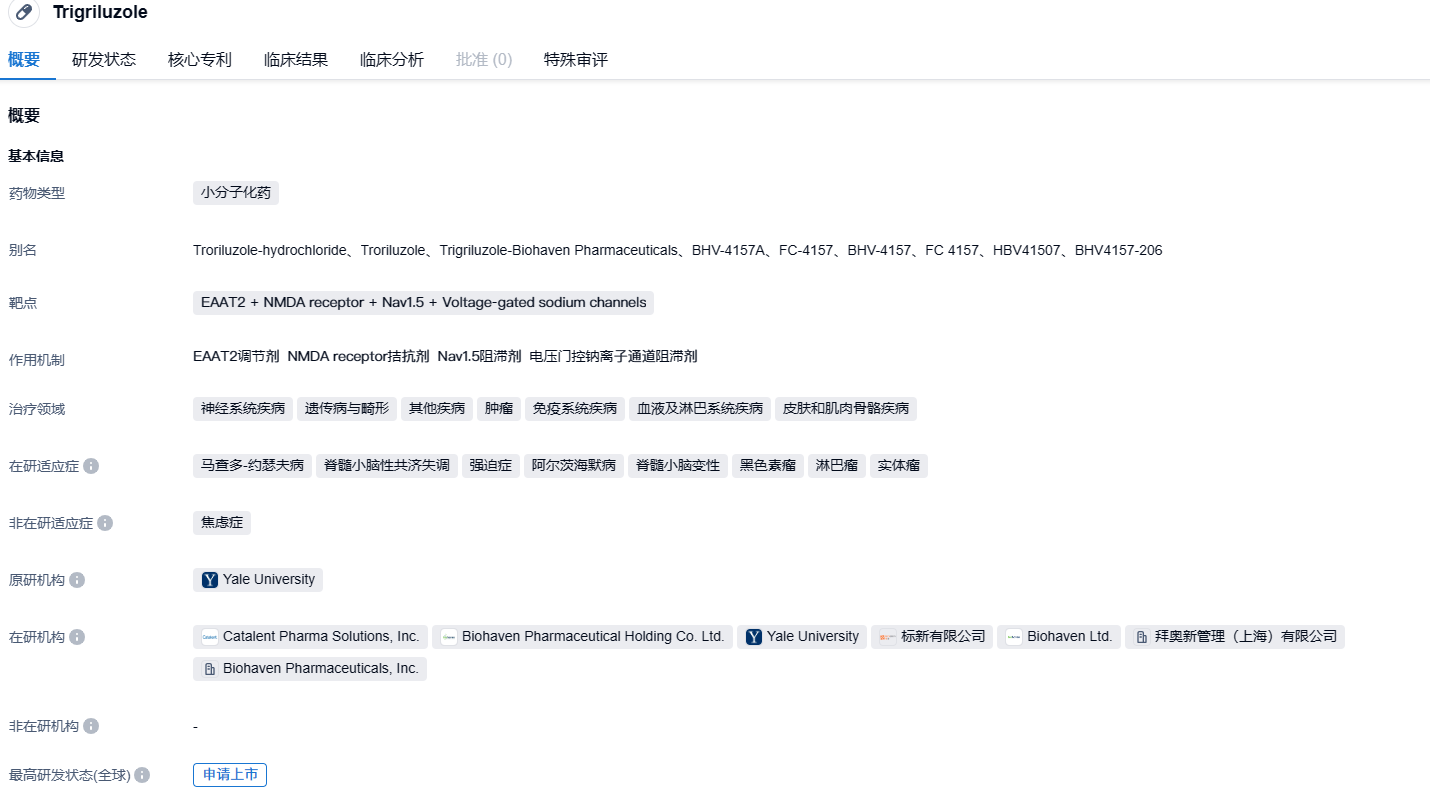
FDA拒绝受理Biohaven旗下EAAT2调节剂trigriluzole上市申请
2023-07-29
阅读时长 2分钟
2023年7月27日,Biohaven宣布,FDA拒绝受理trigriluzole用于治疗脊髓小脑性共济失调(SCA)的新药申请(NDA),原因为trigriluzole治疗SCA的III期BHV4157-206研究未达主要终点。
trigriluzole由BioHaven Pharmaceutical公司开发,该药属于利鲁唑的前药,第三代兴奋性氨基酸转运蛋白2(EAAT2)调节剂,可调节人体主要的兴奋性神经递质谷氨酸水平,可用于治疗运动失调和阿尔茨海默症等疾病的治疗。该分子通过增加神经胶质细胞中EAAT的表达并增强其功能来增加神经元突触对谷氨酸的摄取,从而降低神经元突触中的谷氨酸水平。
BHV4157-206研究是一项随机、双盲、安慰剂对照的III期临床试验,共纳入218例成年SCA患者,旨在评估trigriluzole(200mg)的疗效和安全性。研究的主要终点为修订版共济失调功能评定量表(f-SARA)总分相比于基线的变化。结果显示,在总体SCA人群中,trigriluzole组与安慰剂组患者的f-SARA评分变化均为4.9分,无显著统计学差异。
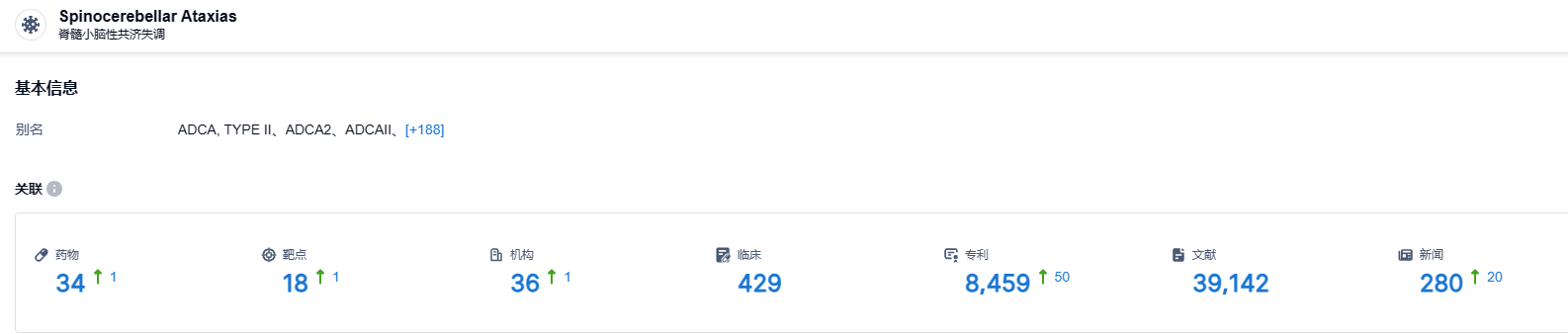
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 脊髓小脑性共济失调 适应症注册登录后可免费获得该适应症下的在研药物、靶点、研发机构、临床试验等详细信息),截止2023年7月29日,脊髓小脑性共济失调 适应症共有在研药物34个,包含的靶点有18种,在研机构36家,涉及相关的临床试验429件,专利8459件……新药研发成本高,难度大,上市申请被拒绝给trigriluzole的后续开发蒙上了阴影。

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
继续阅读
返回博客首页 →最新资讯
阅读时长 2分钟
UroGen Pharma膀胱癌新药UGN-102达到两项3期临床试验主要终点
2023-07-29
UroGen Pharma公司宣布,在研疗法UGN-102(丝裂霉素)在治疗低分级、中危非肌层浸润性膀胱癌(LG-IR-NMIBC)患者的两项3期临床试验ATLAS和ENVISION中达到主要终点。该公司预计在2024年递交新药申请(NDA)。
最新资讯
阅读时长 2分钟
礼来GIP/GLP-1受体激动剂tirzepatide两项关键3期临床试验积极,减重效果显著
2023-07-29
2023年7月28日,礼来(Eli Lilly and Company)公布其葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂tirzepatide在两项3期试验SURMOUNT-3和SURMOUNT-4中的积极结果。分析显示,tirzepatide在两项试验中达到所有主要和关键次要终点。肥胖或超重成人患者(伴有不包含2型糖尿病的体重相关共病)在强化生活方式干预并接续使用tirzepatide治疗后,平均体重下降达26.6%。
最新资讯
阅读时长 2分钟
默沙东21价肺炎球菌疫苗V116两项3期临床试验结果积极,有望成功获批
2023-07-29
默沙东(MSD)公司宣布,在研21价肺炎球菌结合疫苗V116在两项3期临床试验(STRIDE-3和STRIDE-6)中获得积极结果,在未接种过疫苗和曾接种疫苗的个体中均激发显著免疫应答。如果获批,V116将是首个专门为成人设计的肺炎球菌结合疫苗。
最新资讯
阅读时长 2分钟
Viage Therapeutics口服阿尔茨海默病疗法DGX-001在1期临床试验中获得积极结果
2023-07-28
2023年7月27日,Viage Therapeutics公司宣布,其潜在“first-in-class”口服疗法DGX-001在1期临床试验中获得积极结果,DGX-001显示了良好的安全性特征。基于这些结果,该公司计划启动2期临床试验,在由于阿尔茨海默病或帕金森病出现轻中度认知障碍的患者中检验这款疗法的效果。
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。