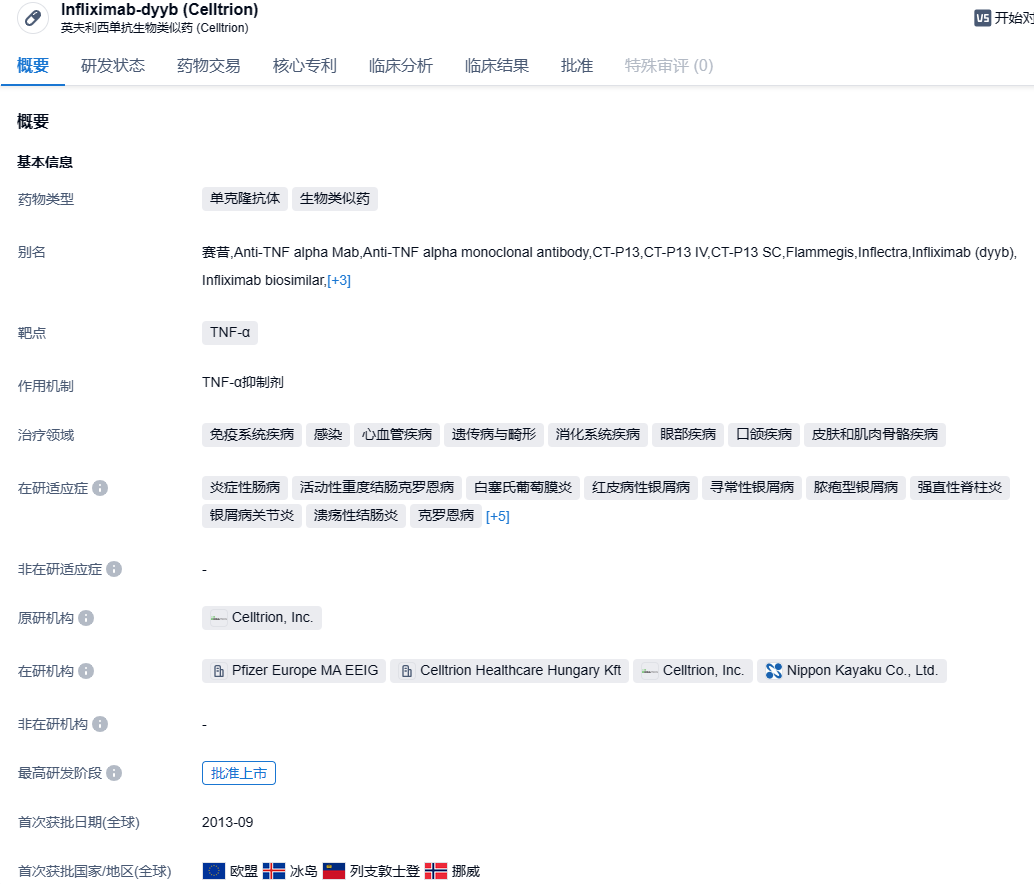
首款!Celltrion公司英夫利西单抗皮下制剂获FDA批准,治疗炎症性肠病
2023年10月25日,Celltrion公司宣布,美国FDA已批准Zymfentra(infliximab,英夫利西单抗)用于中重度活动性溃疡性结肠炎(UC)和克罗恩病(CD)成人患者在接受静脉给予英夫利西单抗治疗后的维持治疗。根据新闻稿,Zymfentra是获FDA批准用以治疗炎症性肠病(IBD)的首个英夫利西单抗皮下制剂。
英夫利西单抗(原研药商品名:Remsima)的原研企业为强生,是一种抗肿瘤坏死因子(TNF-α)单克隆抗体,用于治疗CD、UC、类风湿性关节炎以及强直性脊柱炎等患者。Zymfentra是Celltrion开发的首个抗体生物类似药,目前已获批用于常规治疗无效的中、重度IBD,是治疗IBD的四种主流生物制剂之一。
Zymfentra皮下制剂可提供血清中稳定升高的infliximab单抗水平。这次FDA批准Zymfentra上市主要是基于3期关键性数据,这些数据评估了Zymfentra作为中重度活动性UC(LIBERTY-UC)和CD(LIBERTY-CD)患者维持治疗的疗效和安全性。基于LIBERTY UC和LIBERTY CD研究的结果,在UC和CD患者接受infliximab单抗静脉制剂诱导治疗后,为期54周的研究显示,与安慰剂相比,Zymfentra在主要终点临床缓解(UC和CD)和内镜下缓解(CD)方面具有优效性。在两项研究中,维持期Zymfentra的总体安全性特征与安慰剂相似,未观察到新的安全性信号。
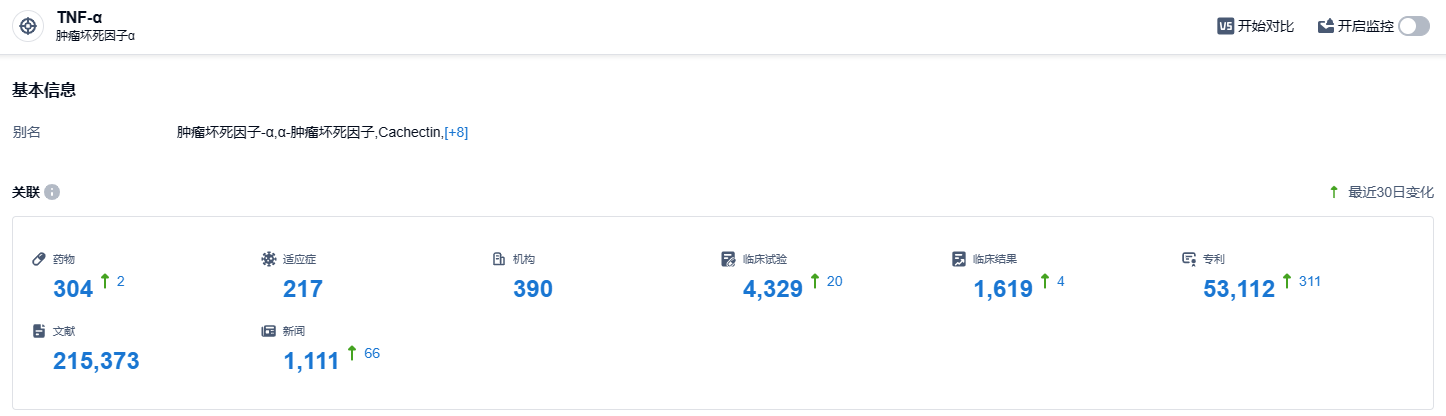
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达TNF-α靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月26日,TNF-α靶点共有在研药物304个,包含的适应症有217种,在研机构390家,涉及相关的临床试验4329件,专利多达53112件……Zymfentra皮下制剂改善了原静脉注射给药的缺点,让患者可自行注射给药,从而减少去医院的次数,提高了患者用药的便利性。同时,新剂型也为医生提供一种替代性的给药选择,克服了TNF-α抑制剂的局限性。期待更多患者能够因此受惠。