邦耀生物口头报告CAR-T产品BRL-201最新临床数据,治疗非霍奇金淋巴瘤
2023年11月6日,邦耀生物发布新闻稿称,其首席执行官(CEO)郑彪博士近日出席了第38届癌症免疫治疗学会(SITC)年会,现场口头报告了CAR-T细胞产品BRL-201治疗复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)的最新临床进展数据。
BRL-201是利用邦耀生物自主研发的非病毒定点整合CAR-T平台(Quikin CART®)开发的CAR-T产品,这也是世界首个靶向CD19非病毒PD1定点整合的CAR-T产品,适应症为复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)。PD-L1/PD-1信号通路是抑制T细胞功能的重要免疫检查点,研究显示敲除PD-1可有效增强CAR-T细胞的功能。BRL-201直接用CRISPR/Cas9基因编辑技术对T淋巴细胞中PD-1位点精确编辑,定点插入针对肿瘤细胞的靶向CD19的CAR分子,因此效果比一般CAR-T更好。同时,由于不需要病毒载体,该产品的工艺相对简单,不仅缩短了病人的等待时间,也降低了生产成本。而且非病毒定点整合可以让每个CAR序列都精确地插入到基因组的特定位点,避免随机插入导致的致瘤风险,进一步提高了CAR-T产品的安全性。
在本次会议中公布的是BRL-201在开展的IIT研究中的最新临床数据,共入组21例患者,包含19例(90%)患者被诊断为III期或IV期,具备中度或更严重的疾病风险;并且4例患者治疗前的淋巴瘤组织中PD-L1表达率大于50%。结果表明,即使患者本身预期的预后较差,但经非病毒PD1-CAR-T细胞产品BRL-201治疗后仍取得了满意的疗效,患者客观缓解率(ORR)高达100%,完全缓解率(CR)达到85.7%。在取得显著疗效的同时,未在任何患者中引起2级以上的细胞因子释放综合征或神经毒性;截止2023年5月17日,中位无进展生存期(mPFS)达到了20.8个月,患者长期获益显著高于现有同类病毒CAR-T产品。至今,全球首位接受邦耀生物BRL-201治疗的患者已无癌生存超过3年。此项研究证明了BRL-201产品出色的临床安全性和有效性。
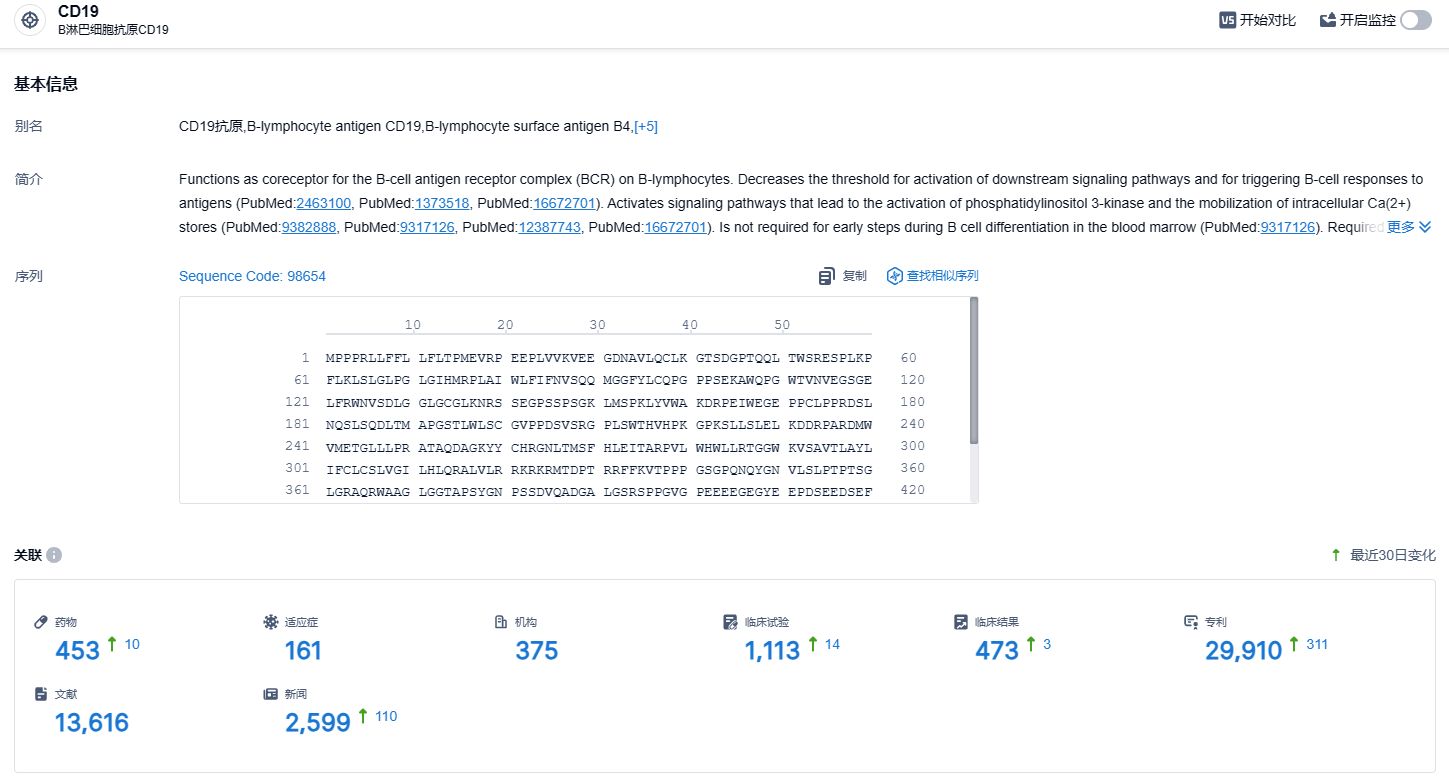
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月8日,CD19靶点共有在研药物453个,包含的适应症有161种,在研机构375家,涉及相关的临床试验1113件,专利多达29910件……BRL-201的研究成果已在国际学术期刊《Nature》发表,并在中国获批进入注册临床阶段,期待其后续研发顺利。