2023 SITC年会 | 君实生物公布PD-1抑制剂特瑞普利单抗最新临床结果
近日,君实生物PD-1抑制剂特瑞普利单抗联合抗EGFR单抗西妥昔单抗治疗复发或转移性头颈部鳞状细胞癌(R/M-HNSCC)的1b/2期临床研究结果,在2023年第38届癌症免疫治疗学会(SITC)年会上壁报展示。结果显示,总体人群的客观缓解率(ORR)达60%,患者实现肿瘤长期缓解,中位缓解持续时间(DoR)达17.9个月。
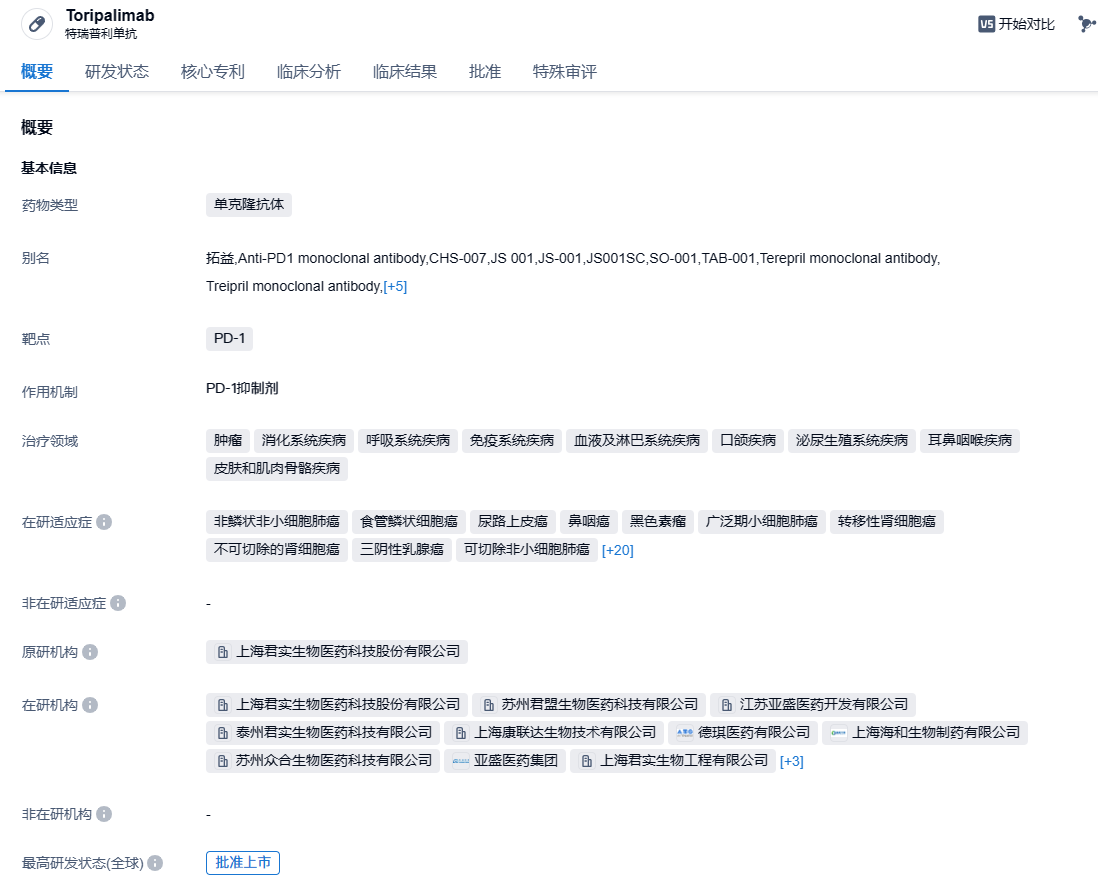
特瑞普利单抗是我国批准上市的首个国产以PD-1为靶点的单抗药物,由本土创新药企君实生物独立研发,用于多种恶性肿瘤治疗。至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由君实生物发起的临床研究。截至目前,该药已在中国获批6项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非鳞状非小细胞肺癌几大癌种。在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
此次研究人员在SITC大会上详细报告了特瑞普利单抗联合西妥昔单抗治疗既往铂类治疗失败的R/M-HNSCC患者的1b/2期临床研究队列A数据。其中,研究队列A纳入接受一线含铂方案治疗后进展的R/M-HNSCC以及含铂新辅助/辅助或放化疗治疗6个月内进展为R/M-HNSCC的患者,所有患者接受特瑞普利单抗和西妥昔单抗联合治疗。主要研究终点为独立审查委员会(IRC)根据RECIST v1.1标准评估的ORR。次要终点包括研究者评估的ORR、疾病控制率(DCR)、DoR、无进展生存期(PFS)、总生存期(OS)和安全性等。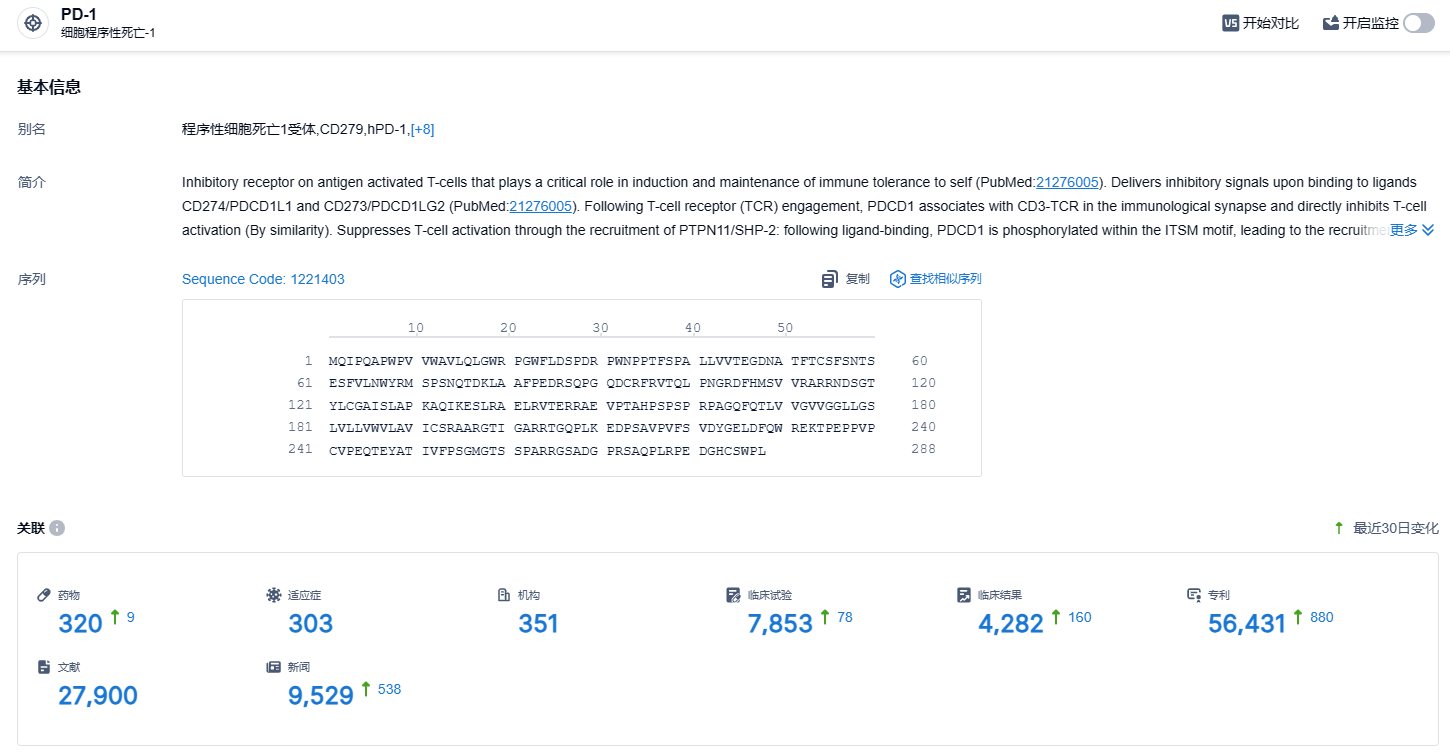
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月7日,PD-1靶点共有在研药物320个,包含的适应症有303种,在研机构351家,涉及相关的临床试验7853件,专利多达56431件……PD-1靶点是研发非常火热的领域,君实的特瑞普利单抗是国产新药的明星产品,期待该药的后续表现。