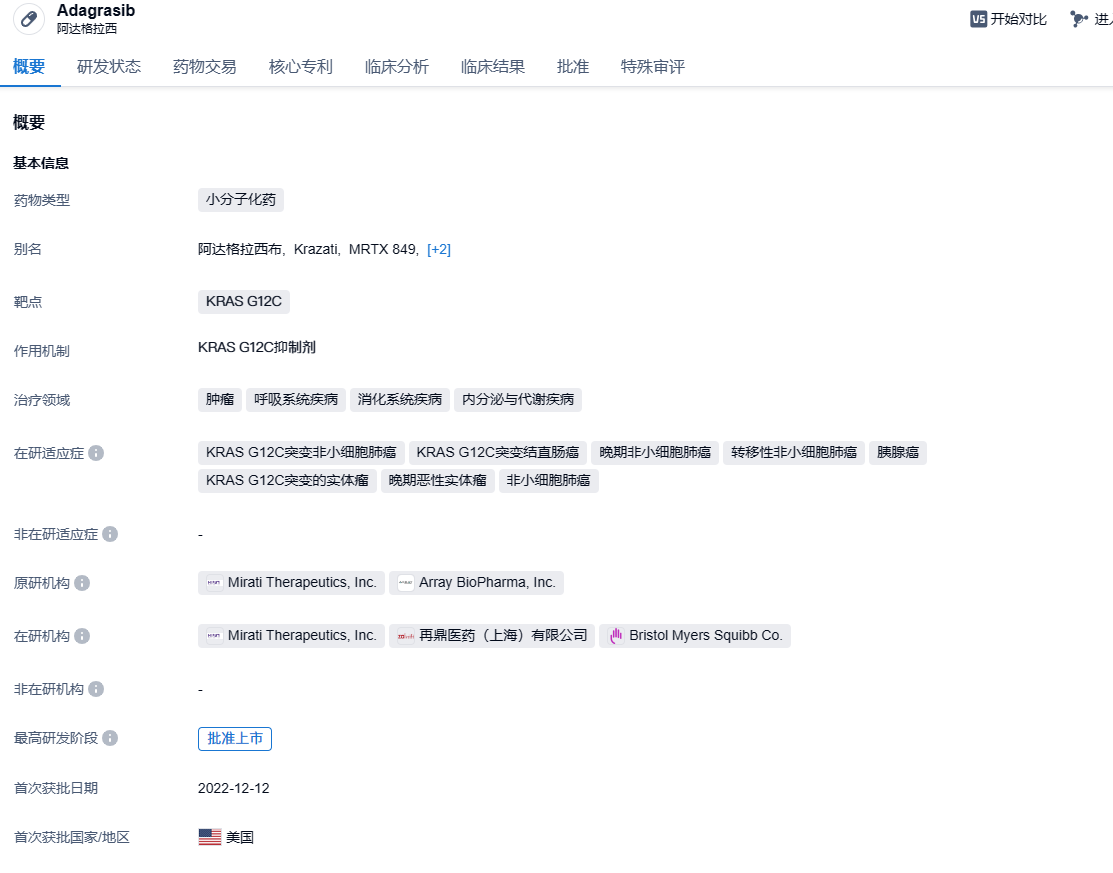
百时美施贵宝KRAS G12C抑制剂adagrasib联合疗法获优先审评资格,针对结直肠癌
2024年2月21日,百时美施贵宝(Bristol Myers Squibb)宣布,美国FDA已接受其KRAS G12C抑制剂Krazati(adagrasib)与西妥昔单抗(cetuximab)联合用以治疗肿瘤带有KRAS G12C突变的经治晚期或转移性结直肠癌(CRC)的补充新药申请(sNDA),并授予该申请优先审评资格。该申请的PDUFA目标日期为2024年6月21日。
Adagrasib (MRTX849) 是一种有效的、口服的KRAS G12C小分子共价抑制剂,在非活性、GDP 结合状态下不可逆地选择性结合 KRAS G12C 。Adagrasib 具有良好的药代动力学特性,包括半衰期长(23 小时)、剂量依赖性和中枢神经系统 (CNS) 渗透性。Adagrasib基于I/II 期KRYSTAL-1研究数据,在2022年12月13日获FDA批准用于治疗携带KRAS G12C突变的局部晚期或转移性NSCLC患者,以上患者既往至少接受过一种全身性疗法。2024年1月11日,欧盟委员会(EC)授予其KRAS G12C抑制剂Krazati(adagrasib)有条件上市许可,作为带有KRAS G12C突变的晚期非小细胞肺癌(NSCLC)成人患者的靶向疗法,这些患者在既往接受过至少一次全身治疗后出现疾病进展。
此次sNDA的提交主要是基于KRYSTAL-1研究的结果,这是一项多队列试验,评估了Krazati作为单药或与其他抗癌疗法联合,用以治疗携带KRAS G12C突变晚期实体瘤患者的疗效与安全性。试验的主要终点是客观缓解率,次要终点包括缓解持续时间、无进展生存期、总生存期和安全性。KRYSTAL-1研究的结果表明,Krazati具有良好的耐受性,并且在携带KRAS G12C突变的局部晚期或转移性的经治CRC患者中具有良好的临床活性。Krazati加西妥昔单抗的安全性是可控的,并且与之前的试验以及每种药物的已知安全性状况一致。
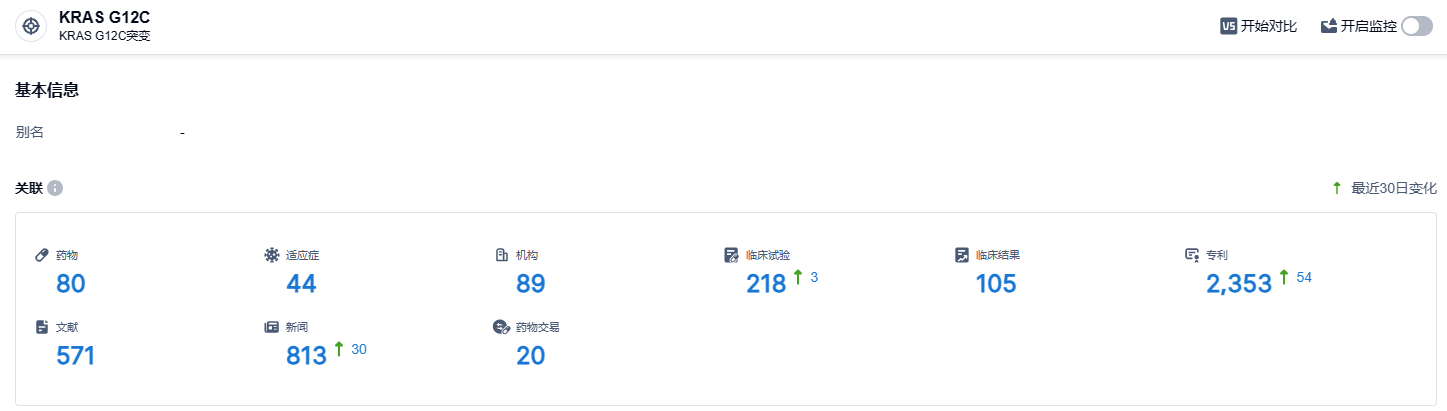
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达KRAS G12C靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年2月23日,KRAS G12C靶点共有在研药物80个,包含的适应症有44种,在研机构89家,涉及相关的临床试验218件,专利多达2353件……2022年12月22日,美国国家综合癌症网络(NCCN;肿瘤诊疗领域最受关注的权威指南之一)发布了2023年首版非小细胞肺癌(NSCLC)临床实践指南,该指南首次推荐TKI类新药Adagrasib(阿达格拉西布)用于KRAS G12C突变NSCLC治疗。此次Adagrasi针对结直肠癌的联合疗法获优先审评资格,有望为该类癌症患者带来新的治疗选择。