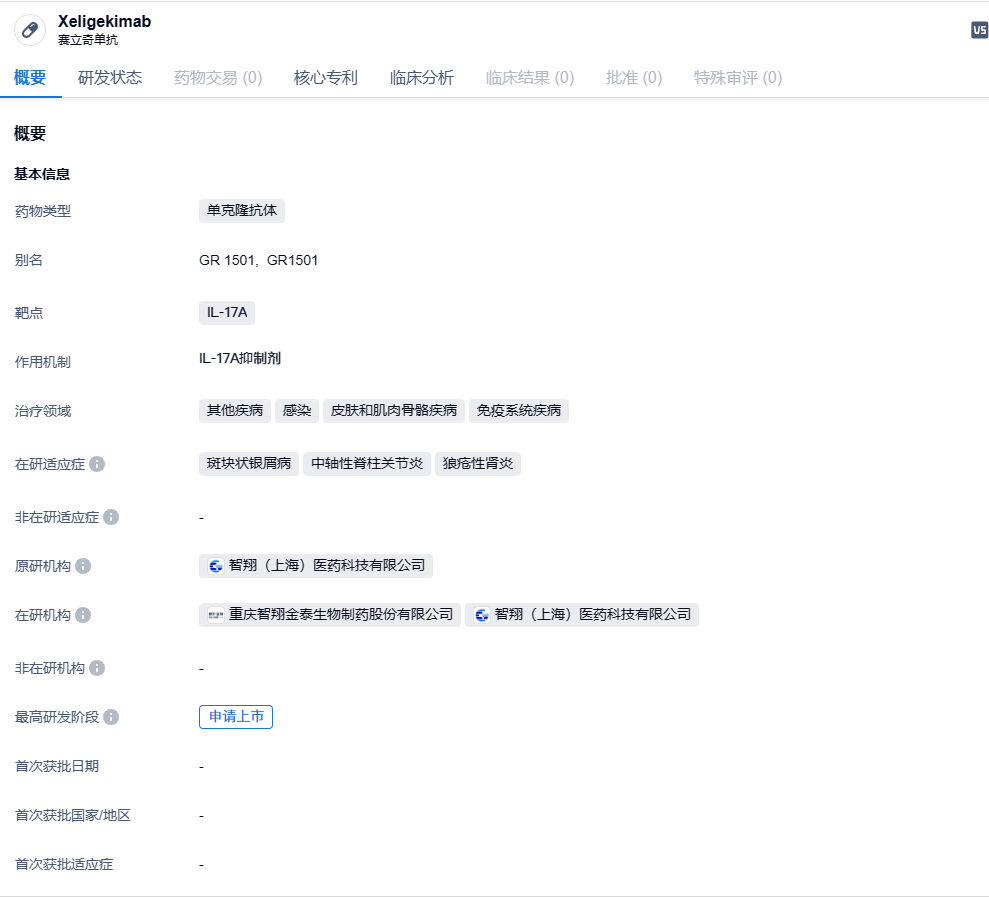
智翔金泰抗IL-17A单抗赛立奇单抗3期临床获积极结果,针对银屑病!
2024年2月19日,智翔金泰宣布其自主研发的抗IL-17A单抗赛立奇单抗(GR1501)注射液针对中、重度斑块状银屑病的3期临床研究取得积极结果,并在国际皮肤病学权威期刊British Journal of Dermatology(BJD)上正式发表。
赛立奇单抗(GR1501)是智翔金泰自主研发的重组全人源抗IL-17A单克隆抗体,通过抗体特异性结合血清中的IL-17A蛋白,阻断IL-17A与IL-17RA的结合,抑制炎症的发生和发展,从而对IL-17A过表达的斑块状银屑病、中轴型脊柱关节炎等自身免疫性疾病达到治疗效果。临床前研究显示,赛立奇单抗可选择性地与IL-17A结合,抑制IL-17RA的下游信号转导,抑制IL-17A诱导的炎性反应。在银屑病患者中开展的研究初步表明,赛立奇单抗治疗患者安全性良好,具有相应治疗效果。2024年1月4日,CDE官网显示,智翔金泰赛立奇单抗注射液上市申请获受理,根据临床试验进展,推测用于治疗放射学阳性中轴型脊柱关节炎患者。这是继中重度斑块状银屑病后,赛立奇单抗第2项申报上市的适应症。
本次在BJD上发表的是一项随机、双盲、安慰剂对照、多中心3期临床研究,旨在评估赛立奇单抗注射液在中国中、重度斑块状银屑病患者中的有效性和安全性。该研究共入组420例患者。临床研究数据显示,中、重度斑块状银屑病患者使用赛立奇单抗后2周迅速起效,在FAS群体中,第12周达到银屑病皮损面积和严重程度指数较基线至少改善75%(PASI 75)的受试者比例为90.7%(安慰剂对照组为8.6%);试验组第12周达到皮损清除/几乎清除(PGA0/1)的受试者比例试验组为74.4%(安慰剂对照组为3.6%),研究达到主要临床终点。同时,该研究也达到了次要临床终点,第12周PASI90应答率为74.4%,PGA0/1和 PASI75/90反应一直持续到第52周。第52周PASI75应答率96.5%,PASI90应答率为84.1%,PGA0/1应答率为83.7%,表现出了显著且持久的疗效。此外,接受赛立奇单抗治疗的受试者中复发的比例较低,用药第52周复发率为0.4%,这表明赛立奇单抗可能具有更好的长期疗效。
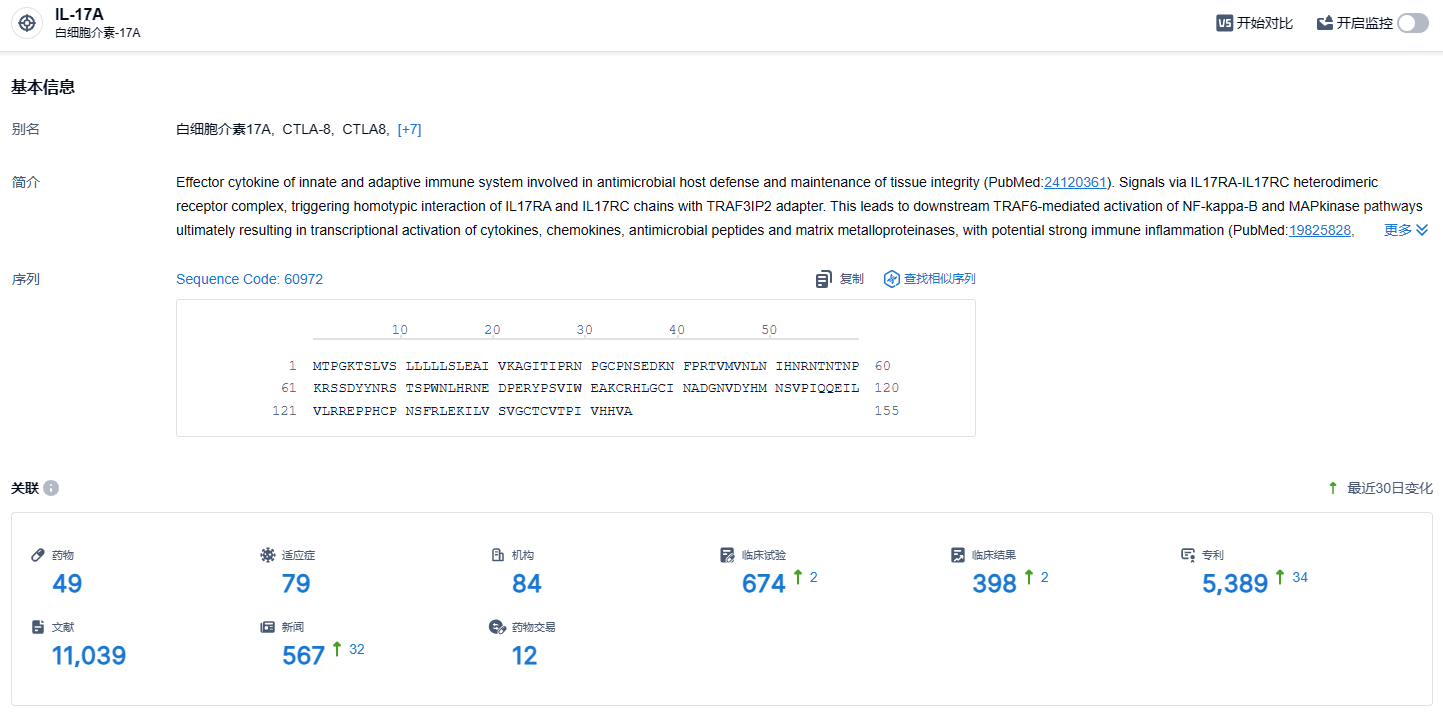
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-17A靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年2月21日,IL-17A靶点共有在研药物49个,包含的适应症有79种,在研机构84家,涉及相关的临床试验674件,专利多达5389件……目前,国内已有3款IL-17类生物制剂获批上市,分别是诺华的司库奇尤单抗(商品名:可善挺)、礼来的依奇珠单抗(商品名:拓咨)以及协和麒麟的布罗利尤单抗(商品名:立美芙)。期待这款国产IL-17类生物制剂赛立奇单抗早日获批上市,为患者带来新的治疗选择。