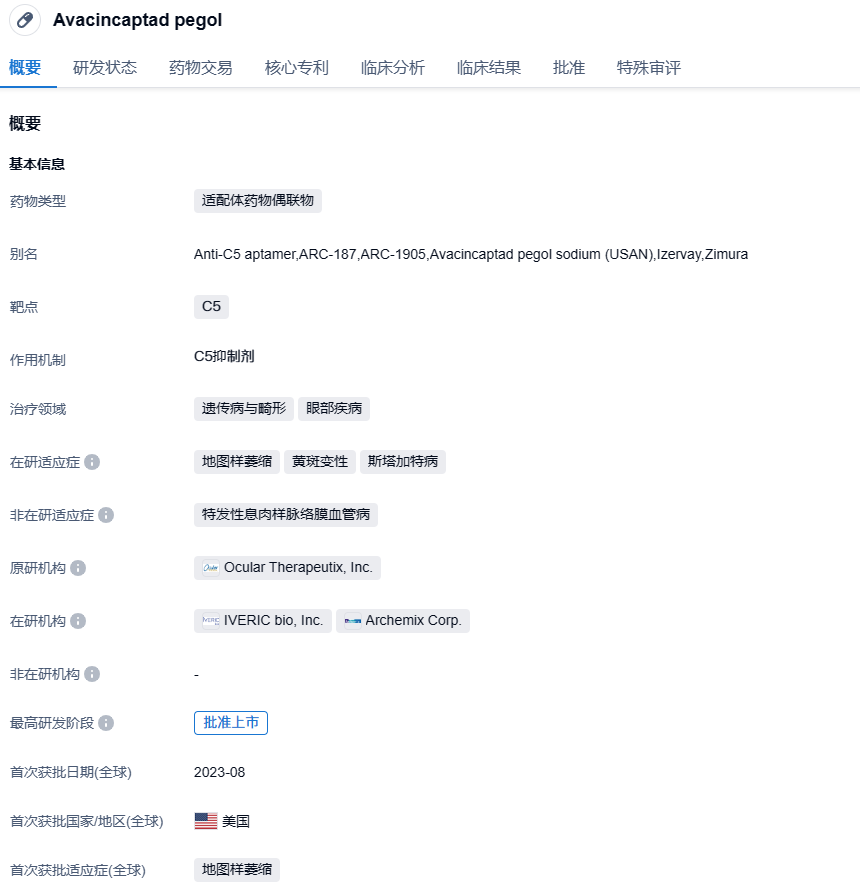
安斯泰来旗下补体C5抑制剂avacincaptad pegol收到FDA完整回复函,针对地图样萎缩
11月19日,安斯泰来宣布美国FDA已于11月15日发布了关于Izervay(avacincaptad pegol)用于治疗年龄相关性黄斑变性(AMD)继发地图样萎缩(GA)的补充新药申请(sNDA)的完整回复函(CRL)。
Avacincaptad pegol是安斯泰来开发的一种新型补体蛋白C5抑制剂,它一款与支化聚乙二醇(PEG)分子共价结合的RNA适配体,能与补体蛋白C5结合并对其产生抑制作用。2023年8月初,该药被FDA批准用于治疗年龄相关性黄斑变性(AMD)引起的地图样萎缩(GA)。2023年4月30日,安斯泰来制药集团和Iveric Bio(NASDAQ:ISEE)宣布,双方于2023年4月29日(日本时间)签订最终协议,根据该协议,安斯泰来通过安斯泰来美国控股公司(Astellas US Holding, Inc.)的全资子公司Berry Merger Sub以每股40.00美元价格的现金收购Iveric Bio 全部已发行股份,总股本价值约为59亿美元(“收购交易”)。通过本次收购交易,Iveric Bio将成为安斯泰来的间接全资子公司,旨在获得潜在的眼科疗法(包含Avacincaptad pegol与基因治疗疗法)。
根据III期GATHER2研究的两年结果,此次安斯泰来的sNDA申请延长Izervay的用药间隔、减少其用药频率。CRL中的FDA意见与Izervay的安全性和获益/风险无关,相反,这些意见侧重于安斯泰来提议的标签语言所涉及的统计问题上。安斯泰来表示正在寻求FDA的进一步澄清,并期待与该机构合作,迅速解决其反馈的问题。Izervay于2023年8月获FDA批准上市,用于治疗AMD继发GA,获批的用药方案是每月给药1次,持续最多1年。GATHER2研究的两年随访结果显示,Izervay在第1年每月给药后,第2年每隔1个月给药1次,患者GA病变的平均生长速率降低了14.3%(p=0.0064)。基于这一结果,安斯泰来向FDA递交了Izervay的sNDA。
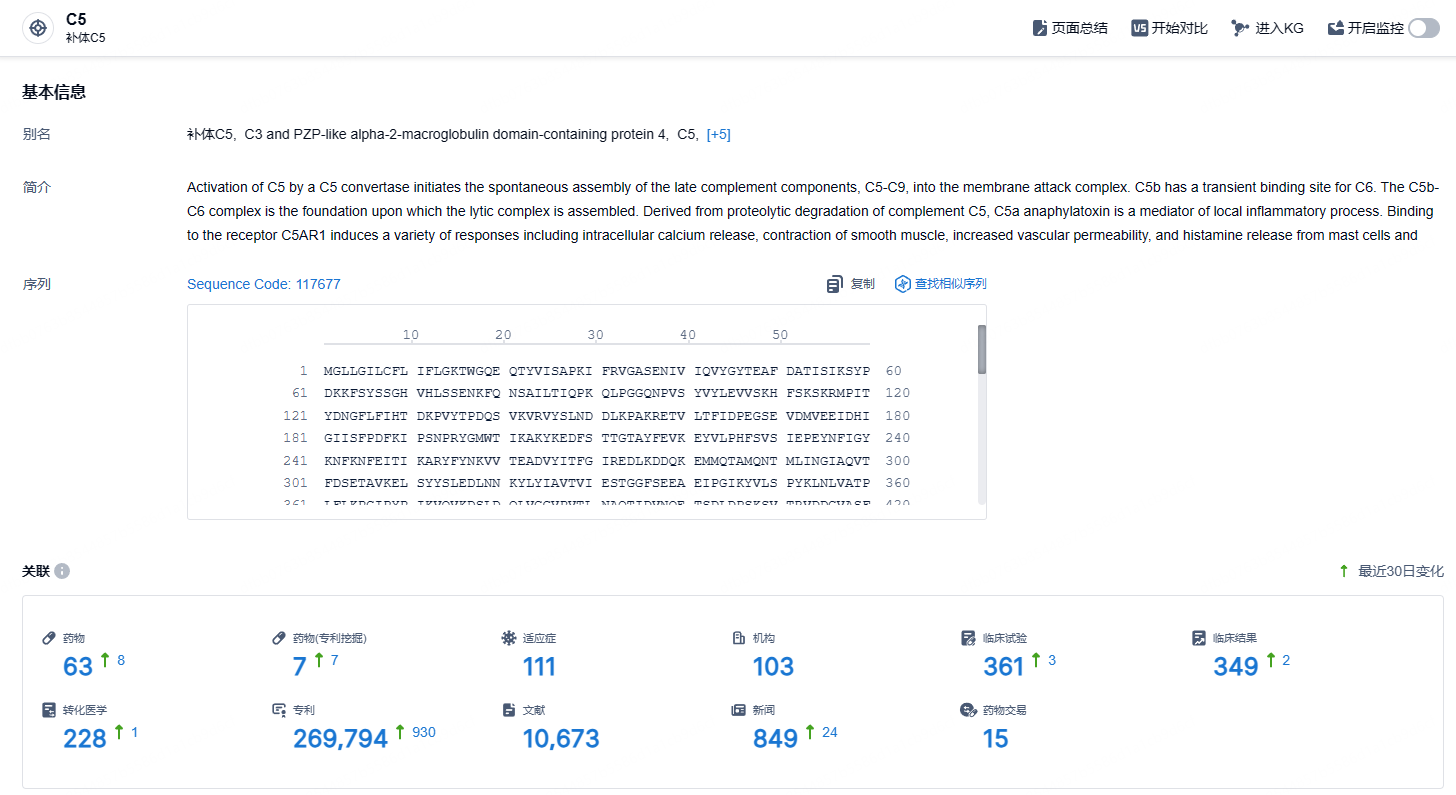
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 C5 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年11月21日,C5 靶点共有在研药物63个,包含的适应症有111种,在研机构103家,涉及相关的临床试验361件,专利多达269794件……地图样萎缩是一种晚期的年龄相关性黄斑变性,是导致患者失明的主要原因,影响全世界超过500万人。期待avacincaptad pegol的能够惠及更多患者。