璧辰医药小分子BRAF抑制剂ABM-1310获FDA孤儿药资格,治疗脑胶质母细胞瘤
2023年8月2日,璧辰医药(ABM Therapeutics)宣布,该公司自主研发的小分子BRAF抑制剂ABM-1310已经获得美国FDA孤儿药资格,用于治疗BRAF V600突变的脑胶质母细胞瘤(GBM)。
ABM-1310是璧辰医药首个自主研发的候选药物,是一种口服的, 具有高选择性、高水溶性、以及高血脑屏障渗透性的小分子BRAF抑制剂,在临床前期研究的动物模型中已显示出血脑屏障渗透方面的独特优势。ABM-1310于2019年11月获得FDA临床试验许可,目前已经在美国进行临床I期试验,美国临床试验登记号为:NCT04190628。2022年9月16日,ABM-1310在中国I期临床试验首例病人成功用药,在中国开展的I期临床是一项多中心、开放性、 剂量递增和扩展的临床研究,旨在探索ABM-1310在BRAF V600X 突变晚期实体瘤患者中的药物安全性、耐受性、药代动力学, 以及初步抗肿瘤活性,为II期临床研究确定最佳剂量和临床初步疗效。
ABM-1310已经在美国和中国多家临床中心开展了针对BRAF V600突变晚期实体肿瘤的临床1期试验。该试验的阶段性研究结果已在2023年美国临床肿瘤学会(ASCO)年会公开发表。临床研究显示,ABM-1310在包括原发性脑肿瘤(包括GBM和其他脑胶质瘤等)在内的晚期实体肿瘤患者中具有良好的抗癌疗效,且安全性、耐受性良好。
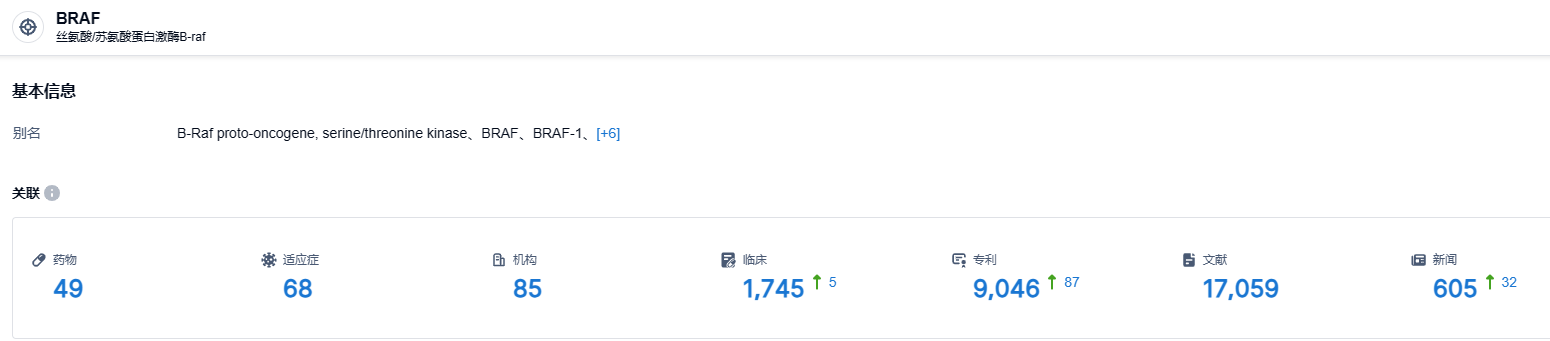
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 BRAF靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月3日,BRAF 靶点共有在研药物49个,包含的适应症有68种,在研机构85家,涉及相关的临床试验1745件,专利多达9046件……期待ABM-1310在中美临床试验的后续表现。