默克KEYTRUDA组合疗法获FDA审查,用于治疗晚期胃癌患者
2023-04-18
临床获批
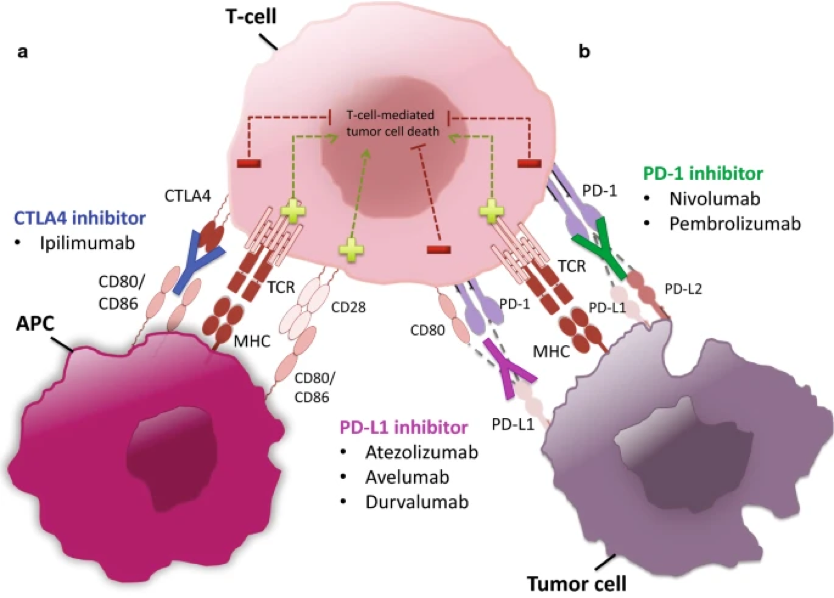
本次sBLA的批准是基于KEYNOTE-859试验的数据,其中KEYTRUDA加化疗与单用化疗相比,在人类表皮生长因子受体2(HER2)阴性的患者中(无论患者PD-L1表达如何),总生存期(OS)有统计学意义的改善。FDA已设定该申请的PDUFA(处方药使用者费用法案)日期为2023年12月16日。

Preview
来源: SYNAPSE
Preview
来源: SYNAPSE
参考资料:
https://www-merck-com.libproxy1.nus.edu.sg/news/fda-accepts-application-for-mercks-keytruda-pembrolizumab-plus-chemotherapy-as-first-line-treatment-for-locally-advanced-unresectable-or-metastatic-gastric-or-gastroesophageal-junctio/
药物
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



