治疗糖尿病的潜在新型化合物取得进展
2023-10-13
临床结果临床研究
山东大学于晓教授团队,北京大学焦宁教授团队联合孙金鹏教授团队在Nature Metabolism 在线发表了题为 “Functional screening and rational design of compounds targeting GPR132 to treat diabetes” 的研究论文,这项研究发现氧化脂肪酸脂代谢产物激活GPR132对胰岛驻留型巨噬细胞重编程发挥重要的调控作用,是促发胰岛炎症的重要原因之一。进一步,联合研究团队通过阐明GPR132识别内源性配体9(S)-HODE,NPGLY并激活的分子机制,结合计算机辅助药物设计、合成药物化学以及药理学检测评估手段开发了靶向GPR132的高亲和力及选择性拮抗剂候选小分子NOX-6-18,能够显著改善糖尿病小鼠的胰岛炎症,并提高糖代谢稳态,为治疗糖尿病提供了新的思路。

Preview
来源: 生物谷
哺乳动物细胞中的脂质代谢是复杂的,目前知道有四种主要形式:首先,脂质可通过磷脂的生物合成和膜的生物发生过程形成细胞和胞内细胞器膜。第二,作为体内主要能量分子ATP生产的备用能源。第三,代谢为多种脂质分子,作为信号分子以选择性和特异性的方式激活受体来调节细胞功能。第四,脂质以形成甘油三酯的形式储存在脂肪组织中。已有的研究表明,脂质信号调节通路对维持糖代谢稳态发挥着重要的作用,比如,美国加州大学Jerrold M Olefsk教授团队发现鱼油中omega-3脂肪酸以及内源性脂质如PAHSA可以通过GPR120发挥抗炎和胰岛素增敏的作用(Cell. 2010 Sep 3;142(5):687-98.)。于晓教授联合孙金鹏教授团队发现胰岛中内源性LCFA-GPR120环路对于胰岛稳态发挥重要作用以及引起不同下游信号通路响应的分子机制(Diabetes. 2022 Jul 1;71(7):1454-1471.;Science. 2023;380(6640):eadd6220.)。在1型和2型糖尿病的进展过程中,糖尿病并发的脂质代谢紊乱也加重了糖尿病的进程,高水平的饱和游离脂肪酸会导致组织和细胞中氧自由基的过量产生,与糖耐量受损的发展有关,且是糖尿病肾病、糖尿病视网膜病变和糖尿病神经病变等严重并发症的关键因素(Physiol. Rev, 93 (1) (2013), pp. 137-188.; Diabetologia, 48 (4) (2005), pp. 752-755)。此外糖尿病的发展通常伴随脂质过氧化产物的增加,如12-HETE, LTB4等也被发现可能通过选择性激活G蛋白偶联受体介导各种炎症和过敏反应(J. Biol. Chem, 286 (39) (2011), pp. 33832-33840.; J. Exp. Med, 192 (3) (2000), pp. 439-446.), 这些氧化脂肪酸代谢产物可能在糖尿病的外周并发症的病因中起重要作用(Sci. Signal, 8 (361) (2015), p. ra10.)。研究脂质代谢小分子对各种代谢器官和组织的调控作用是近年来内分泌和代谢学科的研究难点和热点。
目前的科学研究表明,胰岛环路障碍是糖尿病发生的核心因素之一。比如,美国加州大学Huising教授研究团队和于晓教授团队发现尿皮质素3 (UCN3)介导的β细胞-δ细胞相互作用在糖尿病发生发展过程中发挥关键作用(Nat Med. 2015 Jul;21(7):769-76,J Clin Invest. 2017;127:2631-2646; Nat Commun. 2022 Nov 5;13(1):6670)。延续这一工作,于晓教授发现,敲除胰岛δ细胞,会导致围产期小鼠胰岛素水低血糖死亡(Cell Death Dis. 2018;9:682.),以及胰岛内源性脂肪酸激活GPR120调控胰岛 δ 细胞-β 细胞环路引起不同下游信号通路响应的分子机制(Diabetes. 2022 Jul 1;71(7):1454-1471.;Science. 2023;380(6640):eadd6220.)。平行于胰岛 δ 细胞-β 细胞环路,胰岛β 细胞-巨噬细胞环路也逐渐得到大家的重视。比如说,在1型和2型糖尿病(分别为T1DM和T2DM)背景下,胰岛驻留型巨噬细胞发生重编程并与胰岛内的其他细胞产生信号交流,并参与胰岛的稳态调节以及胰岛病理条件下的炎症反应(Cell Metabolism, 29(2): 457-474; Cell Metabolism, 34(2): 240-255; Nature Reviews Endocrinology, 16(2): 81-90)。而从胰岛β 细胞出发,于晓教授团队最近也发现了胰岛β细胞中的孤儿受体OLFR109可以识别胰岛素肽insB:9-23,通过“刹车机制”控制胰岛素分泌的数量和速度。持续长期的insB:9-23刺激,激活胰岛β细胞-巨噬细胞环路,促进巨噬细胞增殖,损害胰岛稳态,阐明了胰岛β细胞嗅觉受体olfr109与胰岛巨噬细胞之间的细胞通讯对胰岛稳态的调控机制(Cell Metabolism. 2022;34(2):240-255;Trends Cell Biol. 2023 Jun;33(6):463-476.)。值得注意的是,南京医科大学韩晓教授研究发现在高脂等压力条件下胰岛β细胞释放外泌体miR29与单核/巨噬细胞作用,加剧胰岛炎症(Cell Rep, 2021. 34(1): p. 108576)。
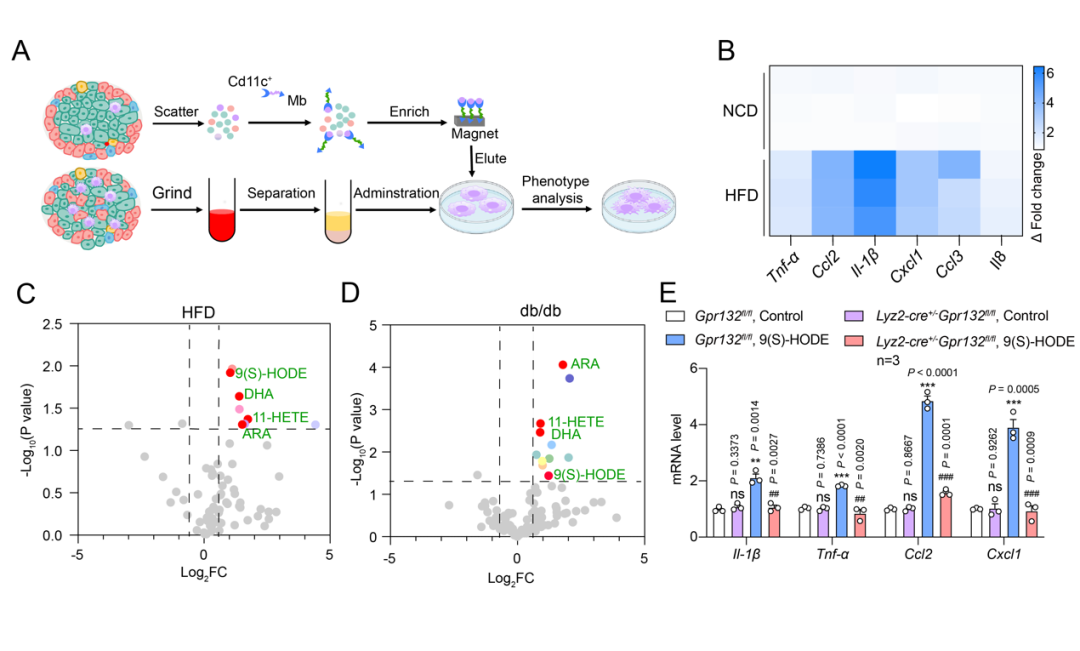
Preview
来源: 生物谷
接下来,为了确定反转9(S)-HODE-GPR132-Gi信号轴是否可以减少糖尿病进展过程中的胰腺炎症,改善葡萄糖代谢,需要获得GPR132的高选择性激动剂和拮抗剂。联合团队中的焦宁教授是国际上著名的有机化学和药物化学专家。焦宁教授团队前期针对代谢类疾病的药物发现积累了多年的研究经验,创建了基于新合成方法学的药物合成和修饰方法,构建了新结构化合物库 (Nature. 597(7874) (2021):64-69.; Science. 367(6475) (2020):281-285.; Nat. Catal., 3 (2020), 107-115.; Nat Chem., 11(1) ( 2019):71-77.);已经发现了多个靶向代谢性疾病的候选药物分子。研究团队于是从解析其对内源性配体识别机制和GPR132受体激活的机制入手,开展靶向GPR132的高选择性激动剂和拮抗剂发现研究。研究团队解析了NPGLY-GPR132-Gi和9(S)-HODE-GPR132-Gi复合物的冷冻电镜结构。对结构进行分析发现,两种内源性配体通过两个不同的口袋与GPR132受体结合,NPGLY占据配体结合口袋左侧使口袋呈“L”形,而9(S)-HODE具有更深的配体结合位置,这表明GPR132上有两个“正构位点”,既说明了其配体口袋的可塑性也为基于结构设计小分子激动剂和拮抗剂带来了挑战。
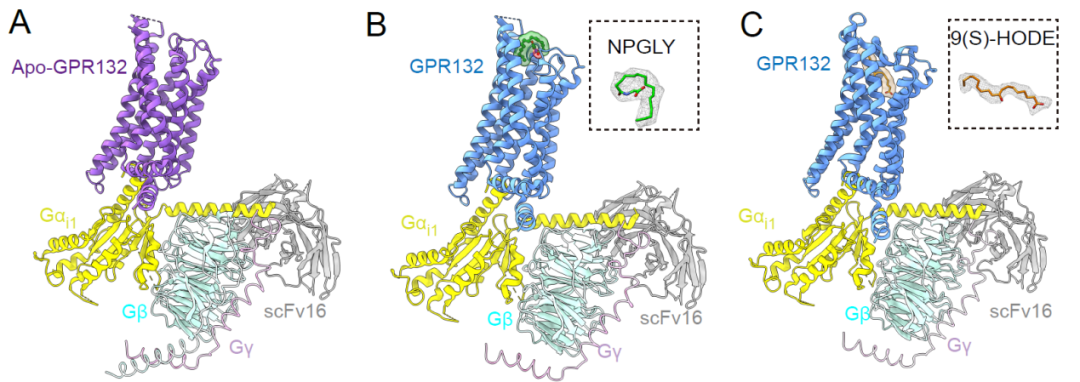
Preview
来源: 生物谷
联合研究团队于是进行了分子动力学模拟,分别计算了两个“正构位点”残基的能量贡献,/p>
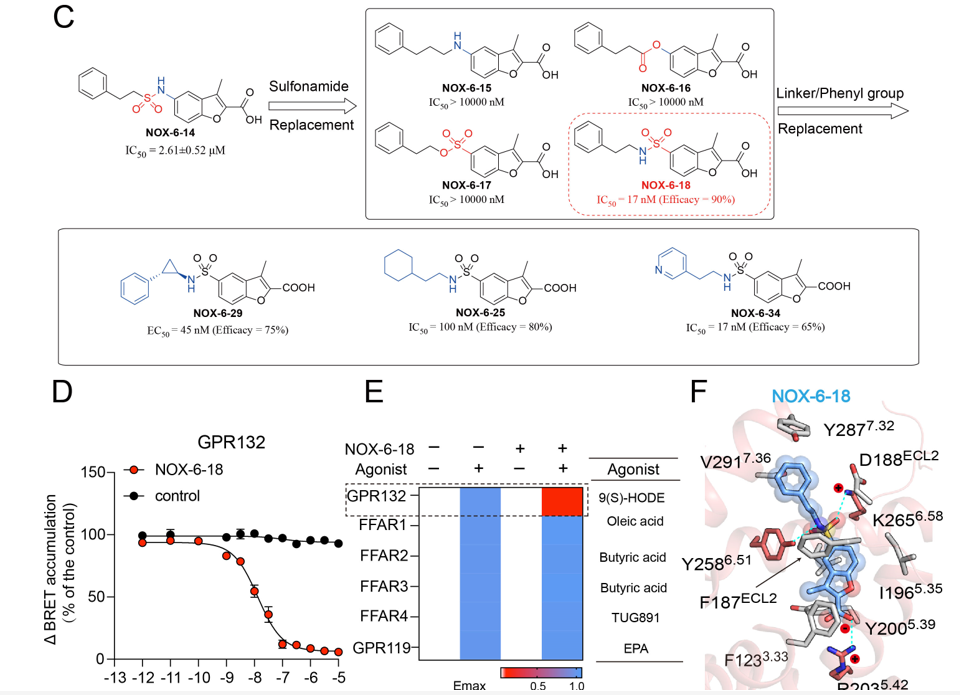
Preview
来源: 生物谷
最后,研究团队在2型糖尿病小鼠模型HFD小鼠上对NOX-6-18针对糖尿病及葡萄糖代谢的治疗效果进行评估,发现NOX-6-18NOX-6-18 给药4-6周,高脂小鼠葡萄糖耐量得到改善,这很大程度归因于NOX-6-18在早期阶段对胰岛功能的改善。NOX-6-18NOX-6-18给药12-14周以后能够显著改善高脂小鼠的体重,葡萄糖耐量以及胰岛素耐量,并且空腹血糖及胰岛素含量也得到改善。同时NOX-6-18显著降低了胰岛、肝脏和脂肪组织的炎症水平,进而改善了代谢紊乱。综上所述,该研究结果表明内源性氧化脂肪酸9(S)-HODE-GPR132信号通路在胰岛驻留型巨噬细胞重编程以及胰岛炎症中发挥重要作用,靶向GPR132开发的高选择性及高亲和力拮抗剂NOX-6-18能够显著降低胰岛的炎症反应,改善葡萄糖代谢,为糖尿病的治疗提供了新的治疗思路。
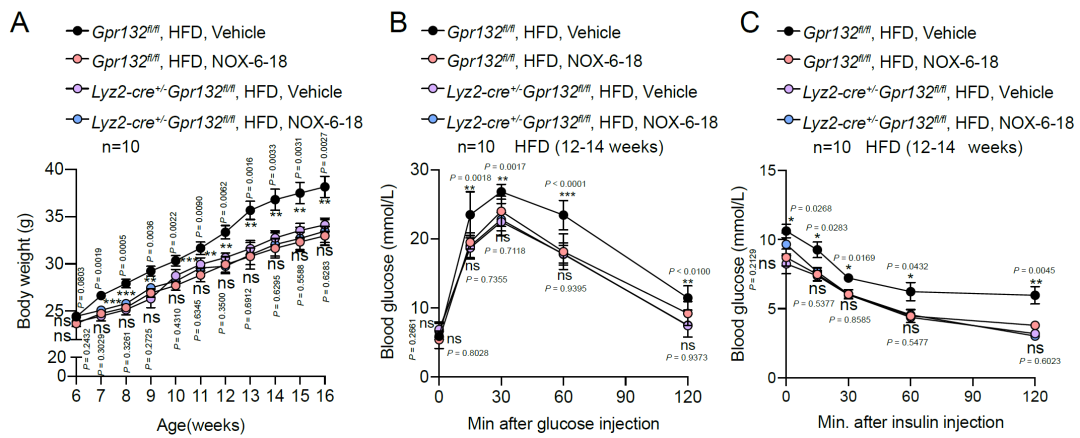
Preview
来源: 生物谷
于晓教授课题组长期从事内分泌生理和糖尿病的研究,聚焦于胰岛内分泌组织的细胞间环路和GPCR跨膜信号转导对胰岛稳态的维持,以通讯作者在 Nature(2篇),Science(封面文章),Cell(封面文章),Cell Metab,Nature Metab,Nat Chem Biol (2篇),J Clin Invest,PNAS,Diabetes,Nat Commun(2篇)等杂志发表论文40余篇, 在胰岛细胞环路对胰岛稳态调控和GPCR在胰岛中的功能研究方面居于国际前沿水平;焦宁教授课题组长期致力于合成方法学、分子骨架编辑、药物高效合成及筛选、基于代谢类疾病的新药发现等研究,以通讯作者在Nature,Science,Nat. Chem.,Nat. Catal.,Nat. Metab.,CCS. Chem.等期刊发表论文190余篇,在绿色氧化反应,氮化反应,卤化反应等研究中取得了一系列创新性成果,并发现多个针对代谢综合征以及用作光动力治疗的候选药物分子。孙金鹏教授课题组长期聚焦于微环境药理学,系统性的研究了膜受体感知微环境并调控生理功能的机制,以通讯作者在 Nature (x6),Science (封面),Cell (x2,封面1篇),Cell Metab,Nature Metab,Nat Chem Biol (x3),Cell Research (x2),PNAS (x5),Nat Commu (x7)等知名杂志发表90余篇论文,在膜受体对微环境感知和配体识别方面处于国际研究前沿。该项研究得到国家重点研发计划基金、国家杰出青年科学基金、自然基金委重点基金、重大项目、山东省重点研发计划、昌平实验室和新基石科学基金的支持。
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。





