Cell | 突破癌症治疗瓶颈:跨癌种蛋白基因组学揭示新靶点
疫苗抗体药物偶联物细胞疗法免疫疗法蛋白降解靶向嵌合体
引言
癌症研究领域随着二代测序(Next-generation sequencing)的发展,取得了显著进展,深入解析了癌症基因组(cancer genome)和转录组(transcriptome),极大地提高了我们对癌症生物学的理解。然而,尽管取得了这些进展,大多数癌症患者仍主要接受放疗和化疗,这些治疗方式伴随着较高的复发风险和毒性。靶向治疗(targeted therapies),如小分子药物(small-molecule drugs)、单克隆抗体(monoclonal antibodies)、抗体-药物偶联物(antibody-drug conjugates,ADCs)、蛋白降解靶向嵌合体(proteolysis-targeting chimeric molecules,PROTACs)、抗体导向酶前药疗法(antibody-directed enzyme prodrug therapies,ADEPTs)、癌症治疗疫苗(cancer treatment vaccines)、检查点抑制剂(checkpoint inhibitors)和T细胞治疗(T cell therapies),为实现更有效和精准的癌症治疗提供了希望。
由于蛋白质是这些治疗方法的主要靶点,并且是驱动癌症基因和表观基因异常的功能效应器,蛋白基因组学(proteogenomics)——即将无偏见的质谱(mass spectrometry,MS)基础蛋白质组学与基因组学、表观基因组学和转录组学整合——为探索现有和未来的癌症治疗靶点提供了一个强大的框架。临床蛋白质组学癌症分析联盟(Clinical Proteomic Tumor Analysis Consortium,CPTAC)对超过1000个前瞻性收集的未经过治疗的原发肿瘤进行了蛋白基因组学表征,覆盖了10种癌症类型,许多样本还包括匹配的正常邻近组织。CPTAC泛癌症资源工作组对这10种癌症类型的所有组学数据进行了统一化处理,以便进行泛癌症蛋白基因组学研究。
6月24日Cell杂志的报道“Pan-cancer proteogenomics expands the landscape of therapeutic targets”,将这一数据集与其他公共数据集整合,揭示了癌症治疗蛋白质靶点的全景。通过系统地识别过表达或过度活化的可靶向蛋白依赖性、与肿瘤抑制基因(tumor suppressor genes,TSGs)缺失相关的蛋白依赖性、以及新抗原(neoantigens)和肿瘤相关抗原(tumor-associated antigens),相关的分析为现有癌症药物靶点提供了新的见解,并系统性地识别了药物再利用或开发的新候选靶点。这些结果为伴随诊断、药物再利用和治疗开发提供了一个全面的蛋白质和肽靶点资源。

Preview
来源: 生物探索
癌症研究的飞速发展使我们对癌症的基因组和转录组有了更深入的了解,但大多数患者仍主要依赖于传统的放疗和化疗,这些治疗方法存在高复发率和显著的毒性。为了实现更有效和精准的治疗,靶向治疗(targeted therapies)应运而生,其中包括小分子药物(small-molecule drugs)、单克隆抗体(monoclonal antibodies)、抗体-药物偶联物(ADCs)、蛋白降解靶向嵌合体(PROTACs)、抗体导向酶前药疗法(ADEPTs)、癌症治疗疫苗(cancer treatment vaccines)、检查点抑制剂(checkpoint inhibitors)和T细胞治疗(T cell therapies)。这些方法的共同点是它们主要靶向癌症细胞中的特定蛋白质,而蛋白质组学(proteomics)结合基因组学、表观基因组学和转录组学的整合,即蛋白基因组学(proteogenomics),为探索癌症治疗的新靶点提供了一个强有力的框架。
该研究利用了临床蛋白质组学癌症分析联盟(Clinical Proteomic Tumor Analysis Consortium,CPTAC)的数据,涵盖了10种癌症类型的超过1000个前瞻性收集的未经过治疗的原发肿瘤样本,许多样本还包括匹配的正常邻近组织。研究团队将这些数据与其他公共数据集整合,系统性地识别了过表达或过度活化的可靶向蛋白依赖性、与肿瘤抑制基因(TSGs)缺失相关的蛋白依赖性、以及新抗原(neoantigens)和肿瘤相关抗原(tumor-associated antigens)。
Preview
来源: 生物探索
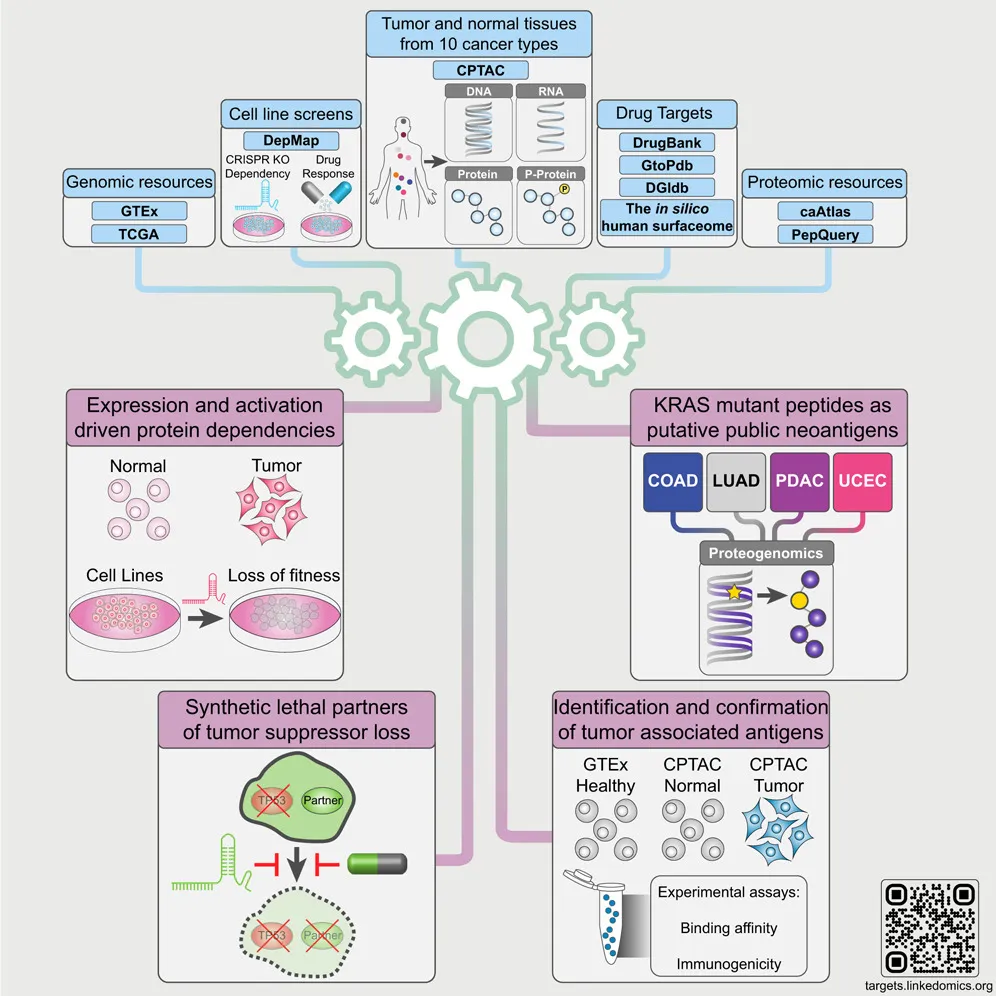
研究团队综合使用了多种组学数据,包括蛋白质组学(proteomics)、基因组学(genomics)、表观基因组学(epigenomics)和转录组学(transcriptomics),并结合细胞系数据和计算预测分析,揭示了癌症治疗的蛋白质靶点全景。
数据收集和处理 :研究首先整合了来自CPTAC的蛋白基因组学数据,这些数据涵盖了10种癌症类型的1043个肿瘤样本和524个正常组织样本。数据整合还包括来自GTEx、TCGA、DepMap等公共资源的数据,这些数据提供了广泛的基因组和蛋白质组信息。
蛋白质表达和活性分析 :研究通过质谱(mass spectrometry, MS)数据,识别出在肿瘤中过表达或活化的蛋白质。这些蛋白质的过表达或活化可能是由基因突变(mutation)、低甲基化(hypomethylation)或拷贝数扩增(copy-number amplification)驱动的。具体方法包括利用PepQuery工具验证蛋白质鉴定,并结合mRNA和蛋白质的表达数据进行相关性分析。
基因依赖性分析 :通过使用CRISPR-Cas9基因敲除(knockout, KO)实验数据,研究团队识别了癌细胞在某些关键蛋白上的依赖性,这些依赖性使得这些蛋白质成为潜在的治疗靶点。基因敲除实验数据来自DepMap数据库,通过分析基因敲除对细胞生长的影响,确定了关键的基因依赖性。
合成致死性分析 :研究团队通过蛋白基因组学数据,识别了合成致死性(synthetic lethality)现象,即当两个基因同时失活时会导致细胞死亡,而单独失活一个基因时细胞仍能存活。这种分析提供了一种针对肿瘤抑制基因缺失的治疗策略。例如,TP53基因缺失的肿瘤对某些蛋白质表现出更高的依赖性,提示可以通过靶向这些蛋白质来治疗TP53缺失的肿瘤。
新抗原和肿瘤相关抗原的预测和验证 :通过计算预测和实验验证,系统性地识别出潜在的新抗原和肿瘤相关抗原。这些抗原可以作为疫苗和T细胞治疗的靶点。研究使用了NeoFlow工具和HLA(人类白细胞抗原)结合亲和力预测,筛选出具有潜力的新抗原,并通过实验验证其免疫原性。
泛癌症分析揭示可靶向蛋白质
通过泛癌症分析,研究团队识别出2863种药物可靶向蛋白质,并揭示了影响mRNA与蛋白质相关性的生物学因素。这些蛋白质中,有许多在不同癌症类型中表现出过表达或过度活化,提供了潜在的治疗靶点。例如,在非小细胞肺癌(LUAD)中,EGFR基因的突变和拷贝数扩增导致了EGFR蛋白质和mRNA水平的显著增加。
Preview
来源: 生物探索
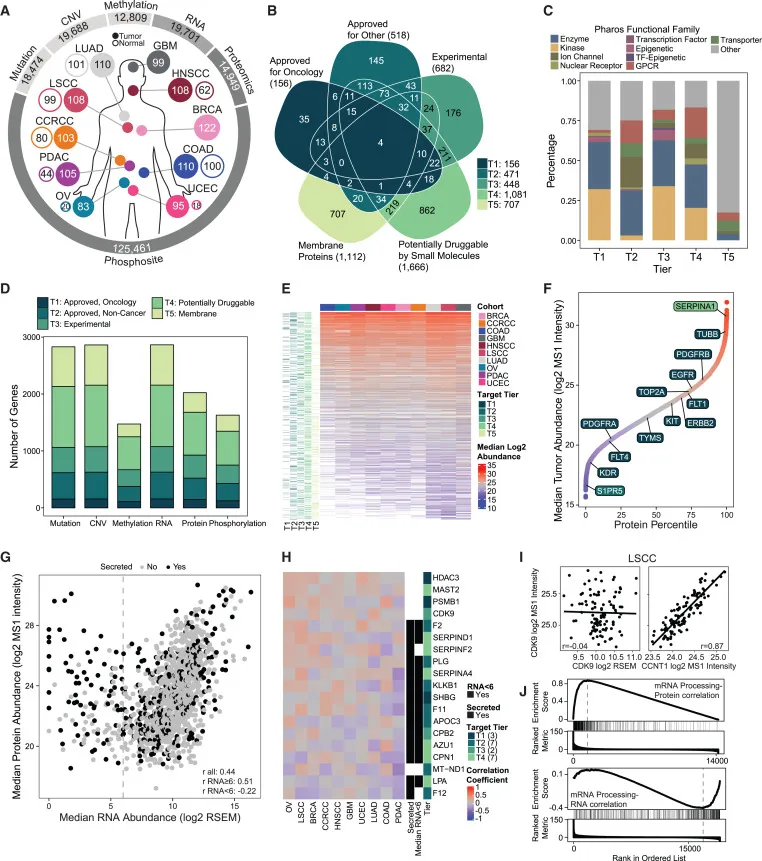
样本和组学特征的概览 :图A展示了10种癌症队列中肿瘤和正常组织样本的数量,以及每种组学类型(基因组学、转录组学、蛋白质组学等)中识别到的特征总数。
目标基因的分类 :图B显示了每个目标层级中基因的数量,并将重叠的基因分配到最高层级。图中将这些基因分为五个层级,分别是:
层级1:已获任何癌症类型的药物批准的主要抑制靶点。
层级2:获批用于其他适应症的药物的主要抑制靶点。
层级3:处于实验或临床试验阶段的药物的靶点。
层级4:经常被小分子药物靶向的蛋白家族中的其他基因。
层级5:细胞表面膜蛋白。
功能家族分布 :图C展示了每个层级中基因所属的功能家族的百分比。
各组学类型中的基因数量:图D显示了在至少一个癌症队列中每种组学类型中识别到的基因数量。
蛋白质丰度热图 :图E为每个癌症队列中目标蛋白的中位log2 MS1强度(蛋白质丰度)热图,展示了不同癌症类型中蛋白质丰度的变化。
蛋白质丰度排名 :图F根据每个队列中蛋白质丰度的中位值,对所有蛋白质进行排名,并标注了最高和最低丰度的药物靶点,以及被最多药物批准靶向的靶点。
mRNA和蛋白质相关性 :图G展示了所有样本中可靶向蛋白质的中位log2 RNA表达和中位log2蛋白质丰度的散点图,并计算了Spearman相关系数。
各队列中的相关性系数热图 :图H显示了在任一队列中基因与蛋白质丰度不相关的基因的mRNA和蛋白质相关性热图。
特定蛋白质的相关性分析 :图I分析了在肺鳞状细胞癌(LSCC)队列中,CDK9蛋白质丰度与CDK9 mRNA丰度及其结合伙伴CCNT1蛋白质丰度之间的Spearman相关性。
基因集合富集分析 (GSEA):图J展示了基于CDK9蛋白质共表达或全球mRNA共表达的GSEA富集分析结果。
蛋白质表达驱动因素
合成致死性提供治疗策略
研究通过蛋白基因组学分析,识别出合成致死性提供了一种针对肿瘤抑制基因缺失的治疗策略。例如,TP53基因缺失的肿瘤对拓扑异构酶IIα(TOP2A)表现出更高的依赖性,提示可通过靶向TOP2A来治疗TP53缺失的肿瘤。研究发现,TP53缺失的子宫内膜癌细胞对拓扑异构酶抑制剂多柔比星(doxorubicin)和米托蒽醌(mitoxantrone)表现出更高的敏感性,提示TP53状态可以作为选择治疗方案的生物标志物。
新抗原和肿瘤相关抗原的发现
该研究通过整合多种组学数据,揭示了癌症治疗的新靶点,并为药物再利用和新疗法的开发提供了重要资源。这些发现不仅有助于理解癌症的生物学机制,还为个性化治疗提供了新的方向。未来的研究可以进一步验证这些靶点的临床应用潜力,并开发相应的靶向治疗和免疫疗法。
数据整合的重要性 :通过整合蛋白质组学、基因组学、表观基因组学和转录组学数据,研究能够全面了解癌症的分子机制。这种多层次的数据整合方法为发现新的治疗靶点提供了广泛的视角。
临床应用的潜力 :尽管该研究主要基于实验室数据,但其发现具有显著的临床应用潜力。例如,识别出的新抗原可以用于开发癌症疫苗和T细胞疗法,过表达和活化的蛋白质可以作为靶向药物开发的基础。
未来研究方向 :该研究揭示了许多潜在的治疗靶点,但还需要进一步的实验验证和临床试验来确定其有效性和安全性。未来的研究可以集中在这些靶点的功能验证、药物筛选和临床应用上。
综上,跨癌种蛋白基因组学的研究为癌症治疗提供了新的视角和方法,通过系统性地识别和验证新的治疗靶点,有望推动个性化治疗和精确医学的发展。这些发现不仅深化了我们对癌症生物学的理解,也为未来的癌症治疗提供了重要的科学依据和实践指导。
参考文献
Savage SR, Yi X, Lei JT, Wen B, Zhao H, Liao Y, Jaehnig EJ, Somes LK, Shafer PW, Lee TD, Fu Z, Dou Y, Shi Z, Gao D, Hoyos V, Gao Q, Zhang B. Pan-cancer proteogenomics expands the landscape of therapeutic targets. Cell. 2024 Jun 17:S0092-8674(24)00583-X. doi: 10.1016/j.cell.2024.05.039. Epub ahead of print. PMID: 38917788.
https://doi-org.libproxy1.nus.edu.sg/10.1016/j.cell.2024.05.039
内容来源于网络,如有侵权,请联系删除。<br>
机构
-热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


