君实生物PD-1抑制剂特瑞普利单抗III期研究再获JAMA主刊发表,针对非小细胞肺癌
2023年1月17日,君实生物宣布,抗PD-1单抗特瑞普利单抗联合化疗用于可切除非小细胞肺癌(NSCLC)围手术期治疗的3期NEOTORCH研究获国际权威期刊《美国医学会杂志》(JAMA)发表。
特瑞普利单抗是我国批准上市的首个国产以PD-1为靶点的单抗药物,由本土创新药企君实生物独立研发,用于多种恶性肿瘤治疗。至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由君实生物发起的临床研究。截至目前,该药已在中国获批6项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非鳞状非小细胞肺癌几大癌种。在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。2023年10月,君实生物与Coherus BioSciences共同宣布,特瑞普利单抗(商品名LOQTORZI)在美国获FDA批准上市,成为FDA批准的首个也是目前唯一一个用于鼻咽癌的PD-1单抗。
NEOTORCH研究是一项抗PD-1单抗用于NSCLC围手术期(涵盖新辅助及辅助治疗)治疗达到无事件生存期(EFS)阳性结果的3期临床研究。该研究旨在比较特瑞普利单抗或安慰剂联合化疗用于可切除II-III期NSCLC患者围手术期治疗的疗效和安全性。研究共纳入501例II-III期NSCLC患者,以1:1的比例随机接受特瑞普利单抗或安慰剂联合化疗术前3周期及术后1周期围手术治疗(鳞癌患者化疗方案为紫杉类+铂类;非鳞癌患者化疗方案为培美曲塞+铂类),随后接受特瑞普利单抗或安慰剂巩固治疗13周期(即“3+1+13”治疗模式)。此次报告的是III期患者的EFS期中分析结果。研究结果显示,与单纯化疗相比,特瑞普利单抗联合化疗用于可切除III期NSCLC患者围手术期治疗,并在后续进行特瑞普利单抗单药巩固治疗,显著延长了主要终点EFS,将疾病复发、进展或死亡风险降低60%。
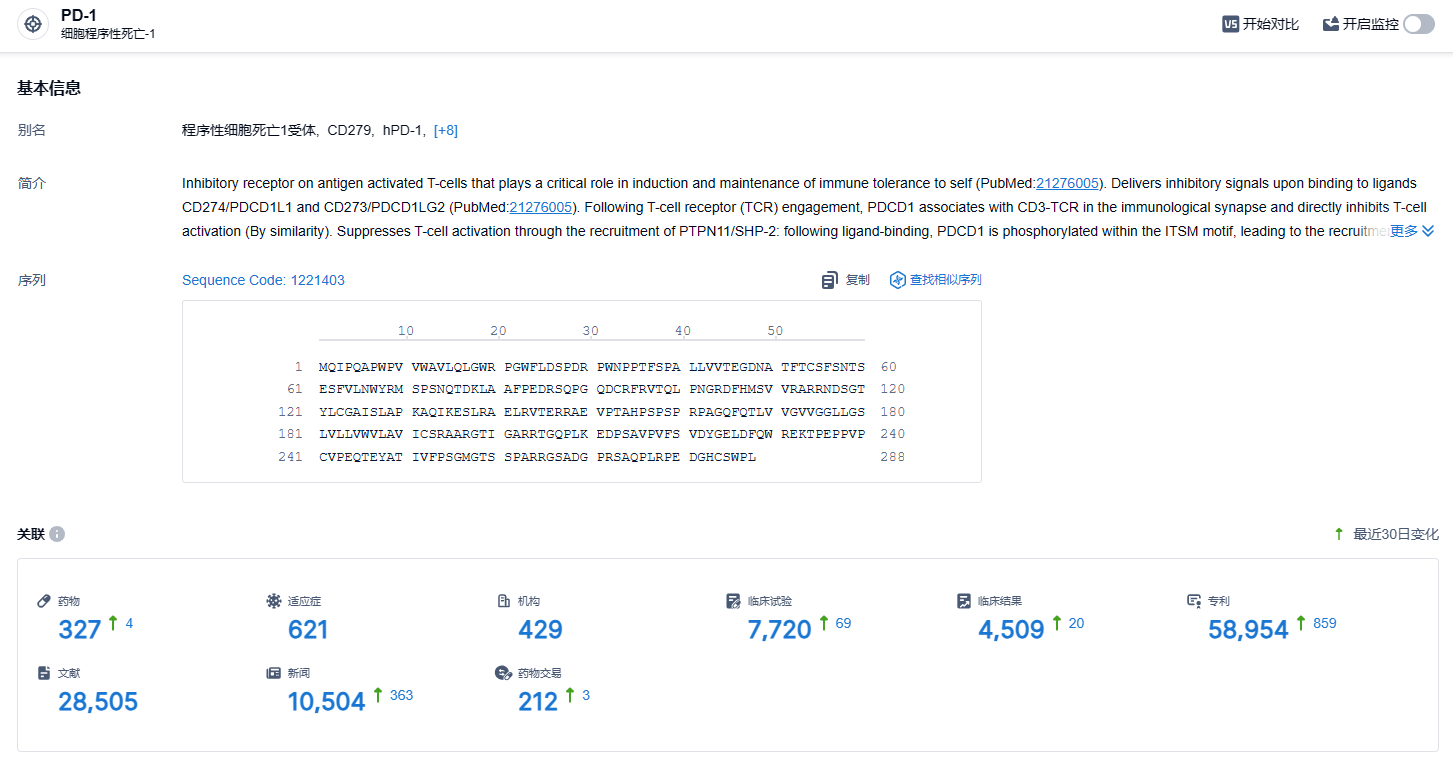
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年1月18日,PD-1 靶点共有在研药物327个,包含的适应症有621种,在研机构429家,涉及相关的临床试验7720件,专利多达58954件……PD-1靶点是研发非常火热的领域,君实的特瑞普利单抗是国产新药的明星产品,期待该药的后续表现。