再生元CD3/CD20双抗odronextamab上市申请遭FDA延期,针对淋巴瘤
2024年3月25日,再生元(Regeneron)宣布,已收到美国FDA就其CD3/CD20双抗odronextamab治疗复发/难治性(R/R)滤泡性淋巴瘤(FL)和R/R弥漫性大B细胞淋巴瘤(DLBCL)的BLA申请发出的完整回复函(CRL)。再生元表示唯一原因是确证临床的入组状态问题,而与疗效或安全性、临床设计、标签或生产问题无关。
odronextamab是再生元利用其专有的VelocImmune技术和Veloci-Bi双特异性平台开发的一种铰链稳定、基于人IgG4的CD20×CD3双特异性抗体(Ab),可结合B细胞表面的CD20和T细胞表面的CD3,从而触发T细胞介导的恶性B细胞毒性。2020年4月,再鼎医药与再生元达成协议,以3000万美元的首付款获得该产品在中国的开发和商业化权益。2023年8月17日,再生元宣布欧洲药品管理局(EMA)已受理旗下双抗治疗CD20 x CD3 双抗odronextamab治疗复发/难治性滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)的上市许可申请(MAA),这些患者在至少接受过两次全身治疗后出现进展。
据再生元介绍,作为最大的淋巴瘤临床项目OLYMPIA的一部分,公司一直在积极招募odronextamab的多个III期试验患者。OLYMPIA项目旨在改变几种B细胞非霍奇金淋巴瘤亚型的治疗模式(包括早期治疗线),FDA也同意了该项目,同时要求试验要包括剂量发现和确证性试验部分。剂量发现部分的患者入组已经开始,但CRL要求确证性试验部分也应该正在进行中,同时试验完成的时间表也要在重新提交申请之前达成一致。再生元致力于与FDA和研究人员密切合作,尽快将Odronextamab带给R/R FL和R/R DLBCL患者。再生元计划在今年晚些时候分享有关注册和监管时间表的最新信息。
欧盟的上市申请主要是基于odronextamab治疗FL和DLBCL的I期和关键II期试验(ELM-1和ELM-2)的数据结果。在ELM-1研究(Ph1,NCT02290951)中,odronextamab在既往接受≥2线治疗(LOT)的弥漫性大B细胞淋巴瘤(DLBCL)患者中表现出令人鼓舞的活性。接受剂量≥80mg odronextamab治疗的DLBCL患者的客观缓解率(ORR)为53%,完全缓解(CR)率为53%。12个月时持续缓解率为88%(Bannerji R. et al.Lancet Haematol.2022)。ELM-2研究是一项全球、多中心研究,患者来自13个国家的91家研究中心。DLBCL队列纳入复发难治的成人DLBCL患者。ELM-2研究结果显示,在121例≥3线的DLBCL患者,90例符合有效性分析,随访17.1个月时ORR和CR分别为53%和37%,而且疗效持久性较好,9个月时持续CR率为73%。同样,在96例3线及以上FL患者中,85例患者评估的ORR和CR分别为82%和75%
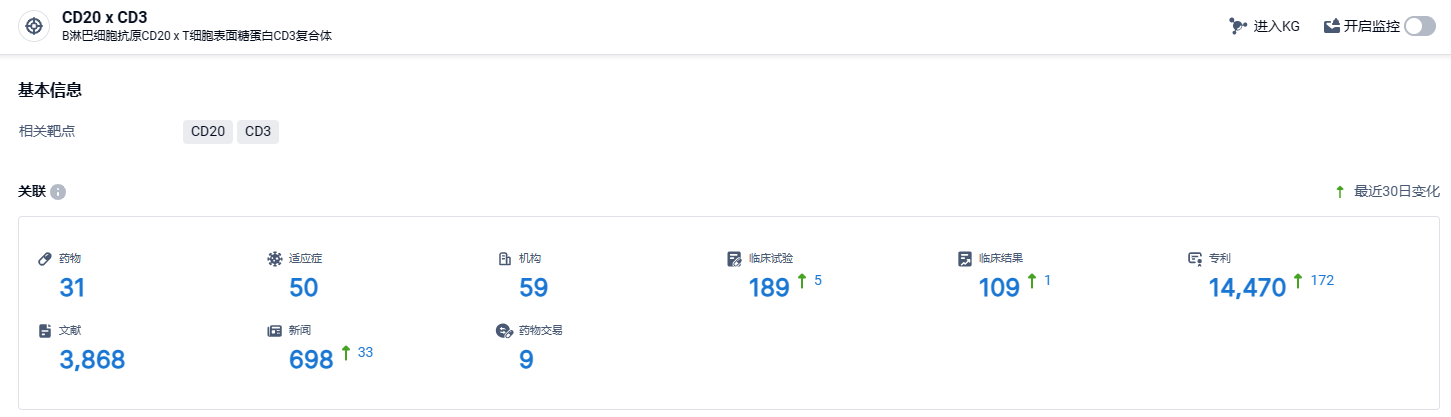
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 CD20 x CD3 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年3月27日,CD20 x CD3 靶点共有在研药物31个,包含的适应症有50种,在研机构59家,涉及相关的临床试验189件,专利多达14470件……血液瘤领域是CD3双抗和CAR-T细胞疗法最先打开局面的治疗领域,两者互为补充,甚至CD3双抗在CAR-T复发的患者中还可以实现10%-20%的响应率,潜力无穷,下一步CD3双抗将进一步从有效性和安全性方面不断提升,实现实体瘤中的突破。