赛诺菲/再生元度普利尤单抗新适应症获FDA批准,治疗1至11岁EoE患儿
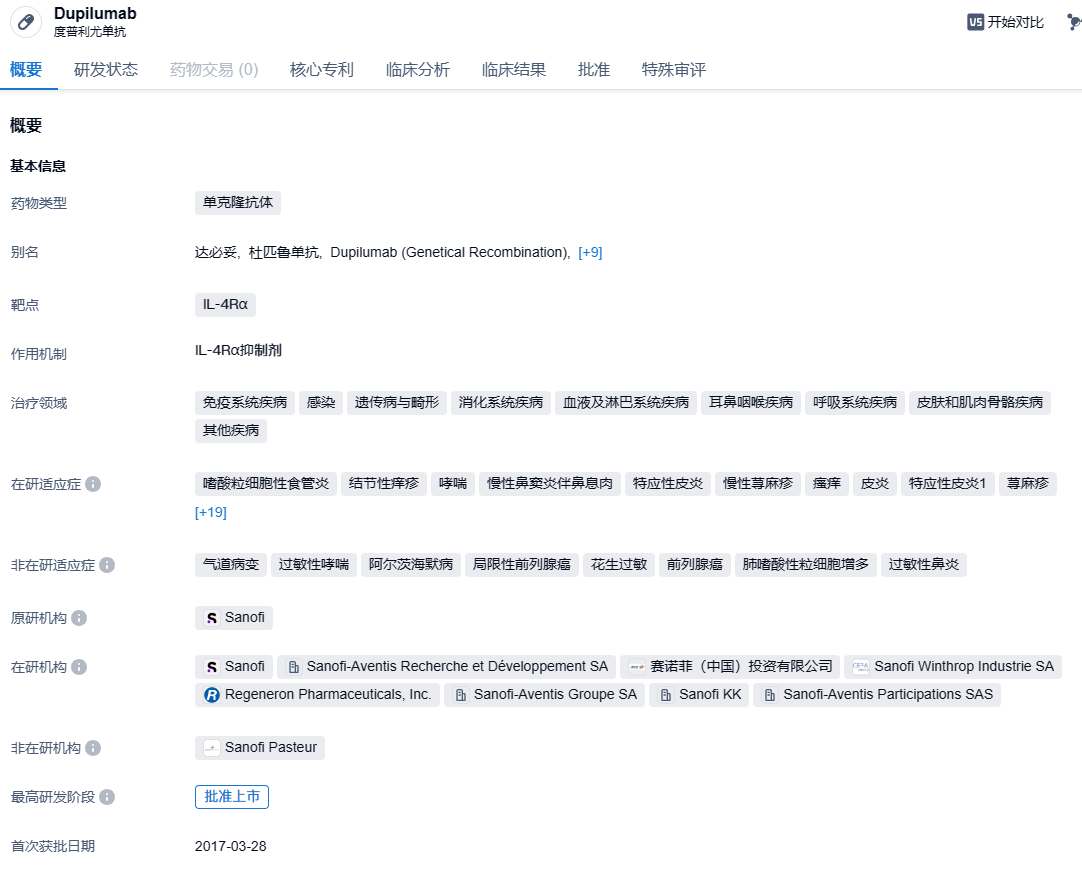
2024年1月26日,赛诺菲和再生元共同宣布,FDA已批准Dupixent(度普利尤单抗)新适应症,用于1至11岁嗜酸性粒细胞性食管炎(EoE)患者的治疗。
度普利尤单抗是赛诺菲和再生元合作开发的一款人源性单克隆抗体,靶向IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断IL-4 和IL-13信号通路,IL-4和IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。2017 年 3 月,度普利尤单抗获FDA批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®。2022年5月,Dupixent获FDA批准用于治疗12岁及以上、体重≥40Kg的EoE患者,是美国首款且唯一一款用于治疗EoE的药物。度普利尤单抗在国内首次上市批准时间为 2020年6月,用于治疗成人中重度特应性皮炎。随后,又陆续申报两项适应症,分别针对 12 岁及以上的中重度特应性皮炎患者,以及6~12岁的中重度特应性皮炎患者,均以儿童用药的理由纳入优先审评审批并取得批准。
本次扩展新适应症主要是基于III期EoE KIDS研究(Part A和Part B)的积极结果。Part A结果显示,在16周时,66%接受基于体重给药的较高剂量Dupixent的儿童(n=32)达到了组织学疾病患者的主要终点,而安慰剂组为3%(n=29)。Part B是为期36周的积极治疗延长期(n=47),在此期间来自Part A中Dupixent组符合条件儿童继续接受治疗,而安慰剂组儿童则改用Dupixent。结果显示,53%(17/32)患者的组织学疾病缓解维持到52周,其中从安慰剂转用Dupixent的患儿中有53%(8/15)也实现了组织学缓解。
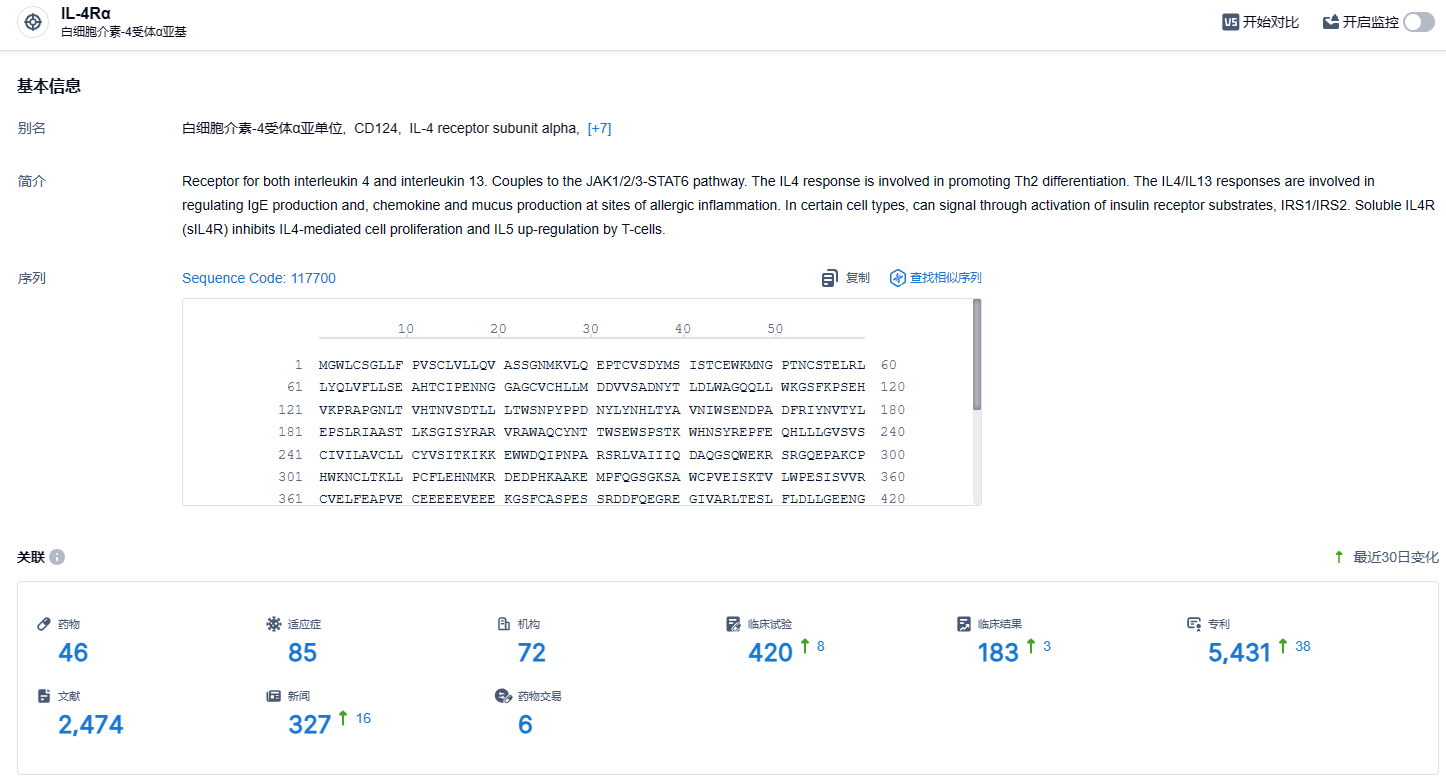
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-4Rα 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年1月27日,IL-4Rα 靶点共有在研药物46个,包含的适应症有85种,在研机构72家,涉及相关的临床试验420件,专利多达5293件……度普利尤单抗是第一款领域横跨皮肤科、呼吸科、变态反应用药的生物制剂,优秀的临床数据,使得其具有非常强的市场潜力。自2017 年上市以来度普利尤单抗全球销售额增长迅速,至2022 年达到82.93 亿欧元。期待度普利尤单抗销售额突破百亿美元。