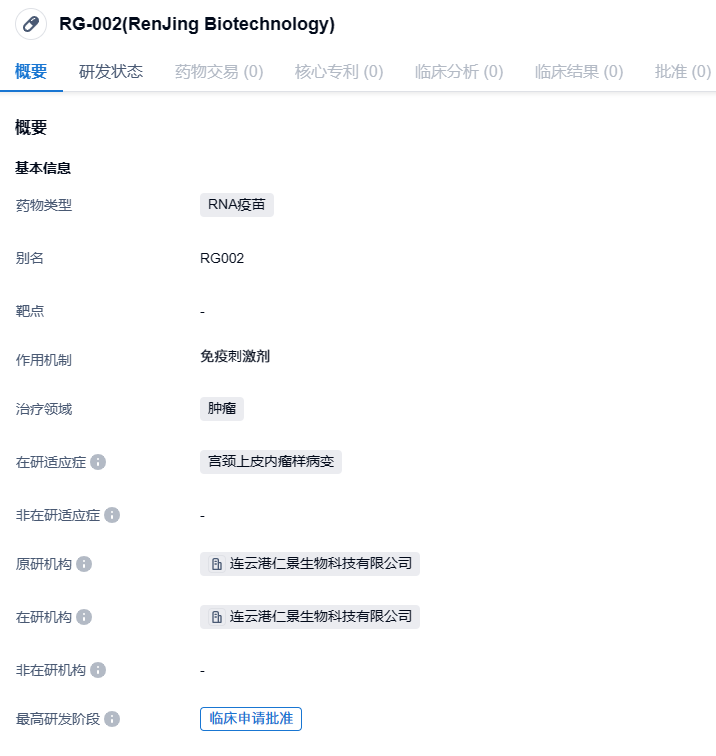
仁景生物治疗性mRNA疫苗RG002在美国获批临床,治疗HPV相关宫颈上皮内瘤变
2023年11月6日,仁景生物(RinuaGene)宣布,公司自主研发的HPV相关肿瘤治疗性mRNA疫苗RG002已于近日获得美国FDA新药临床试验申请(IND)许可,用于治疗人乳头瘤病毒(HPV)16型和/或18型相关的2级或3级宫颈上皮内瘤变(CIN2/3)。该公司正同步推进中国国家药品监督管理局(NMPA)的临床试验申请。
RG002采用仁景生物自主知识产权的mRNA序列和脂质纳米颗粒(LNP)递送系统,并基于抗原设计,序列优化和调控元件等多项专利技术进行整体优化。公司所采用的递送系统递送效率高、体内安全性优异。临床前研究表明,RG002单药能诱导强烈的特异性细胞免疫和肿瘤细胞杀伤作用,有效抑制HPV相关肿瘤生长;与免疫检查点抑制剂等抗肿瘤药物联用表现出良好的协同、增效作用。
宫颈癌是全球女性的第三大常见癌症,全世界每年有近50万名女性确诊患有宫颈癌,其中超过25万人死亡。尽管目前的HPV疫苗在预防感染和肿瘤疾病方面非常有效,但是其不能清除已经确定的感染。因此,研究和开发治疗性疫苗的开发很有必要。与预防性疫苗的不同,治疗性疫苗旨在产生细胞介导的免疫而不是中和抗体,即通过引发细胞介导的免疫应答以治疗特定的感染和恶性肿瘤。迄今为止,尚未有被批准用于治疗HPV感染和相关恶性肿瘤的商业用途的治疗性疫苗。RG002是全球首个被批准开展用于治疗人乳头瘤病毒(HPV)16型和/或18型相关的2级或3级宫颈上皮内瘤变(CIN2/3)临床试验的mRNA-LNP治疗性疫苗。
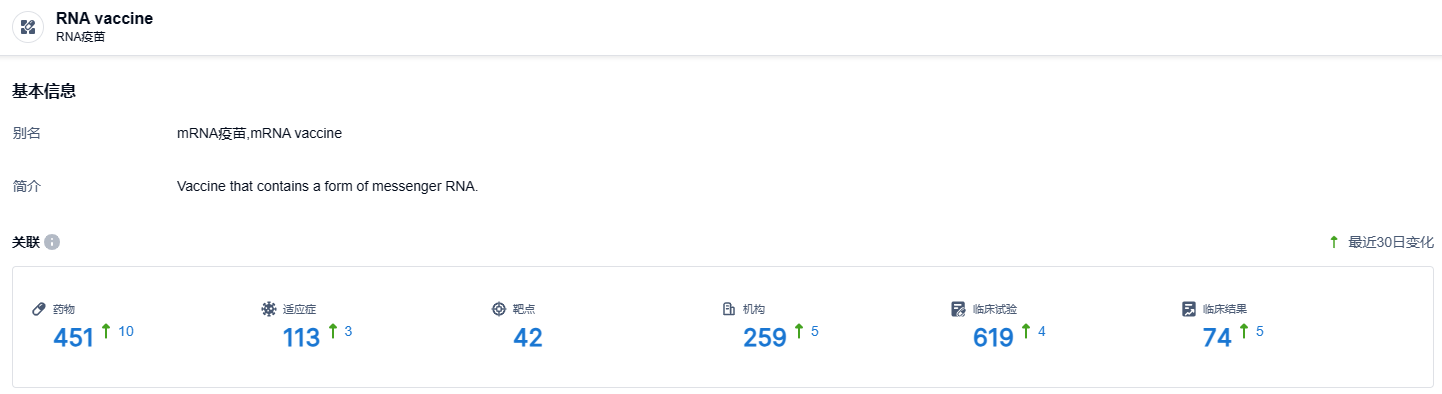
根据智慧芽新药情报库所披露的信息 (点击下方图片直达RNA疫苗药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2023 年11月8日,RNA疫苗这一药物类型共有在研药物451个,包含的适应症有113种,靶点42个,在研机构259家,涉及相关的临床试验619件……在RG002的研发方面,仁景生物将在全球范围内广泛布局相关各适应症的临床试验,积极探索该药物在宫颈癌前病变、宫颈癌、头颈部鳞癌、罕见肿瘤中单药和联合治疗,以解决HPV相关疾病治疗的巨大临床需求。期待RG002后续研发顺利。