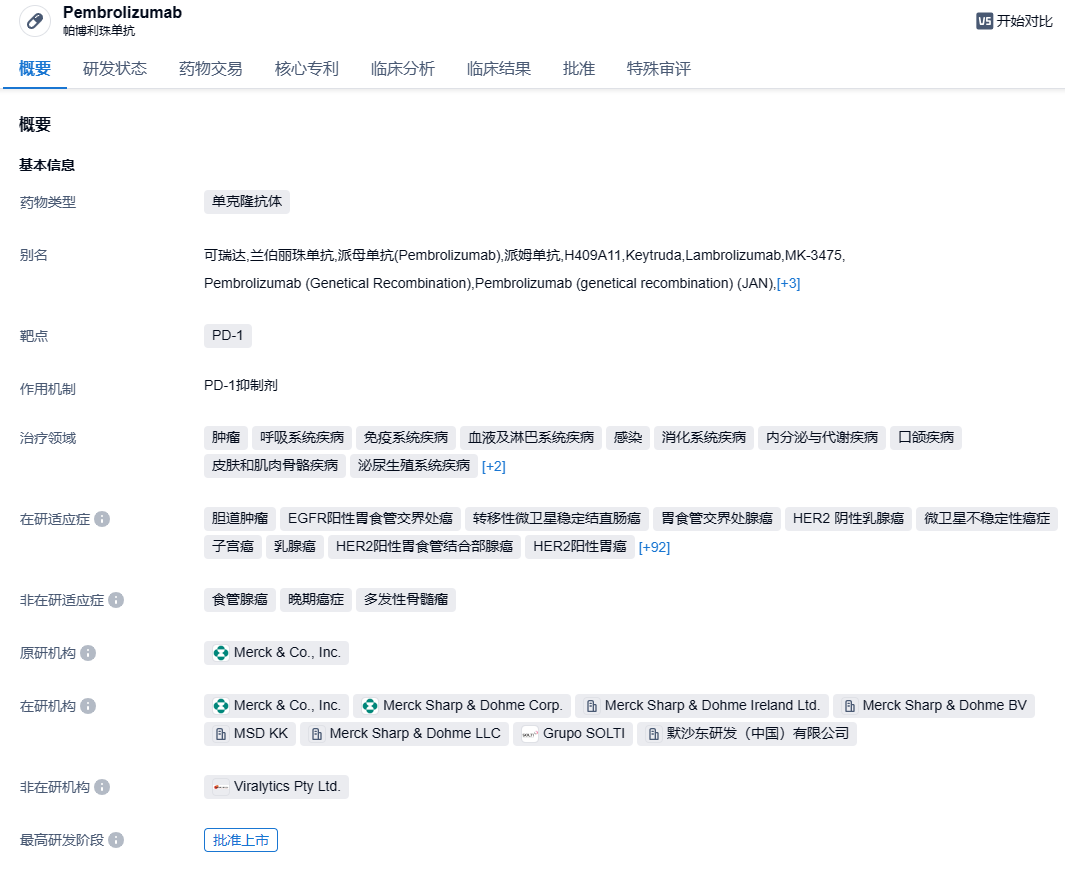
默沙东PD-1抑制剂帕博利珠单抗在华获批第12个适应症,一线治疗胃癌
2023年12月18日,默沙东(MSD)宣布,中国国家药品监督管理局(NMPA)已批准其PD-1抑制剂帕博利珠单抗的新适应症上市,联合含氟尿嘧啶类和铂类药物化疗用于局部晚期不可切除或转移性人表皮生长因子受体2(HER2)阴性胃或胃食管结合部腺癌患者的一线治疗。这是帕博利珠单抗在中国获批的第12个适应症。
帕博利珠单抗商品名为 Keytruda(可瑞达),在国内俗称 K 药,是一种大分子单抗药物,能够高选择性地结合癌细胞或免疫细胞表面的免疫检查点PD-1,从而释放被PD-1抑制的免疫功能,增强机体抗肿瘤免疫应答,起到强力抗癌的作用。默沙东发布了 2022 年度业绩,K 药全年销售额已经达到 209.37 亿美元(+22%),随着修美乐(阿达木单抗)的专利到期,其垄断时代即将落下帷幕,K 药今年很可能超过修美乐,成为新药王。
帕博利珠单抗此次新适应症的获批是基于全球3期临床试验KEYNOTE-859的数据。2023年11月,美国FDA也基于该数据批准帕博利珠单抗新适应症上市,联合含氟嘧啶和铂类化疗药物,用于局部晚期不可切除或转移性HER2阴性胃或胃食管连接部腺癌成人患者的一线治疗。该研究共纳入1579例患者,旨在评估Keytruda联合PF(5-氟尿嘧啶+顺铂)或CAPOX(卡培他滨+奥利沙铂)对比安慰剂联合PF/CAPOX一线治疗HER2阴性局部晚期不可切除或转移性胃癌或GEJ腺癌患者的疗效和安全性,主要终点为总生存期(OS),次要终点包括无进展生存期(PFS)、客观缓解率(ORR)、缓解持续时间(DOR)等。研究结果显示,在总体人群(无论PD-L1表达状态)中,中位随访31.0个月(15.3-46.3个月)后,Keytruda组患者的中位OS相比化疗组显著延长(12.9 vs. 11.5个月),死亡风险降低了22%(HR=0.78;95% CI:0.70-0.87;P<0.0001)。对PD-L1阴性患者(CPS <1)进行探索性分析发现,Keytruda组的中位OS为12.7个月,化疗组为12.2个月,HR为0.92。次要终点方面,Keytruda组患者的中位PFS(6.9 vs. 5.6个月)和中位DOR(8.0 vs. 5.7个月)显著延长,疾病进展或死亡风险降低了24%(HR=0.76;95% CI:0.67-0.85;P<0.0001);Keytruda组患者的ORR亦高于安慰剂组(51.3% vs. 42.0%,P=0.00009)。总之,无论患者PD-L1表达如何,主要终点OS、次要终点PFS和ORR都在统计学意义上改善。安全性方面,Keytruda组发生3-5级治疗相关不良事件(TRAEs)的比例为59.4%,安慰剂组这一比例为51.1%。
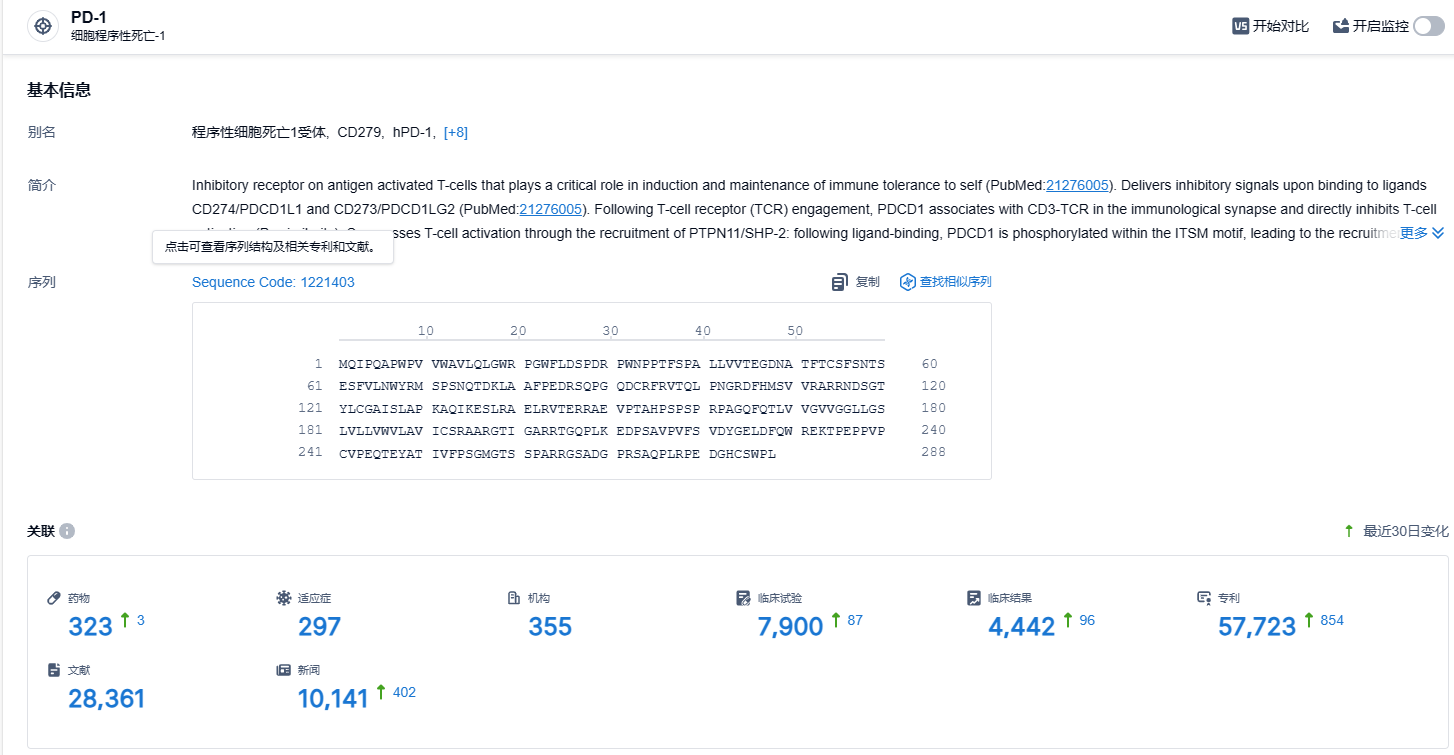
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月20日,PD-1 靶点共有在研药物322个,包含的适应症有302种,在研机构354家,涉及相关的临床试验7882件,专利多达56802件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有10余款相关新药上市,诸如恒瑞的卡瑞利珠单抗年销售额峰值更是接近50亿元人民币。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重,K药和O药是该赛道的标杆,国产PD-1/PD-L1新药如何与K药、O药竞争是不得不面对的难题。