默沙东PD-1抑制剂帕博利珠单抗再获FDA批准,一线治疗晚期癌症
2024年6月18日,美国FDA批准默沙东(MSD)重磅PD-1抑制剂Keytruda(pembrolizumab)与卡铂和紫杉醇联用,随后单药Keytruda治疗,用于原发性晚期或复发性子宫内膜癌成人患者。Keytruda是首个获得美国FDA批准与化疗联合用于治疗原发性晚期或复发性子宫内膜癌成年患者的PD-1靶向疗法,无论患者的错配修复(MMR)状态如何。
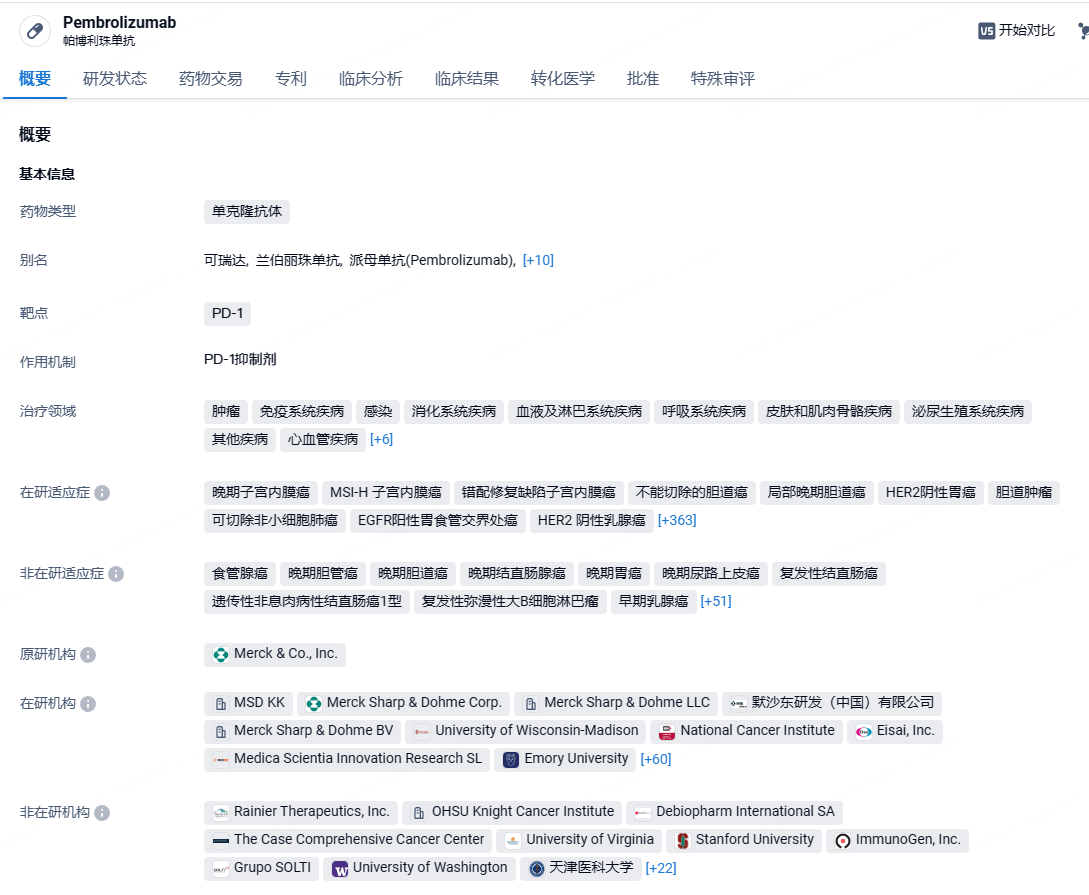
帕博利珠单抗商品名为 Keytruda(可瑞达),在国内俗称 K 药,是一种大分子单抗药物,能够高选择性地结合癌细胞或免疫细胞表面的免疫检查点PD-1,从而释放被PD-1抑制的免疫功能,增强机体抗肿瘤免疫应答,起到强力抗癌的作用。默沙东发布了 2022 年度业绩,K 药全年销售额已经达到 209.37 亿美元(+22%),随着修美乐(阿达木单抗)的专利到期,其垄断时代即将落下帷幕,K 药今年很可能超过修美乐,成为新药王。2023年12月18日,默沙东(MSD)宣布,中国国家药品监督管理局(NMPA)已批准其PD-1抑制剂帕博利珠单抗的新适应症上市,联合含氟尿嘧啶类和铂类药物化疗用于局部晚期不可切除或转移性人表皮生长因子受体2(HER2)阴性胃或胃食管结合部腺癌患者的一线治疗。这是帕博利珠单抗在中国获批的第12个适应症。
这次的批准主要是基于在KEYNOTE-868/NRG-GY018临床3期试验的积极结果。这是一项多中心、随机、双盲、安慰剂对照试验,入组了810例晚期或复发性子宫内膜癌患者。试验包括基于错配修复状态的两个独立队列:222例错配修复缺陷(dMMR)队列患者,和588例错配修复完善(pMMR)队列患者。患者随机(1:1)分配接受Keytruda联合化疗(卡铂和紫杉醇)接续Keytruda单药治疗,或接受安慰剂联合化疗后接续安慰剂单药治疗。患者并根据其MMR状态、ECOG体能状态(0或1 vs 2)和既往所接受辅助化疗种类进行随机化分层。试验的主要疗效终点为无进展生存期(PFS),由研究者根据RECIST 1.1标准进行评估。在dMMR队列中,Keytruda联合疗法组未达到中位PFS(95% CI:30.7,NR),安慰剂组的中位PFS为6.5个月(95% CI:6.4,8.7),两者具显著统计学差异(HR:0.30,95% CI:0.19-0.48;p<0.0001)。在pMMR队列中,Keytruda联合疗法组的中位PFS为11.1个月(95% CI:8.7-13.5),安慰剂组为8.5个月(95% CI:7.2,8.8),两者具统计学差异(HR:0.60,95% CI:0.46-0.78;p<0.0001)。该研究结果在2023年发表于《新英格兰医学杂志》上。
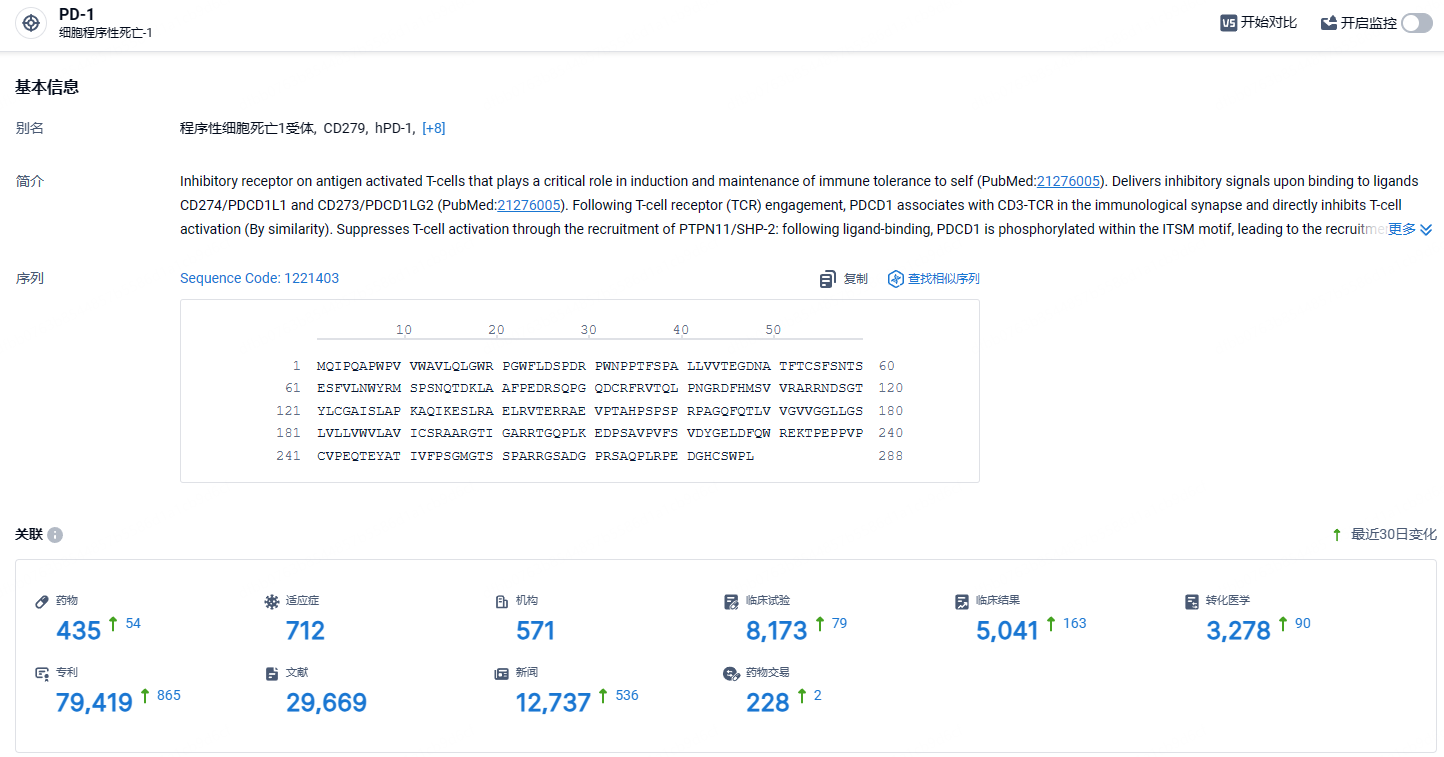
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月19日,PD-1 靶点共有在研药物435个,包含的适应症有712种,在研机构571家,涉及相关的临床试验8173件,专利多达79419件……PD-1/PD-L1靶点是研发非常火热的领域,国内目前已经有10余款相关新药上市,诸如恒瑞的卡瑞利珠单抗年销售额峰值更是接近50亿元人民币。在这一红海市场,商业化与更进一步的临床推进成了药企pk的重中之重,K药和O药是该赛道的标杆,国产PD-1/PD-L1新药如何与K药、O药竞争是不得不面对的难题。