阿斯利康三代EGFR抑制剂奥希替尼在美申报新适应症,针对非小细胞肺癌
2024年2月16日,阿斯利康宣布三代EGFR抑制剂奥希替尼新适应症获FDA批准,用于联合化疗一线治疗携带EGFR突变的非小细胞肺癌(NSCLC)患者。
奥希替尼是一种不可逆的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),具有抗CNS转移的临床活性。奥希替尼是全球第一个上市,也是中国首个获批的用于EGFR T790M突变阳性的局部晚期或转移性NSCLC的肿瘤药物,也是中国首个获批的第三代肺癌靶向药物。该产品已有3项适应症在中国上市,分别为:1)用于往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者;2)用于一线治疗EGFR外显子19缺失或外显子21(L858R)置换突变的NSCLC患者;3)用于EGFR敏感突变NSCLC成人患者肿瘤切除术后的辅助治疗。

本次获批主要是基于一项全球性、多中心、随机、开放标签的III期Flaura2研究积极数据。该研究共纳入586例患者,旨在评估奥希替尼联合或不联合化疗(培美曲塞+顺铂/卡铂)一线治疗携带EGFR突变的局部晚期(IIIB-III期)或转移性(IV期)NSCLC患者的有效性和安全性,主要终点为无进展生存期(PFS)。结果显示,与奥希替尼单药组相比,奥希替尼联合化疗组患者的PFS具有统计学意义和临床意义的延长,患者疾病进展或死亡风险降低了38%(HR=0.62;95% CI:0.49-0.79;p<0.0001)。研究者评估的中位PFS为25.5个月,较奥希替尼单药治疗(16.7个月)改善了8.8个月。盲法独立中心评价的PFS与研究者评估的结果相似,其中奥希替尼联合化疗组的中位PFS为29.4个月,较奥希替尼单药组(19.9个月)改善了9.5个月(HR 0.62; 95% CI 0.48-0.80; p=0.0002)。此外,总生存期(OS)数据在第二次期中分析时仍不成熟,但尚未观察到损害趋势(HR 0.75;95% CI 0.57-0.97)。该试验将继续以OS作为关键次要终点进行评估。安全性数据和不良事件导致的停药率与每种药物的既往研究数据一致。
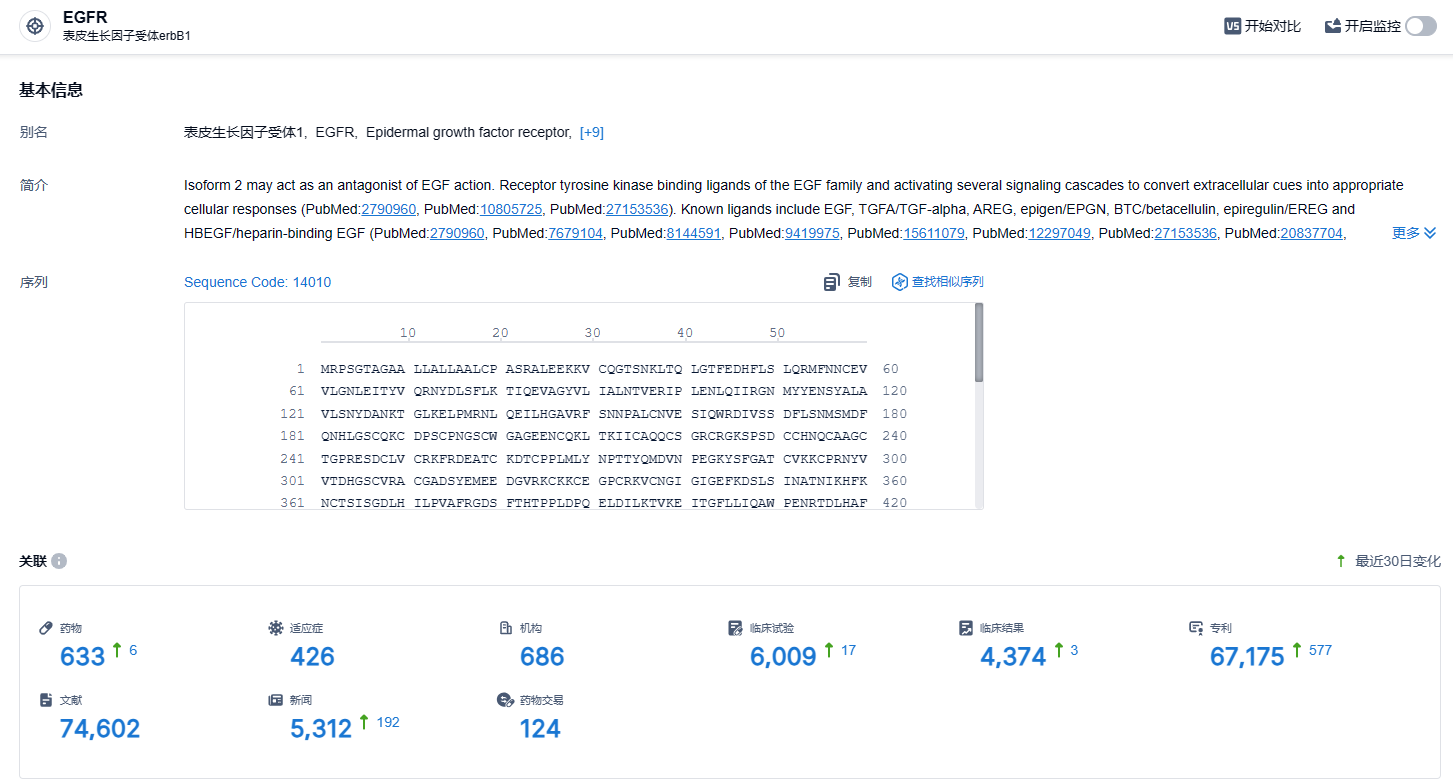
根据智慧芽新药情报库所披露的信息 (点击下方图片直达EGFR靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年2月19日,EGFR靶点共有在研药物633个,包含的适应症有426种,在研机构686家,涉及相关的临床试验6009件,专利多达67175件……自2015年上市以来,奥希替尼市场表现一路向好。该产品从2021年全年销售额开始超过50亿美元,2023年预计全年能突破60亿美元,期待该药能够获批更多适应症,惠及众多肺癌患者。