第5项!恒瑞医药HER2 ADC注射用SHR-A1811拟纳入突破性治疗品种,针对胃癌!
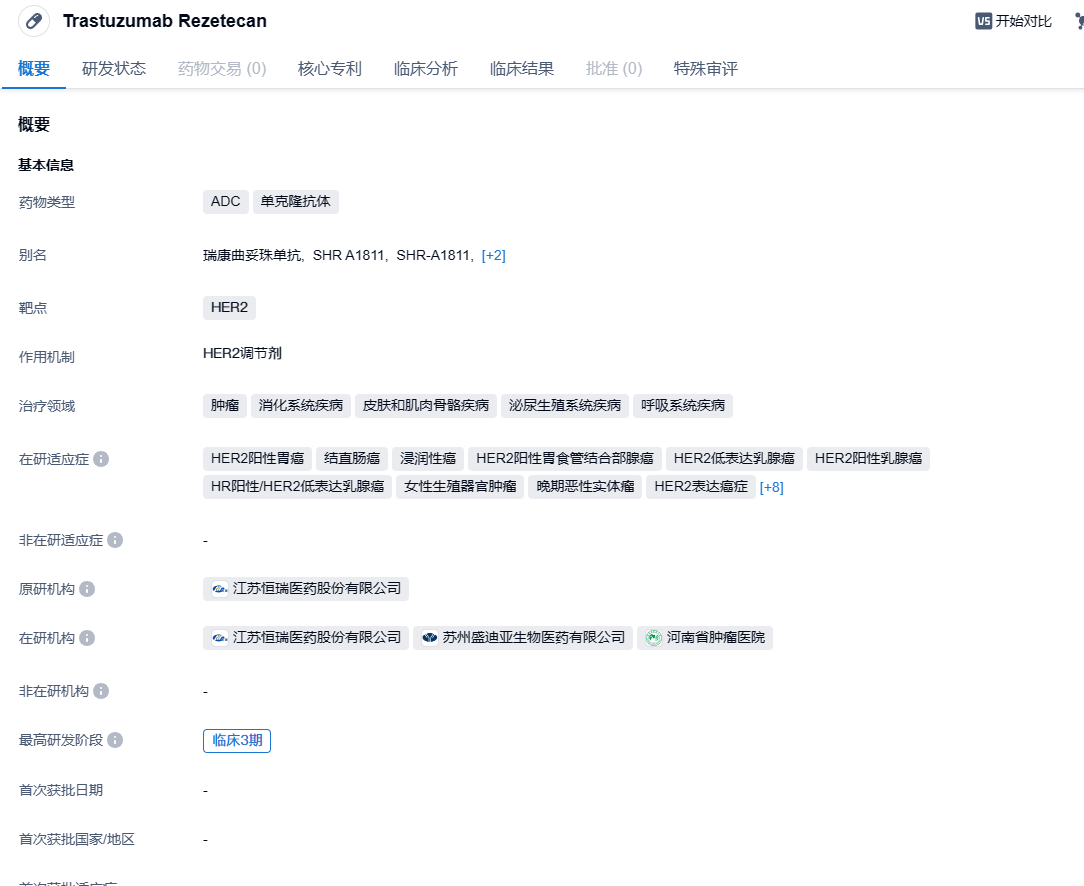
2024年2月1日,中国国家药监局药品审评中心(CDE)官网公示恒瑞医药申报的注射用SHR-A1811拟纳入突破性治疗品种,针对适应症为既往至少一线抗HER2治疗失败的HER2阳性晚期胃癌或胃食管结合部腺癌。
SHR-A1811(瑞康曲妥珠单抗)是恒瑞医药自主研发的、以HER2为靶点的抗体偶联药物(ADC),注射用SHR-A1811可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。SHR-A1811由曲妥珠单抗、可裂解四肽连接子和新型拓扑异构酶 I 抑制剂载荷 SHR9265 组成,DAR 值为 5.7。与 DS8201 相比,恒瑞在结构上进行了优化,在 SHR-A1811 的有效载荷与连接子临近处引入了一个手性环丙基。SHR-A1811目前已开展多项Ⅰ~Ⅲ期临床研究,涵盖HER2表达或突变的晚期实体瘤、晚期胃癌或胃食管结合部腺癌、结直肠癌、晚期非小细胞肺癌、转移性乳腺癌等。此前,SHR-A1811四项适应症已被国家药品监督管理局药品审评中心纳入突破性治疗品种名单,适应症分别为:HER2低表达的复发或转移性乳腺癌、HER2阳性的复发或转移性乳腺癌以及既往含铂化疗失败的HER2突变的晚期非小细胞肺癌、HER2阳性晚期结直肠癌。
恒瑞医药此前在2023年欧洲肿瘤内科学会(ESMO)大会上公布了SHR-A1811治疗HER2+晚期胃癌(GC)或胃食管交界癌(GEJ)的1期研究结果。截至数据截止日期(2023年4月21日),98例患者入组,包括55名GC/GEJ患者。
数据显示,在2期推荐剂量(RP2D)下,GC/GEJ和HER2阳性GC/GEJ的相应客观缓解率(ORR)分别为38.2%和43.8%;6个月无进展生存(PFS)率分别为71.0%和73.9%。安全性方面,98例患者中有67例(68.4%)发生3级治疗相关的不良事件(TRAE),所有发生的不良事件中≥10%为血液毒性。未报告间质性肺病。根据研究人员得出的结论,SHR-A1811在HER2阳性的GC/GEJ患者中显示出可接受的安全性和有希望的临床活性。
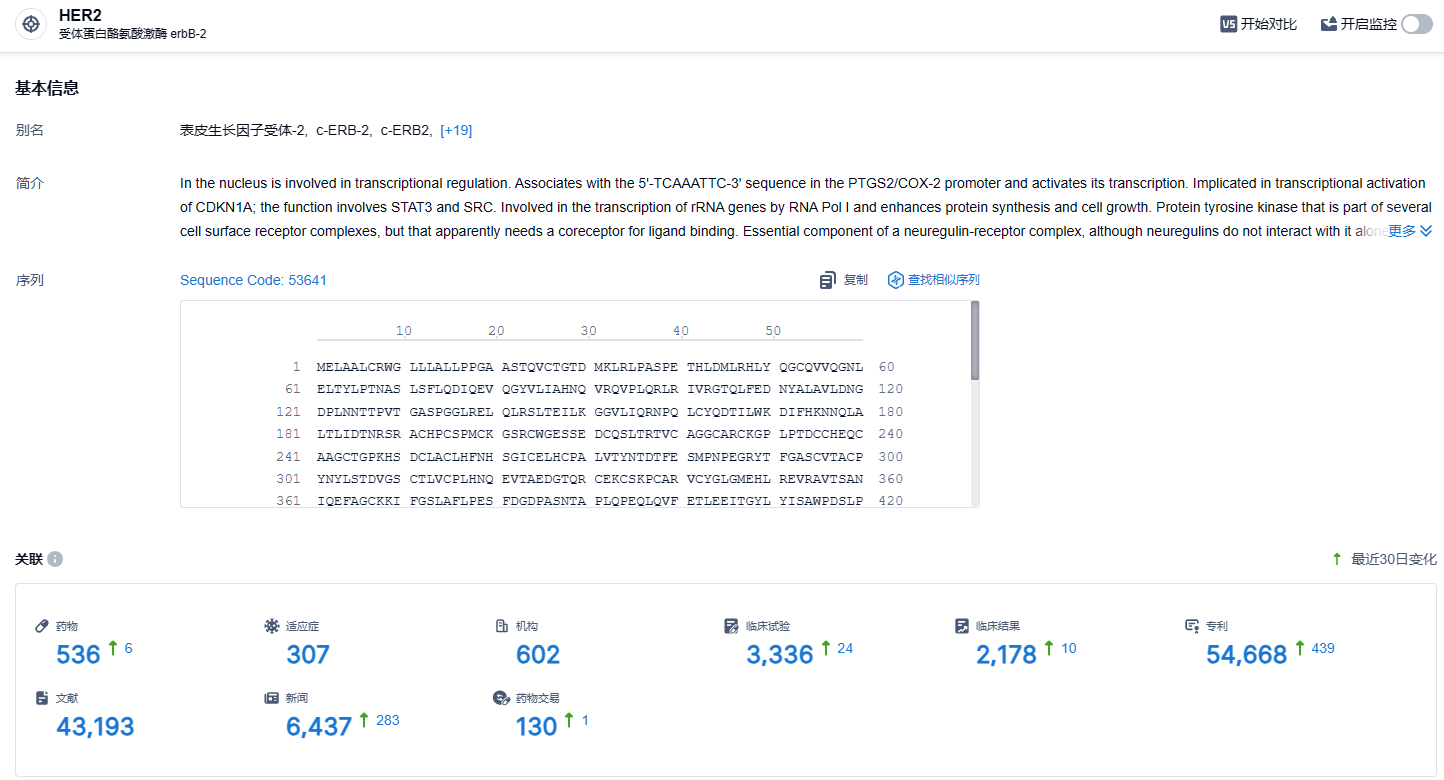
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 HER2 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年2月4日,HER2靶点共有在研药物536个,包含的适应症有307种,在研机构602家,涉及相关的临床试验3336件,专利多达54668件……SHR-A1811 首次临床申请始于 2020 年 5 月,次月就启动首个临床试验,当前已经针对乳腺癌、非小细胞肺癌、胃癌、结直肠癌开展了近20 项临床试验。SHR-A1811在T-DXd的结构基础上进一步优化,在多癌种中取得了良好的ORR及安全性数据,有望为恒瑞医药的肿瘤新药拓宽护城河。