预约演示
最新资讯
华辉安健靶向HBV pre-S1「立贝韦塔单抗」获FDA突破性疗法认定,针对慢性丁肝
2024-11-19
阅读时长 2分钟
11月18日,华辉安健宣布立贝韦塔单抗(HH-003)已于近日获FDA授予突破性疗法认定,用于治疗慢性丁型肝炎病毒(HDV)感染。2023年4月,该药已获得中国NMPA授予突破性疗法。
立贝韦塔单抗(HH-003)是华辉安健开发的一款靶向乙肝病毒表面大包膜蛋白前S1(HBV pre-S1)区的中和抗体。它可通过特异性结合HBV/HDV表面的PreS1区域,阻断HBV、HDV和其受体NTCP的结合从而阻止病毒进入肝细胞,中和病毒的感染。
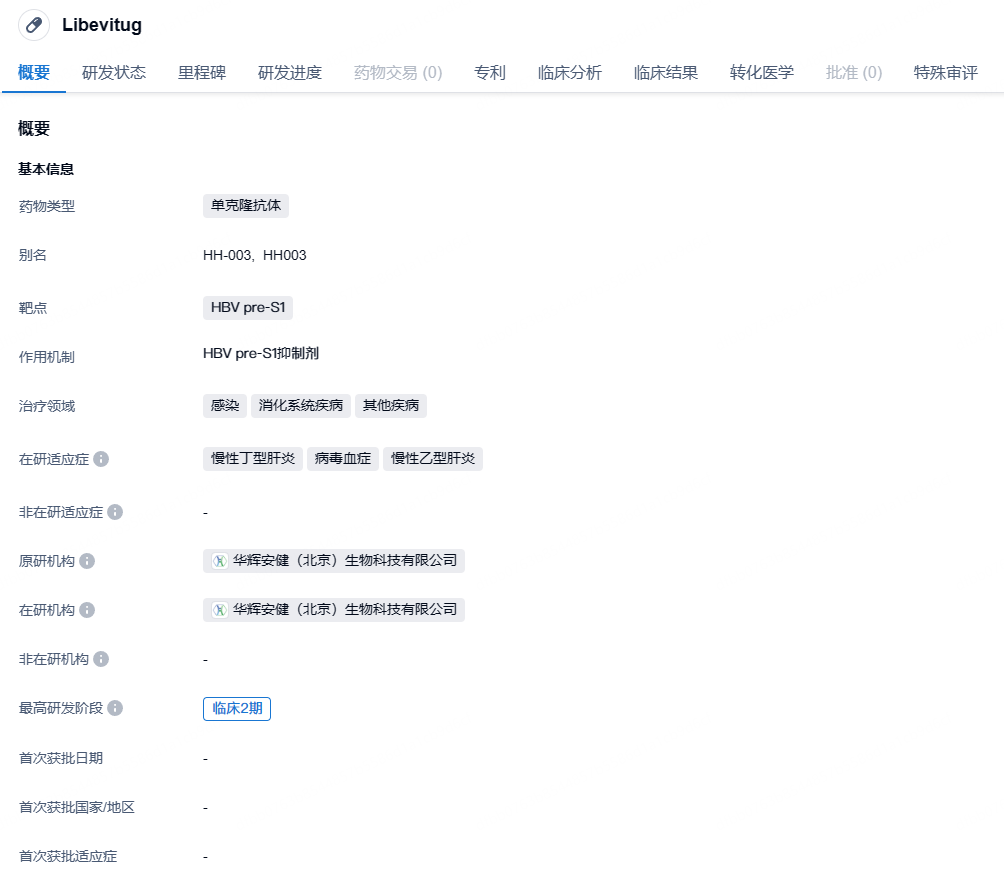
美国FDA授予立贝韦塔单抗BTD是基于两项针对慢性HDV感染者治疗24周的临床结果:HH003-201(NCT05674448)和HH003-204(NCT05861674)。立贝韦塔单抗在慢性HDV感染者中显示了令人鼓舞的疗效和良好的安全性。其中HH003-201临床数据已在欧洲肝病协会2023年会上发表;HH003-204是一项国际多中心、随机、对照、开放标签的关键临床试验,目前仍在进行中,研究结果将在获得所有受试者48周治疗的有效性和安全性数据后发表。
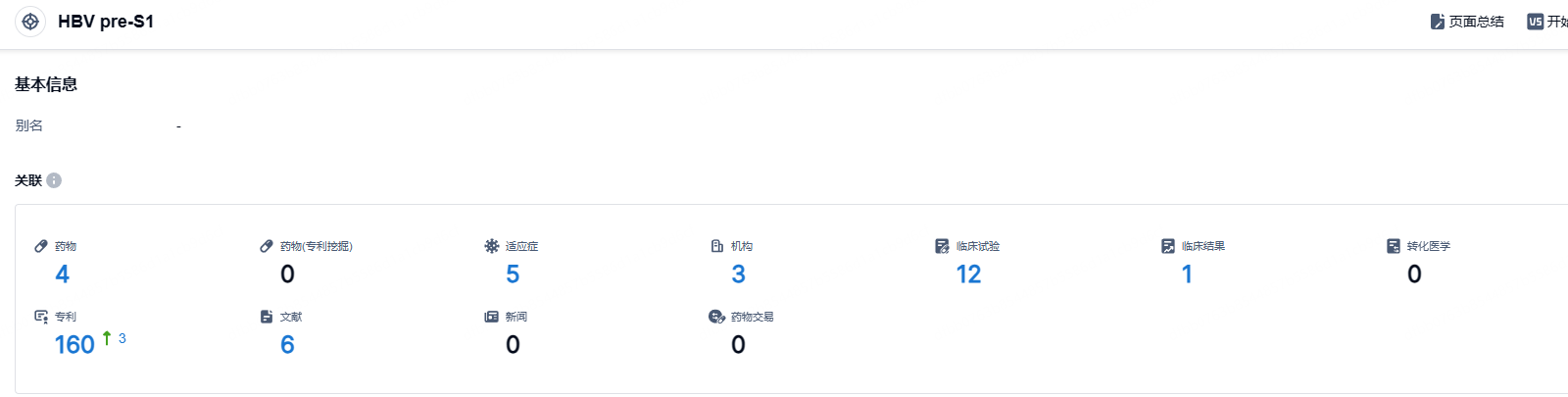
根据智慧芽新药情报库所披露的信息 (点击下方图片直达HBV pre-S1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月19日,HBV pre-S1靶点共有在研药物4个,包含的适应症有5种,在研机构3家,涉及相关的临床试验12件,专利多达160件……美国FDA的BTD旨在加快针对严重或危及生命的疾病药物开发和审批。临床上尚无有效药物,或有足够的临床证据表明新药优于目前已有药物。此次立贝韦塔单抗获得FDA突破性疗法认定,将加快其全球开发和上市审评进程。期待立贝韦塔单抗后续临床进展顺利。

Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
继续阅读
返回博客首页 →最新资讯
阅读时长 2分钟
礼来GIPR x GLP-1R激动剂替尔泊肽新3期结果发表NEJM,显著延缓心衰恶化
2024-11-19
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂
最新资讯
阅读时长 2分钟
信达生物HER2 ADC IBI354拟纳入突破性治疗,治疗铂耐药卵巢癌
2024-11-17
IBI354是抗HER2单克隆抗体-喜树碱衍生物偶联物,基于信达生物拥有自主知识产权的创新ADC linker-payload NT3技术平台。
最新资讯
阅读时长 2分钟
GSK旗下BCMA ADC belantamab mafodotin III期临床达到终点,头对头达雷妥尤单抗
2024-11-17
Blenrep(Belantamab mafodotin)是GSK开发的一种抗体偶联药物,由靶向B细胞成熟抗原(BCMA)的单克隆抗体与毒性载荷auristatin F通过不可切断的连接子连接而成。
最新资讯
阅读时长 2分钟
礼来GIPR x GLP-1R激动剂替尔泊肽最新3期临床试验结果,糖尿病进展风险降低94%
2024-11-15
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。