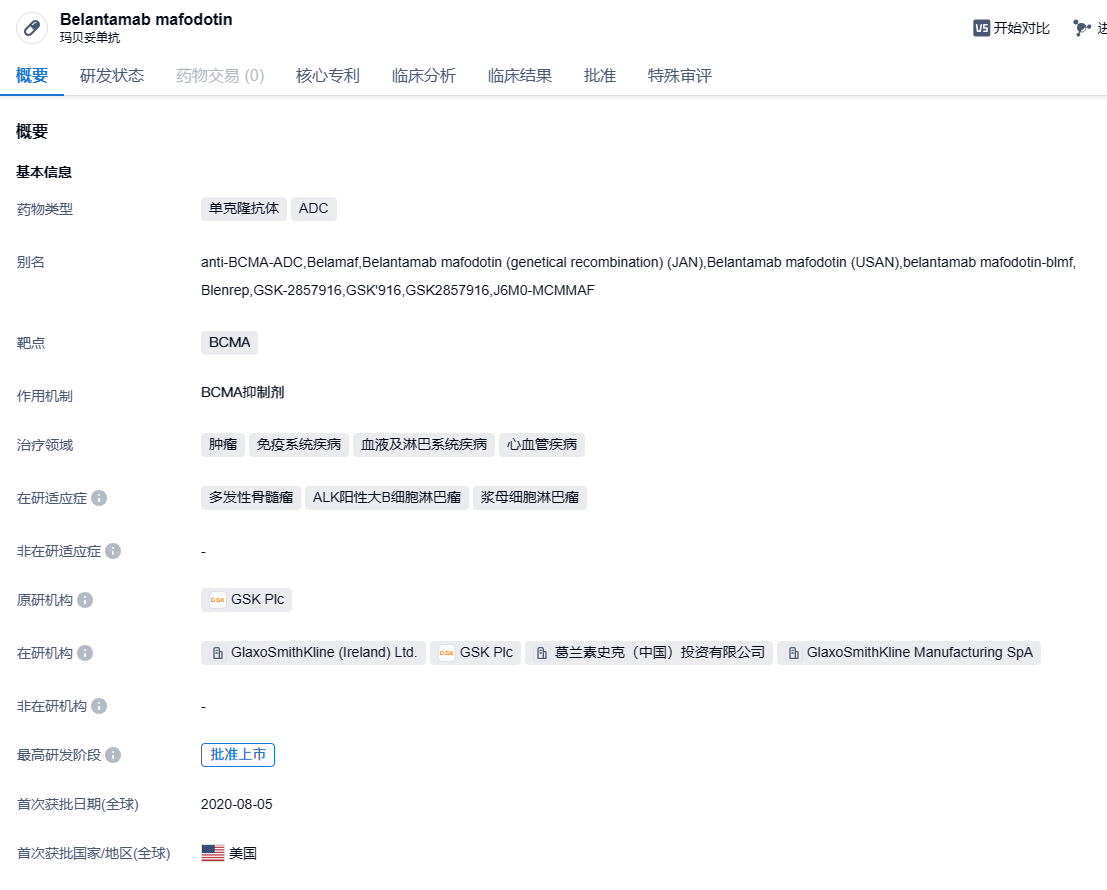
GSK靶向BCMA ADC Belantamab mafodotin拟纳入突破性治疗,针对多发性骨髓瘤
9月2日,CDE官网显示,由葛兰素史克(GSK)注册的注射用Belantamab mafodotin拟纳入突破性治疗品种,适应症为:与硼替佐米和地塞米松联合,用于治疗既往接受过至少一种治疗的多发性骨髓瘤成年患者。
Blenrep(Belantamab mafodotin)是GSK开发的一种抗体偶联药物,由靶向B细胞成熟抗原(BCMA)的单克隆抗体与毒性载荷auristatin F通过不可切断的连接子连接而成。2020 年 8 月获 FDA 加速批准用于治疗先前经过四线治疗失败的多发性骨髓瘤(MM)患者。2022年 11 月,GSK 宣布基于确证性 III 期临床 DREAMM-3 研究的失败,已应美国 FDA 的要求,启动了撤销 Blenrep 美国上市许可的程序。
2023年11月28日,GSK宣布了3期临床试验DREAMM-7计划中的中期疗效分析的积极顶线结果,作为2线疗法达到了无进展生存期(PFS)主要终点。GSK计划在2024年下半年与美国、日本和欧盟的监管机构共享试验数据,以期获得二线批准,重回市场。
DREAMM-7研究是一项随机、开放、多中心的III期临床,旨在评估belantamab mafodotin联合BorDex与达雷妥尤单抗联合BorDex治疗R/R MM患者的疗效和安全性,这些患者之前至少接受过一次治疗,并在最近一次治疗期间或之后出现疾病进展。研究共纳入494名受试者,按1:1的比例随机分组接受治疗。主要终点是PFS,关键次要终点包括OS、缓解持续时间和最小残留疾病阴性率。结果显示,与 daratumumab+BorDex(硼替佐米+地塞米松)相比,Blenrep+BorDex 联用疗法可显著延长患者疾病进展或死亡时间。此外,还观察到显著且具有临床意义的 OS 趋势,目前试验仍在继续进行中,进一步监测 OS 结果。
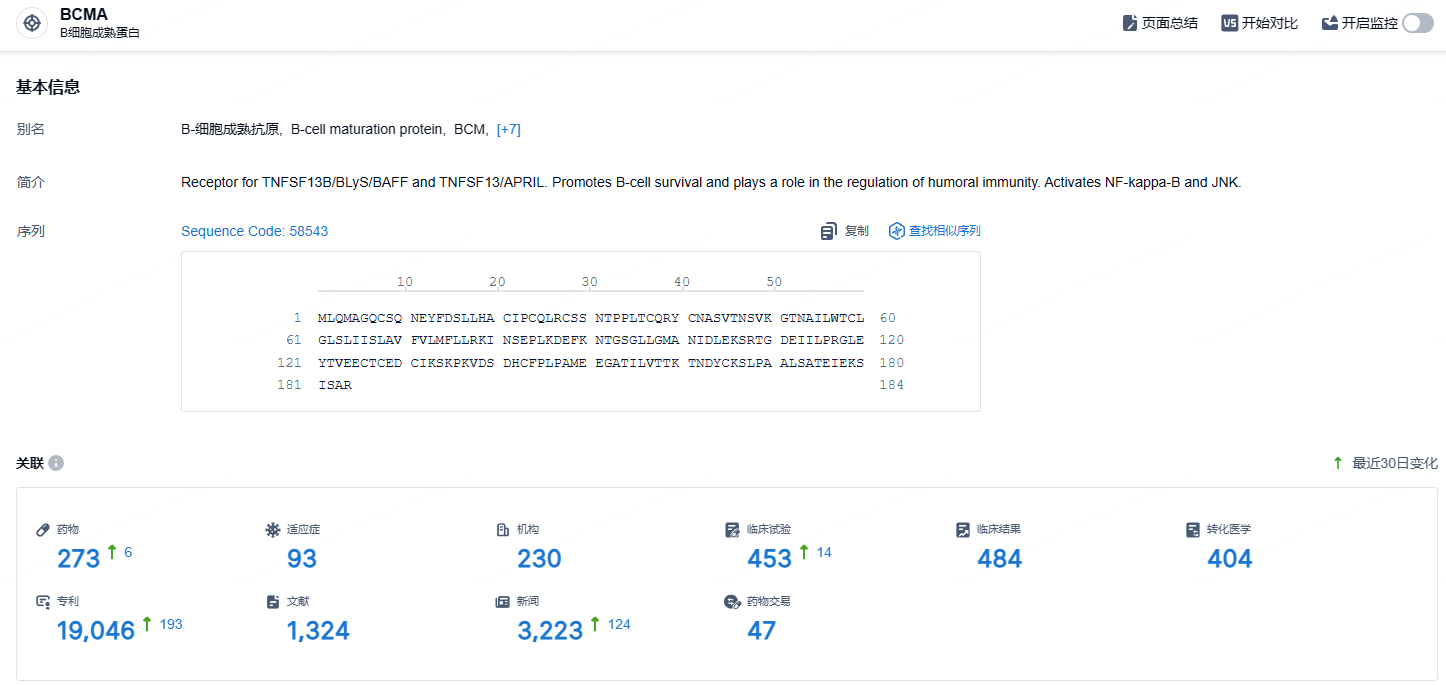
根据智慧芽新药情报库所披露的信息 (点击下方图片直达BCMA靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年9月3日,BCMA靶点共有在研药物273个,包含的适应症有93种,在研机构230家,涉及相关的临床试验453件,专利多达19046件……当前全球仅有 6 款 BCMA ADC 进入临床,且以CAR-T产品为主。期待belantamab mafodotin能够再次上市。