FDA批准诺华PI3Kα抑制剂阿吡利塞扩大适应症,针对乳腺癌
近日,FDA批准诺华PI3Kα抑制剂阿吡利塞(alpelisib)扩大适应症,将绝经前和围绝经期妇女纳入乳腺癌适应症治疗范围,该适应症变更为:与氟维司群联合用于治疗经FDA检测激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性、PIK3CA突变的晚期或转移性乳腺癌成人患者。
阿吡利塞(alpelisib)是首款针对HR+/HER2-、PIK3CA突变的晚期乳腺癌的药物,为口服小分子α特异性I类磷脂酰肌醇-3-激酶(PI3Kα)抑制剂,在携带PIK3CA基因突变的乳腺癌细胞系中显示出抑制PI3K通路的能力,并具有抑制细胞增殖作用。2019年5月,美国FDA批准诺华Alpelisib与氟维司群联合治疗应用于内分泌治疗期间或治疗后出现疾病进展的HR+/HER2-、PIK3CA突变的晚期乳腺癌的绝经后女性和男性患者,打开了PI3K抑制剂在实体瘤应用的大门。此后,Alpelisib快速获得了加拿大、欧盟等四十多个国家和地区相同适应症的获批。诺华创新药Alpelisib的面世,对改变携带PIK3CA突变的HR+/HER2-晚期乳腺癌患者的治疗格局至关重要,也为临床医生和患者提供了一种明确的治疗方法。
在III期临床研究SOLAR-1中,Alpelisib联合Fulvestrant的组合,显著改善了患者疾病控制时长,平均无进展生存期为11.0个月,而安慰剂组(安慰剂+Fulvestrant)只有5.7个月。如果患者未携带PIK3CA突变,则Alpelisib和安慰剂组的平均无进展生存器并无显著别差。由此可见,其靶向针对性非常明确。
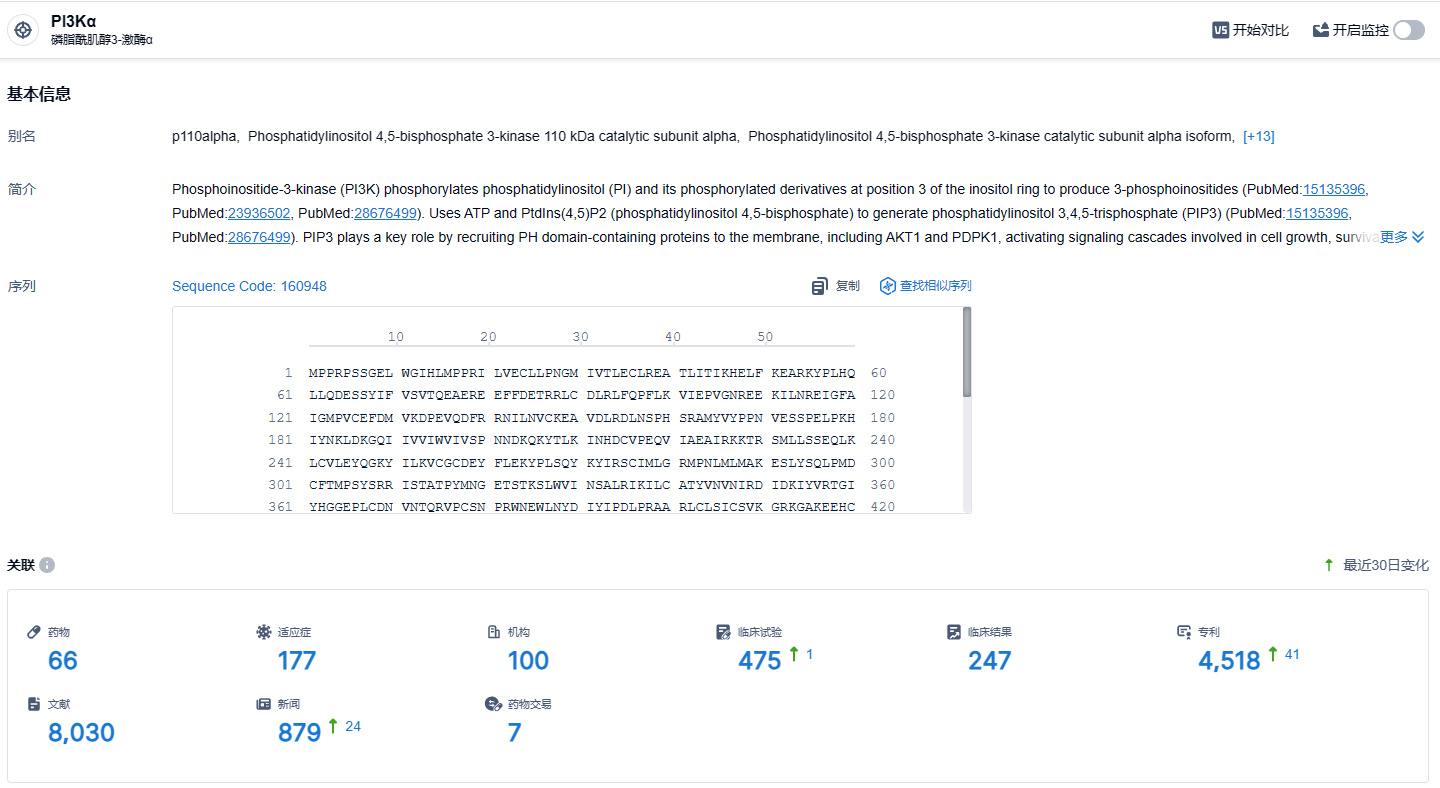
根据智慧芽新药情报库所披露的信息(点击下方图片直达PI3Kα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年1月23日,PI3Kα靶点共有在研药物66个,包含的适应症有177种,在研机构100家,涉及相关的临床试验475件,专利多达4518件……在全球范围内,每年约有36.2万人被诊断为转移性乳腺癌(mBC)。约40%的HR+/HER2-亚型患者的肿瘤中存在PIK3CA突变,该突变会刺激肿瘤生长,并且与治疗应答不佳、预后很差相关。Alpelisib扩大适应症有望惠及更多乳腺癌患者。