预约演示
最新资讯
博锐生物/恩沐生物联合开发创新三特异性抗体BR115获批临床,针对晚期实体瘤
2024-01-20
阅读时长 2分钟
2024年1月18日,中国国家药监局药品审评中心(CDE)官网公示,博锐生物与恩沐生物共同申报的1类新药CD3/HER2/HER2三特异抗体BR115注射液获批临床,拟开发治疗晚期恶性实体瘤。
BR115是针对实体肿瘤的T细胞介导三特异抗体。BR115基于恩沐生物的多功能抗体工程平台TRIAD构建,可同时靶向T细胞表面受体CD3和HER2不同表位,具有更好的肿瘤特异性,同时可以更好地针对TAA突变引起的肿瘤逃逸。BR115是博锐生物从恩沐生物引进的,2022年11月,博锐生物与恩沐生物达成合作,获得恩沐生物三特异抗体BR115(CMG6A19)的临床前开发和在大中华地区(包括中国大陆、香港、澳门及台湾)的临床注册、开发、生产以及商业化权益。
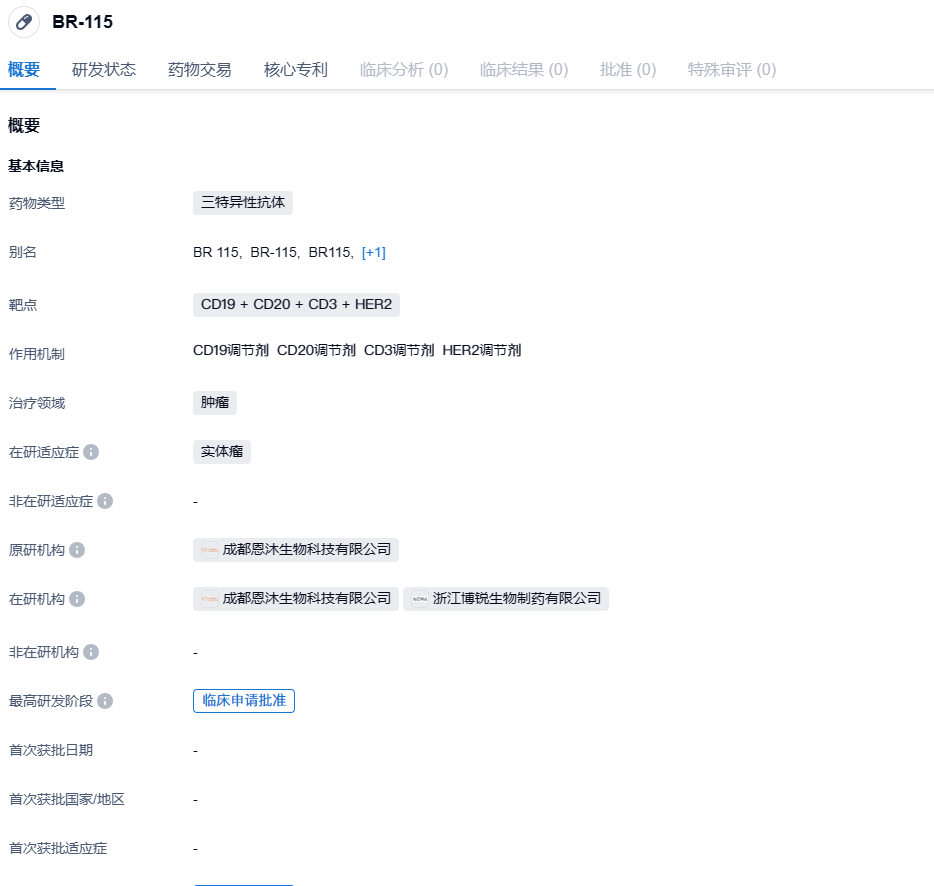
与传统双抗药物相比,BR115 能选择性地杀伤 HER2 高表达肿瘤细胞,而对 HER2 正常水平表达组织作用大幅减弱,具有更好的肿瘤特异性和安全性;对 HER2 抗原突变引起的肿瘤逃逸和复发具有预防作用。BR115 在多种 HER2 阳性的肿瘤移植模型中产生了显著且持久的肿瘤缓解,具有较好的临床价值。
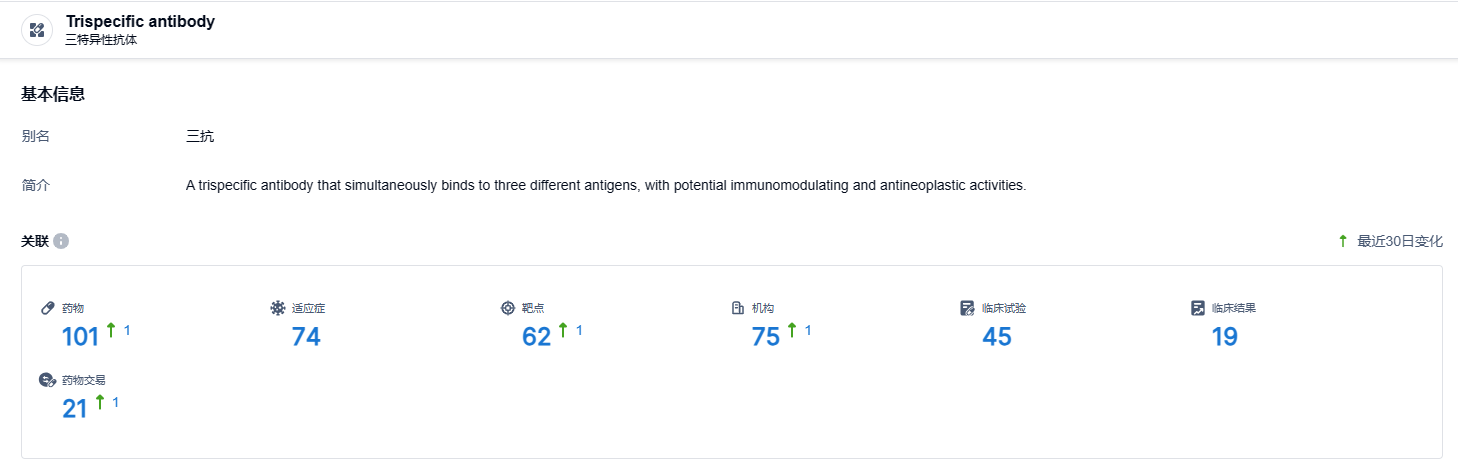
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达三特异抗体靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年1月20日,三特异抗体靶点共有在研药物101个,包含的适应症有74种,在研机构62家,涉及相关的临床试验45件,临床结果19件……BR115具有全新的分子设计和多种新的生物学机理,此次BR115临床试验申请获得国家药品监督管理局批准是该款新药研发进程中的重大进展。期待BR115临床试验推进顺利,为癌症患者提供新的治疗选择。

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
继续阅读
返回博客首页 →最新资讯
阅读时长 2分钟
PeproMene Bio公司靶向BAFFR CAR-T疗法展现抗癌潜力,针对B淋巴细胞白血病
2024-01-20
PMB-CT01是PeproMene Bio公司开发的全球首个靶向BAFF-R的自体CAR-T细胞疗法。
最新资讯
阅读时长 2分钟
惠升生物SGLT-2抑制剂加格列净片获批上市,治疗2型糖尿病
2024-01-20
加格列净是惠升生物自主研发的SGLT2抑制剂,已经获得中国、美国、欧洲、日本和韩国专利权,用于治疗2型糖尿病
最新资讯
阅读时长 2分钟
百济神州PD-1单抗替雷利珠单抗递交第15项适应症上市申请,治疗非小细胞肺癌
2024-01-20
百泽安®(替雷利珠单抗注射液)是一款人源化IgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合。
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。