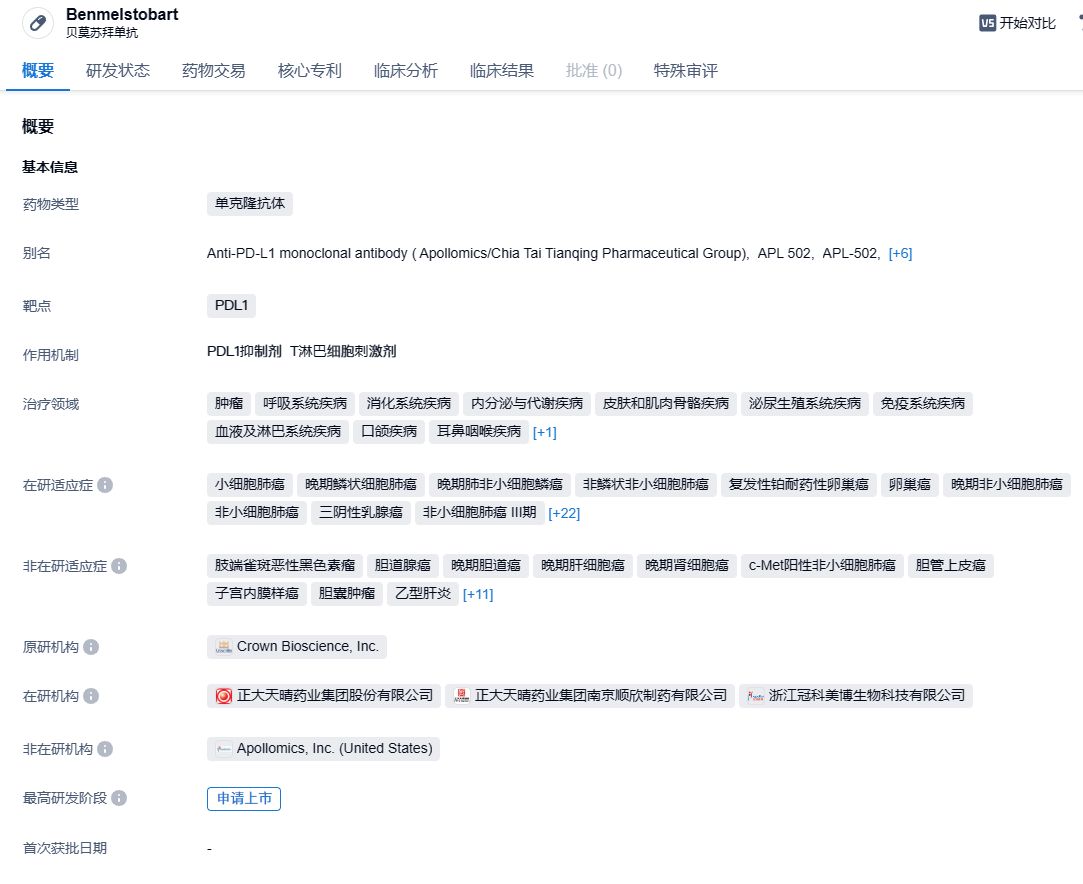
正大天晴PD-L1单抗贝莫苏拜单抗申报新适应症,治疗子宫内膜癌
2024年1月31日,CDE网站显示,正大天晴PD-L1单抗TQB2450(贝莫苏拜单抗)的新适应症拟纳入优先审评,用于联合盐酸安罗替尼胶囊治疗既往接受一、二线化疗方案治疗失败或不能耐受的非微卫星高度不稳定(非MSI-H)或非DNA错配修复缺陷(非dMMR)的复发性或转移性子宫内膜癌患者。
贝莫苏拜单抗是正大天晴研发的全新序列的创新抗PD-L1人源化单克隆抗体,可阻止PD-L1与T细胞表面的PD-1和B7.1受体结合,使T细胞恢复活性,从而增强免疫应答。贝莫苏拜单抗上市申请已于2023年1月递交国家药品监督管理局并获得受理,目前正在评审中,申报的适应症为联合安罗替尼和依托泊苷及卡铂一线治疗广泛期小细胞肺癌。
2023年9月,正大天晴发布,其1类创新药小分子多靶点受体酪氨酸激酶抑制剂安罗替尼和PD-L1抑制剂贝莫苏拜单抗(benmelstobart,TQB2450)多项临床研究成果入选2023年世界肺癌大会(WCLC)口头报告、壁报。其中,在贝莫苏拜单抗联合疗法一线治疗广泛期小细胞肺癌(ES-SCLC)患者的3期ETER701研究中,患者的中位OS提高至19.3个月,刷新了目前总生存期记录。
在一项随机、双盲、平行对照、多中心III期的ETER701研究临床中,既往未经系统治疗的ES-SCLC患者 1:1:1 随机分为三组,分别接受贝莫苏拜单抗+安罗替尼+依托泊苷+卡铂后采用贝莫苏拜单抗+安罗替尼维持、接受安慰剂+安罗替尼+依托泊苷+卡铂后采用安慰剂+安罗替尼维持、接受安慰剂+依托泊苷+卡铂后采用安慰剂维持。主要终点为独立影像评估委员会(IRC)评估的总生存期(OS)及无进展生存期(PFS),次要终点包括研究者评估的PFS、客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DOR)及安全性等。
研究结果显示,在主要终点中,两组人群中IRC评估的中位PFS存在显著差异,且为历史最高值,分别为6.93个月 vs 4.21个月。IRC评估的中位OS也有较为显著的差异,远高于既往研究,为历史最高值,分别为19.32个月 vs 11.89个月。
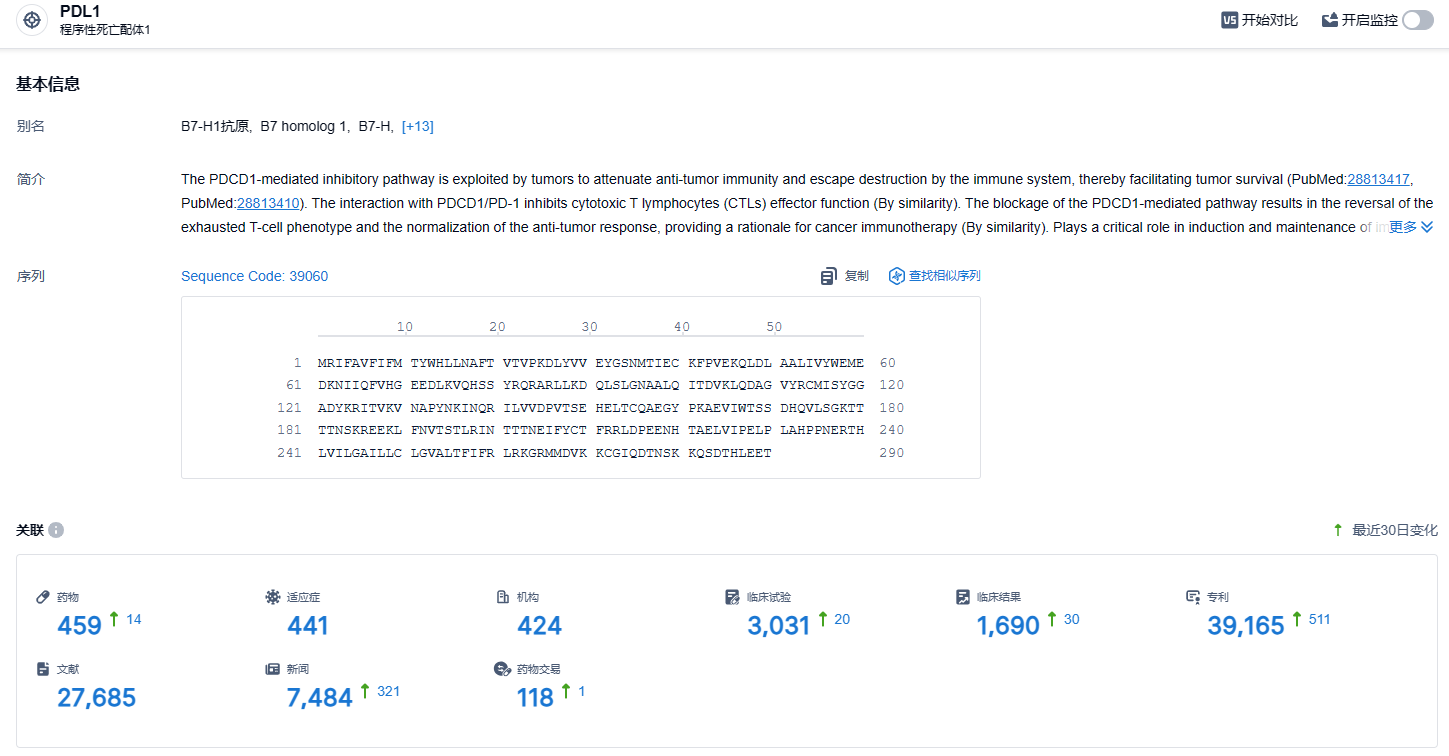
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-L1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年2月1日,PD-L1靶点共有在研药物459个,包含的适应症有441种,在研机构424家,涉及相关的临床试验3031件,专利多达35165件……截止目前,国内共有15款PD-(L)1抑制剂获批上市,除去4家海外药企的产品,共有12款国内自研产品上市。国内PD-(L)1抑制剂赛道处于非常内卷的程度,具有更优秀的临床数据和能够解决未满足的医疗需求才是后来企业需要重视的问题。期待贝莫苏拜单抗能够在这场内卷大战中脱颖而出。