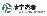预约演示
更新于:2025-05-07
3D Medicines (Sichuan) Co., Ltd.
四川思路康瑞药业有限公司|私营公司|2016|中国四川省
四川思路康瑞药业有限公司|私营公司|2016|中国四川省
更新于:2025-05-07
概览
标签
神经系统疾病
遗传病与畸形
免疫系统疾病
纳米抗体
关联
1
项与 四川思路康瑞药业有限公司 相关的药物20
项与 四川思路康瑞药业有限公司 相关的临床试验NCT04910386
A Randomized, Open-Label, Multicenter Phase 2 Study of Envafolimab in Combination With Gemcitabine Plus Cisplatin Versus Gemcitabine Plus Cisplatin as the First-line Treatment in Patients With Locally Advanced or Metastatic Biliary Tract Cancers
This is a Randomized, Open-Label, Multicenter Phase 2 Study to access the efficacy and safety of Envafolimab in Combination with Gemcitabine Plus Cisplatin Versus Gemcitabine Plus Cisplatin as the First-line Treatment in Patients with Locally Advanced or Metastatic Biliary Tract Cancers
开始日期2025-06-01 |
申办/合作机构 |
CTR20233392
恩沃利单抗联合含铂双药化疗对比安慰剂联合含铂双药化疗用于可切除III期非小细胞肺癌患者新辅助/辅助治疗的随机、对照、双盲、多中心III期临床研究
比较恩沃利单抗联合化疗与安慰剂联合化疗新辅助/辅助治疗可手术切除非小细胞肺癌受试者的主要病理学缓解率和无事件生存期。
开始日期2023-11-27 |
申办/合作机构 四川思路康瑞药业有限公司 [+1] |
NCT06123754
A Randomized, Controlled, Double-blind, Multicenter Phase III Clinical Study of Envafolimab Plus Platinum-based Doublet Chemotherapy Versus Placebo Plus Platinum-based Doublet Chemotherapy in Patients With Non-small Cell Lung Cancer
This is a randomized, controlled, double-blind, multicenter Phase 3 clinical study to assess the efficacy and safety of envafolimab plus platinum-based doublet chemotherapy versus placebo plus platinum-based doublet chemotherapy as neoadjuvant/adjuvant therapy in subjects with resectable stage IIIA and IIIB (N2) NSCLC. Primary study endpoints are MPR rate assessed by BIPR and EFS assessed by BIRC.
开始日期2023-11-17 |
申办/合作机构 |
100 项与 四川思路康瑞药业有限公司 相关的临床结果
登录后查看更多信息
0 项与 四川思路康瑞药业有限公司 相关的专利(医药)
登录后查看更多信息
12
项与 四川思路康瑞药业有限公司 相关的新闻(医药)2024-12-09
郑希元, 刘国伟. 《医药新技术与专利法》[M]. 北京: 知识产权出版社, 2022, 212-215.
单抗药物市场之争[1]
2005年,日本小野制药和美国梅达雷克斯制药共同合作开发Nivolumab[2](纳武利尤单抗,商品名为Opdivo,俗称“O药”),并于2006年提交PCT申请,公开号为WO2006121168A1,之后陆续在日本、美国、中国以及欧洲等药品主流市场获得专利授权。2009年,百时美施贵宝斥资24亿美元收购梅达雷克斯制药,将Nivolumab项目收入囊中,其临床试验、知识产权与后续开发权利由百时美施贵宝所主导。2014年7月4日,Nivolumab获得日本医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)的上市批准,同年12月22日获得FDA的上市批准,2015年6月19日获得EMA的上市批准,并由小野制药在日本销售,百时美施贵宝在美国和欧洲销售。该药批准的适应证为转移性黑色素瘤、非小细胞肺癌、晚期肾细胞癌、霍奇金淋巴瘤等。
此外,百时美施贵宝的竞争对手默沙东于2009年收购先灵葆雅,获得MK-3475(即帕博利珠单抗Pembrolizumab,商品名为Keytruda,俗称“K药”,一种新型的人源化IgG4-κ型单克隆抗体,通过作用于PD-1,阻断PD-1/PD-L1通路,进而有助于人体免疫系统攻击肿瘤细胞)的后续开发权。该药于2014年9月4日获得FDA的上市批准,又于2015年7月17日获得EMA的上市批准,用于治疗转移性黑色素瘤、非小细胞肺癌、晚期黑色素瘤。[3]
然而,正当默沙东还沉浸在Keytruda获得FDA批准的喜悦中时,百时美施贵宝一纸诉状将其告上美国特拉华州联邦地区法院,百时美施贵宝及其日本合作伙伴小野制药称,PD-1抑制剂的美国专利由小野制药获得,并已许可给百时美施贵宝,授权范围涵盖该药物在肿瘤领域的应用,默沙东侵犯了小野制药和百时美施贵宝在美国上市的PD-1抑制剂Opdivo的专利。据此,百时美施贵宝在起诉书中要求法院判决Keytruda侵权。对此,默沙东承认小野制药确实享有Keytruda产品的方法专利,但同时表示,该专利是无效的。经过几番诉讼,2017年1月,百时美施贵宝在专利纠纷中获胜,与默沙东达成和解协议:默沙东首先要向百时美施贵宝/小野制药支付6.25亿美元的专利许可费首付款,另外在2017年1月1日至2023年12月31日期间,默沙东需按6.5%的比例向百时美施贵宝支付销售提成,在2024年1月1日至2026年12月31日期间,需按2.5%的比例支付销售提成。[4]百时美施贵宝与小野制药则按照3∶1的比例平分这笔额外收益。2020年,默沙东的Keytruda全球销售额增长30%,达到144亿美元[5],K药对于默沙东业绩的贡献占比达到30%,预计2026年的全球销售额可能达到243.2亿美元[6]。2020年,百时美施贵宝公司的Opdivo全球销售额达到79.2亿美元,当年获得了FDA的7项批准,其中2项与CTLA4免疫疗法Yervoy联合使用,用于关键的非小细胞型肺癌(NSCLC)领域。
百时美施贵宝与默沙东在国际市场上战得难解难分,然而在中国市场却是一片“和平”的景象。截至2022年2月28日,国内已有12款PD-1/PD-L1单抗获批上市,包括6款国产PD-1抗体[7][8]、2款国产PD-L1抗体[9]、2款进口PD-1抗体和2款进口PD-L1抗体。其中,8款药物2020年的市场表现如表2-10-1所示。[10]由于PD-1单抗药物是一类适应证很广的肿瘤免疫治疗药物,所以每家制药公司获批的适应证不尽相同,例如信迪利单抗获得国家药品监督管理局的批准,联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(nsqNSCLC)的一线治疗,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤[11],联合吉西他滨和铂类化疗治疗不可手术切除的局部晚期或转移性鳞状非小细胞肺癌,以及联合贝伐珠单抗注射液用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗;卡瑞利珠单抗除用于上述霍奇金淋巴瘤治疗外,还获批用于晚期肝细胞癌、食管癌、二线及以上鼻咽癌、一线鼻咽癌以及非小细胞肺癌的治疗[12],并于2020年底正式被纳入国家医保目录。截至2022年2月28日,卡瑞利珠单抗和替雷利珠单抗是国内获批适应证最多的PD-1/PD-L1抗体(均为6项),替雷利珠单抗是医保覆盖范围最广的PD-1/PD-L1抗体(5项适应证)。
表2-10-12020年PD-1/PD-L1抗体市场表现
②信迪利单抗是信达生物制药和礼来制药在中国共同合作研发的创新生物药,也是双方合作的首个硕果。2020年8月18日,双方签署协议,礼来制药将获得信迪利单抗在中国以外地区的独家许可,信达生物制药将获得累计超10亿美元款项。
③2022年2月26日,百济神州发布2021年度业绩快报公告,PD-1抗体替雷利珠单抗2021年在中国的销售额为16.47亿元人民币。
下面笔者就小野制药在美国、欧洲和中国获得授权的同族专利的保护范围进行分析。
美国授权专利US8728474B2[13]的权利要求1如下所示。
1.一种用于治疗肿瘤患者的方法,包括给予患者药物有效量的抗-PD-1单克隆抗体。
欧洲授权专利EP1537878B1的权利要求1如下所示。
1.抑制PD-1的免疫抑制信号的抗-PD-1抗体在制备用于癌症治疗的药物中的应用。
中国授权专利CN101213297B的权利要求1如下所示。
1.人单克隆抗体或其抗原结合部分,其包含
氨基酸序列如SEQ ID NO:18所列的重链可变区CDR1;
氨基酸序列如SEQ ID NO:25所列的重链可变区CDR2;
氨基酸序列如SEQ ID NO:32所列的重链可变区CDR3;
氨基酸序列如SEQ ID NO:39所列的轻链可变区CDR1;
氨基酸序列如SEQ ID NO:46所列的轻链可变区CDR2;和
氨基酸序列如SEQ ID NO:53所列的轻链可变区CDR3,
其中所述抗体或其抗原结合部分与人PD-1特异性结合。
比较上述权利要求的保护范围不难发现,小野制药美国和欧洲授权专利的保护范围相比于中国授权专利的保护范围宽了不少,几乎是任何人未经允许将任何PD-1抗体用于治疗任何肿瘤或癌症的用途都将落入US8728474B2和EP1537878B1的保护范围内并构成侵权,然而这样的权利要求在中国是无法获得授权的。
[1] 郑希元,李海霞. PD-1单克隆抗体药物的相关专利分析[J]. 中国知识产权杂志,2017(8).
[2] Nivolumab所涉及的PD-1最早由日本京都大学的免疫学家本庶佑(Tasuku Honjo)于1992年发现,发现之初,就与日本小野制药进行联合开发。
[3] 从俊杰,宿央央,霍春芳,等. PD-1/PD-L1抗体的专利分析[J]. 今日药学,2017(6):420-424.
[4] 丁言. PD-1/PD-L1抗体烽烟再起[N]. 医药经济报,2017-03-15(F02).
[5] MERCK官网. Merck Announces Fourth-Quarter and Full-Year 2020 Financial Results[EB/OL].(2021-02-04)[2021-11-10]. https://www-merck-com.libproxy1.nus.edu.sg/news/merck-announces-fourth-quarter-and-full-year-2020-financial-results/.
[6] 陈淑文. 全球前四畅销药“专利悬崖”危机逼近,艾伯维、默沙东、BMS如何应对?[EB/OL].(2021-07-15)[2021-08-09]. https://mp.weixin.qq.com/s/1UZ8G5sy8bt6to1PpbJJVg.
[7] 2021年8月3日,正大天晴康方(上海)生物医药科技有限公司的PD-1抗体派安普利注射液获得国家药品监督管理局批准上市,成为第5款获批上市的国产PD-1抗体,其适应证为复发或难治性经典霍奇金淋巴瘤(cHL)。
[8] 2021年8月30日,誉衡药业/药明生物研发的重组全人抗PD-1单克隆抗体——赛帕利单抗注射液(GLS-010注射液)获得国家药品监督管理局批准上市,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤(r/r cHL)患者。
[9] 2021年11月25日,国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准四川思路康瑞药业有限公司申报的恩沃利单抗注射液(商品名:恩维达)上市,其是目前全球首个获批的皮下注射给药的PD-L1抗体,适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗。2021年12月13日,NMPA批准基石药业(苏州)有限公司申报的舒格利单抗注射液(商品名:择捷美,重组抗PD-L1全人源单克隆抗体)上市,该药品适用于联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗。
[10] 青瓦PD-1商业大战背后的BD策略[EB/OL].(2021-04-20)[2021-05-13]. http://www.pharmcube.com/index/news/article/6774.
[11] 信达生物官网. 信达生物联合礼来制药宣布达伯舒(信迪利单抗注射液)获得国家药品监督管理局批准联合培美曲塞和铂类化疗用于一线治疗非鳞状非小细胞肺癌[EB/OL].(2021-02-03)[2021-10-24]. http://cn.innoventbio.com/#/news/249.
[12] 恒瑞官网. 注射用卡瑞利珠单抗[EB/OL].(2021-06-08)[2021-10-24]. https://www.hengrui.com/product/innovativeMedicine.html#pie5.
[13] 考虑到US8728474B2等6件美国专利的公开内容涉及诺贝尔获奖者Tasuku Honjo与另两位科学家Wood博士和Freeman博士的部分研究合作内容,美国联邦巡回上诉法院在2020年7月14日公布的Dana-Farber Cancer Institute, Inc.v.Ono Pharma.Co.,LTD.No.19-2050(Fed.Cir.2020)案判决中认定Tasuku Honjo及其团队成员与另两位科学家Wood博士和Freeman博士为共同发明人,他们均对涉案专利的发明构想作出了积极贡献。
目录
(下翻查看完整目录)
第1章 医药新技术与新政策
1.1医药技术发展新趋势
1.1.1抗体药物偶联物
1.1.2双(多)特异性抗体
1.1.3NTRK融合基因靶向药
1.1.4膜内外蛋白降解技术
1.1.5AI制药与基因疗法
1.2中国医药行业发展演变
1.2.1药品注册政策与上市分析
1.2.2医保谈判与集中带量采购
1.2.3授权合作与尽职调查
1.3中国医药专利制度演变
第2章 医药专利类型与授权、确权和侵权
2.1化合物
2.1.1新颖性判断规则变化
2.1.2创造性判断思路与比较分析
2.1.3无效宣告请求阶段的修改与举证
2.2盐
2.2.1中国典型案例分析
2.2.2美国典型案例分析
2.2.3中美案例比较研究
2.3晶型
2.3.1国内外新颖性评判标准
2.3.2鉴别方法与新颖性评判案例
2.3.3美国创造性评判标准与实践
2.3.4中国创造性评判标准与实践
2.3.5中美创造性评判差异及启示
2.4前药、代谢物和中间体
2.4.1前药侵权性质认定
2.4.2专利间接侵权法律制度
2.4.3前药与代谢物专利侵权案例
2.4.4代谢物专利布局案例
2.4.5中间体专利侵权案例
2.4.6启示与不同的声音
2.5医药用途
2.5.1瑞士型权利要求的演进
2.5.2医药用途权利要求撰写方式
2.5.3中国新颖性评判标准与案例
2.5.4中国创造性评判标准与案例
2.6制备方法与新产品制造方法
2.6.1制备方法专利侵权与创造性判断
2.6.2新产品制造方法专利侵权诉讼
2.7手性化合物
2.7.1药理活性与毒副作用
2.7.2中欧新颖性评判标准分析
2.7.3中美创造性评判差异分析
2.7.4审查差异与启示
2.8药物制剂
2.8.1药用辅料发明的中美评判标准
2.8.2剂型转换发明的创造性判断
2.9药物组合物
2.9.1化学药组合物创造性评析
2.9.2中药组合物创造性评析
2.10抗体
2.10.1肿瘤免疫疗法研究进展
2.10.2单抗药物市场之争
2.10.3中欧专利审查“支持”问题
2.10.4国外专利布局分析与举例
2.10.5国外专利布局考虑因素
2.10.6中欧专利审查创造性标准
2.10.7对我国医药企业的启示
2.11基因与微生物
2.11.1中国基因专利创造性评析
2.11.2美国基因专利创造性评析
2.11.3微生物可专利性演变
2.11.4微生物专利无效与侵权诉讼
2.12胚胎干细胞
2.12.1伦理要求变化
2.12.2可专利性案例分析
2.12.3中国相关法律规定
2.12.4其他国家/地区相关法律规定
第3章 医药专利法律问题
3.1优先权认定
3.1.1在后申请中缺少的技术特征
3.1.2技术方案是否实质相同
3.1.3在先申请是否为“首次申请”
3.2商业成功
3.2.1商业成功的中美相关规定
3.2.2中国关于“商业成功”的案例
3.2.3美国关于“商业成功”的案例
3.2.4商业成功在中国的可操作性探讨
3.3技术偏见
3.3.1“肯定的”技术偏见与“消极的”技术偏见
3.3.2中国无效诉讼案例
3.3.3美国同族授权专利审查档案
3.3.4案例分析与启示
3.4实验数据
3.4.1说明书充分公开问题
3.4.2补充实验数据问题
3.4.3补充实验设计问题
3.4.4实验数据真实性问题
3.5等同侵权
3.5.1数值范围特征
3.5.2封闭式权利要求
3.5.3放弃的技术方案
第4章 医药专利法律制度
4.1药品专利链接制度
4.1.1中美药品专利链接制度对比
4.1.2韩国和加拿大如何选择
4.1.3欧盟和印度如何选择
4.1.4中国实践中可能存在的困境
4.2药品专利期限补偿制度
4.2.1计算方法
4.2.2适用对象
4.2.3保护范围
4.2.4限制规定差异
4.3Bolar例外条款
4.3.1条款起源及发展状况
4.3.2中国Bolar例外条款
4.3.3Bolar例外条款与行政审批
4.3.4仿制药研发的未来出路
第5章 医药专利典型案例评析
5.1张某田诉欧意药业有限公司等侵犯发明专利权纠纷再审案
5.1.1案情概述
5.1.2最高人民法院的改判
5.1.3针对该案的法律分析
5.1.4该案所带来的启发
5.2礼来公司诉华生公司发明专利侵权案
5.2.1案情概述
5.2.2针对该案的法律分析
5.2.3该案所带来的启发
5.3国家知识产权局、中惠公司与众生公司发明专利权无效行政纠纷案
5.3.1案情概述
5.3.2光盘背景介绍
5.3.3判决要旨及诉讼应对策略
5.3.4新药光盘不能视为现有技术
5.4确认不侵犯专利权若干问题的分析
5.4.1案情概述
5.4.2法理分析
5.4.3侵权比对分析
5.4.4禁止反悔原则
5.4.5本案带来的启发
案例索引
后记
并购专利侵权上市批准
2024-11-30
·药智网
在每年北京最冷的时候,也是医药企业的关注点格外统一的时候,无论是否参与,企业都翘首以盼医保谈判的最终结果。2024年11月28日,国家医保局联合人力资源和社会保障部正式发布2024年医保目录,其中91种药品新增进入医保目录,医保谈判整体成功率达76%,创多项历史之最。
由此可见,医保对于中国药企的重大意味,隐约间已成为药企商业化放量的前提条件。但是,以目前医保目录中的3159种药品,对于中国上市药品整体而言,占比明显不高。也就是非医保药品仍是药品主流(数量上),那么更大群体“非医保”产品生存情况如何?“非医保”产品真的如想象中那么没前途吗?
01
非医保销售TOP榜
诚然,医保对于整体社会而言,无论是在加强患者医药可及性、促进医药行业整合与发展,还是推动医药行业研发创新都有举足轻重的作用。而对于企业而言,历年医保谈判成功的药品中,销量暴涨的案例也比比皆是。
但正如前言所讲,医保并非唯一,也不可能成为唯一,事实上,在医药行业中仍有大量“非医保”产品活得很滋润。
药智数据显示,虽然从2016年至2023年非医保销量TOP榜持续变化,如前列地尔注射液等曾今畅销的非医保产品也逐渐退出榜单,但同时如盐酸多柔比星、帕博利珠单抗、盐酸罗沙替丁醋酸酯、聚乙二醇重组人生长激素等产品却也接替上榜、2023年销售额均在10亿元以上。
数据来源:药智数据
盐酸多柔比星脂质体注射液
据悉,2023年公立医院销售额超10亿的非医保品种共有12个,其中2023年盐酸多柔比星脂质体注射液成功超越地佐辛注射液,成为当年“非医保”公立医院销售榜榜首,期间销售额达39.19亿元,并且以目前趋势来看,2024年起销售额预计还将再创新高,突破40亿元。
数据来源:药智数据
地佐辛注射剂
数据显示,2023年非医保公立医院销售额第二的是地佐辛注射剂,由于2020年以来地方医保清退政策的影响,其销量正在呈现下滑趋势,2023年公立医院销售额为39.15亿元,2024上半年销量18.41亿元。
数据来源:药智数据
注射用哌拉西林钠他唑巴坦钠
作为临床上应用最广泛的抗生素,自2005年开始注射用哌拉西林钠他唑巴坦钠就已成为全球注射用抗生素处方量第1名,且多年以来收获众多指南推荐。
虽说2023年中标第八批集采,对药品单价有所影响,以至于2023年公立医院市场销售额有所下降,但整体市场份额依旧,只是相较而言的竞争格局更加严峻。
目前,注射用哌拉西林钠他唑巴坦钠已有瑞阳制药、湖南科伦制药、苏州二叶制药、山东鲁抗医药等15家药企过评,而在仿制药布局方面,成都倍特药业、江苏海宏制药、江苏睿实生物科技等8家药企提交了仿制申请,均在审评审批中。
数据来源:药智数据
帕博利珠单抗注射液
作为创新药里未纳入医保的典型案例,其虽布局医保优势,却由于其先发优势、广泛获批的适应症和默沙东超强的销售能力使其在市场上仍取得了不错的成绩。
其2023年公立医院销售额达17.02亿元,预计2024年业绩将再创新高,超过20亿元,作为默沙东公司的拳头产品,2023年刚刚以250.11亿美元(约合人民币1796亿元)年销售额,登顶全球「药王」。
更关键的是,帕博利珠单抗同时还是非医保新药领域中妥妥的王者,成功证明了“医保并非创新药唯一的出路”这句话。
数据来源:药智数据
蒲地蓝消炎口服液
药智数据显示,作为济川药业清热解毒类的独家产品,在未纳入医保的情况下,2023年公立医院销售额达13.43亿元,截止目前,蒲地蓝消炎口服液连续8年销售额破十亿元大关,公立医疗机构累计销售额已突破百亿,达136.7亿元。
数据来源:药智数据
但自2018年以来,由于说明书修改、退出省级医保目录等方面因素影响,蒲地蓝消炎口服液在公立医院方面的销售额逐年下降,
但与此同时,蒲地蓝退出医保后,选择发力零售端,2023年蒲地蓝零售端销售额已达17.3亿元,甚至超过了样本医院端销售额,并且,2024年11月12日,蒲地蓝消炎口服液正式由处方药转为OTC类药物,这或许不利于公立医院板块的销售增长,但同时也将成为蒲地蓝消炎口服液攻占零售市场的重大转折。
当然,上述案例只是非医保产品销售现状的缩影,过程中有在非医保情况下销售额仍能大幅增长的情况,也有在非医保情况下艰难求生的情况,但无论如何,对于非医保产品而言,情况似乎并非我们想象中那么艰难,关键还是要看企业背后的商业化逻辑。
02
不进医保背后的销售逻辑
对于企业而言,其实进医保与否,其商业化成功都需找准自身定位才行。
对于创新药领域而言,在过去多年的医保增减历程中,如再鼎医药的尼拉帕利、艾力斯医药的伏美替尼、诺诚健华的奥布替尼等生物技术公司首个商业化产品,在进入医保后确实表现不俗。而2024年迪哲医药的舒沃替尼也由非医保转向医保序列,由此证明医保对品种上量有着确切的促进作用。
但同时,目录外的创新药,也不乏丰收者。比如康方生物的派安普利单抗、卡度尼利单抗及思路康瑞药业的恩沃利单抗,年销售额均超5亿元人民币,这些产品上市时间都在2021年之后。尽管目前实现这一目标的产品还不多,但可见国内医药市场对非医保创新药的支撑潜力。
另外,如今越来越多企业对待“进医保”这个话题的态度也在发生着变化,以价换量不再是单一的考量因素,更多的则是对在研管线的发展、销售团队的覆盖能力等进行综合性评估。
以PD-1为例,在目前尤为内卷的竞争格局之下,紧随“四小龙”强行进入医保之后,也无非是换个地方再卷,因此康方生物、誉衡生物、基石药业的产品具备资格但未参与谈判。
而事实也证明,医保之外的市场同样有不少值得挖掘的地方,而就算进入医保,对于很多初创biotech企业而言,仍跨不过医院这关。
03
总结
从现有数据上来看,无论是对于仿制药还是创新药而言,“进医保”永远不是必选项,非医保市场上同样不乏优秀的品种能实现年销售额破10亿元。
而且,对于企业而言,进医保与否也并非单一用“以价换量”就能搞清楚的,更多还是应根据自身企业的综合能力进行评估,找准市场真正的突破口。
声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。
责任编辑 | 青霉素
转载开白 | 马老师 18996384680(同微信)
商务合作 | 王存星 19922864877(同微信)
阅读原文,是受欢迎的文章哦
带量采购核酸药物医药出海
2023-06-26
·药研网
6月26日,信达生物宣布与荣昌生物达成一项临床研究和供药合作协议,将就PD-1抑制剂信迪利单抗注射液与靶向间皮素(MSLN)的 ADC(RC88) 、靶向细胞间质上皮转换因子(c-MET)的ADC(RC108)分别开展联合用药临床研究合作。至此,国内“pd1四小龙”已经全部对PD1联用ADC的疗法展开了布局。除了恒瑞是“组内联用”,其余三家均为“组间联用”,且合作对象都是荣昌生物。信达/荣昌:PD1+MSLN/cMET ADC根据本次的合作协议,信达生物将提供试验使用的信迪利单抗注射液,荣昌生物将在中国开展临床I/IIa期研究,评估信迪利单抗注射液联合RC88或RC108在中国肿瘤患者中的安全性、耐受性和初步疗效。RC88是荣昌生物自研的MSLN ADC,2018年在国内开展Ⅰ期临床试验,初步结果显示RC88单药对MSLN表达的实体瘤具有抗肿瘤活性,安全性可控。临床前研究结果显示RC88与肿瘤细胞表面MSLN结合后,内吞进入细胞内,经蛋白酶切割释放小分子后发挥杀伤作用,使肿瘤细胞阻滞于G2/M期,从而诱导肿瘤细胞凋亡。RC88与ICIs类药物联用能诱导免疫原性细胞死亡(ICD)的发生,释放一系列信号分子进一步激活T细胞,增强肿瘤免疫反应,协同产生更强的抗肿瘤作用。RC108是荣昌生物自研的c-MET ADC,2020年11月在国内开展针对c-Met阳性晚期实体瘤的Ⅰ期临床试验,初步结果显示RC108单药对c-MET表达的实体瘤具有抗肿瘤活性,安全性可控。临床前研究结果显示RC108诱导肿瘤特异性适应性免疫,增加T细胞对肿瘤微环境的浸润,而PD-1单抗则活化T细胞,增强抗肿瘤免疫反应。因此,预期RC108与信迪利单抗联用既能增强树突状细胞对肿瘤抗原的递呈,也能强化T细胞对肿瘤细胞的杀伤,从而产生增强的协同抑瘤效果。君实/荣昌:PD1+HER2/MSLN ADC特瑞普利单抗最先合作的是荣昌的HER2 ADC,进展相对较快,也有相关数据。今年的ASCO年会上公布了RC48联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌(la/mUC)的最新Ib/II期数据。数据如下:此外,荣昌生物今年4月刚登记了一项RC88与特瑞普利单抗联用治疗晚期实体瘤的临床,此为与荣昌生物达成的另一款ADC合作。百济/荣昌:PD1+HER2 ADC替雷利珠单抗的首选ADC也是靶向HER2的RC48,适应症涉及MIBC、NMIBC、上尿路尿路上皮癌和晚期胃癌。去年ESMO年会公布了联合治疗MIBC的初步结果:今年ASCO年会还公布了一项RC48联合替雷利珠单抗治疗高危非肌层浸润性膀胱癌(NMIBC)的结果。恒瑞医药恒瑞在今年1月注册了一项HER2 ADC(SHR-A1811)联合PD-L1/TGF-β融合蛋白(SHR1701)和/或化疗治疗GC/GEJ的研究。今年3月,又注册了一项卡瑞丽珠单抗相关的临床研究,治疗三阴性乳腺癌,其中涉及SHR-A1811和卡瑞丽珠单抗的联用组合。小结除此之外,从clinicaltrials.gov官网公布的情况来看,国内一些PD-(L)1玩家也已展开布局,如科伦博泰、誉衡生物、康方生物和思路康瑞药业。今年4月3日,FDA加速批准K药联用Nectin ADC(Padcev)一线治疗尿路上皮癌,证明了PD1+ADC组合的可行性,一时之间,PD1+ADC的联用组合在业界备受关注。国外O药与K药目前已与多个ADC展开了临床联用研究,而国内众多企业也在fast follow,但具体效果如何,还需等待更多数据的公布。细胞系产品查询投稿丨商务合作加入交流群参考:信达生物官方新闻往期推荐双抗ADC全球在研格局美股市值最高的基因编辑公司:CRISPR Therapeutics2023 H1 国产创新药license-out盘点点击下方“药研网”,关注更多精彩内容
抗体药物偶联物临床1期ASCO会议临床结果
100 项与 四川思路康瑞药业有限公司 相关的药物交易
登录后查看更多信息
100 项与 四川思路康瑞药业有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年11月12日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
批准上市
1
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
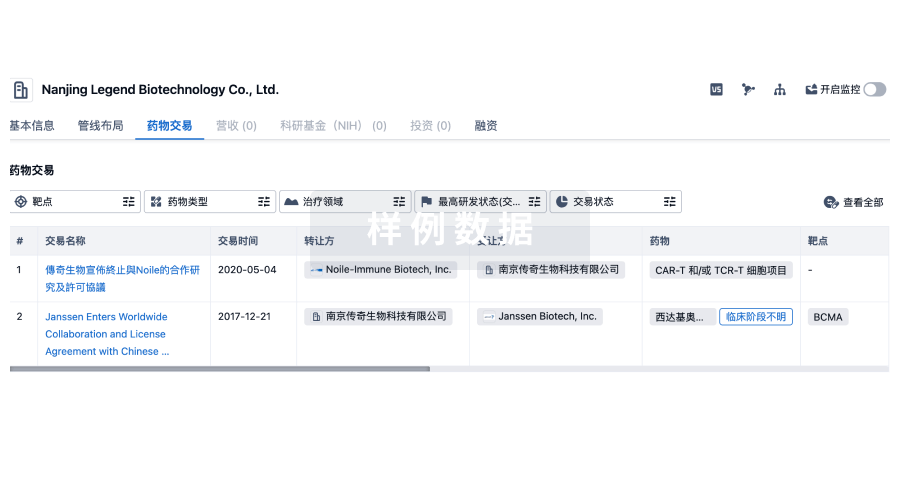
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
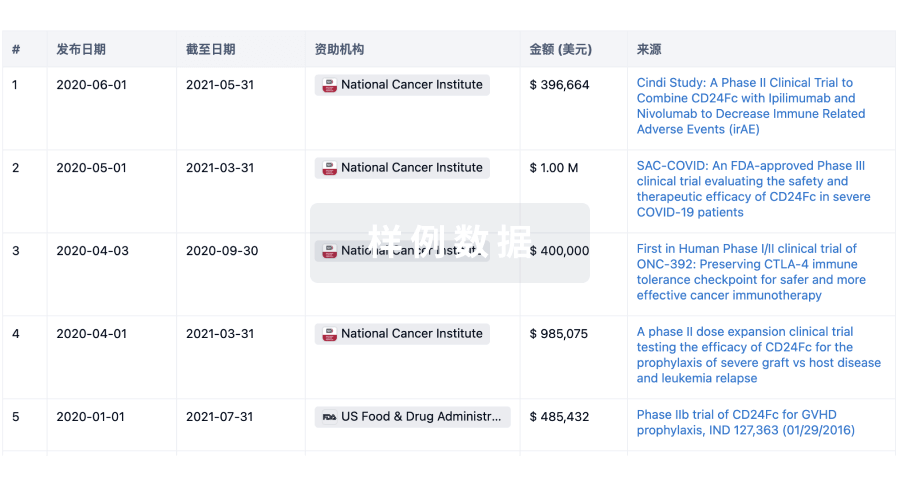
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
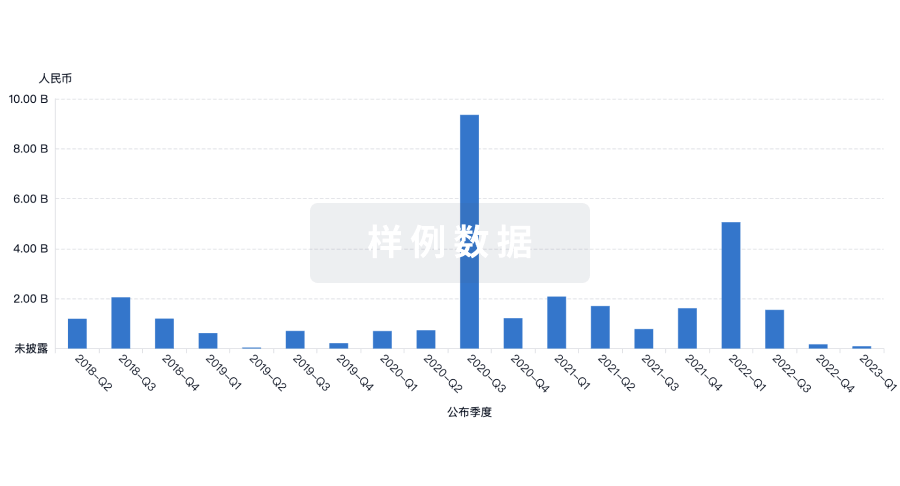
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
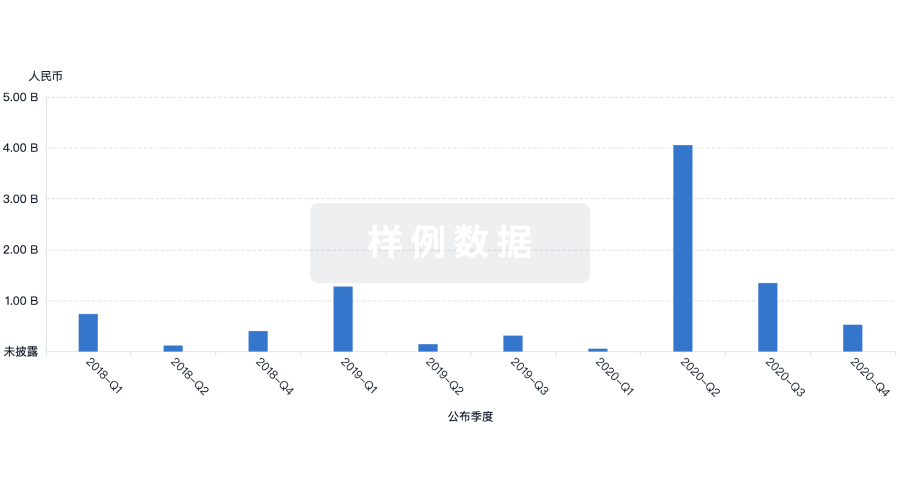
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用