预约演示
更新于:2025-05-07

Molecular Axiom
更新于:2025-05-07
概览
标签
肿瘤
呼吸系统疾病
神经系统疾病
ASO
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| ASO | 6 |
关联
6
项与 上海微哲默理生物科技有限公司 相关的药物作用机制 KRAS G12A抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期- |
作用机制 KRAS G12V抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期- |
作用机制 KRAS G12C抑制剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期- |
100 项与 上海微哲默理生物科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 上海微哲默理生物科技有限公司 相关的专利(医药)
登录后查看更多信息
1
项与 上海微哲默理生物科技有限公司 相关的新闻(医药)2024-01-16
1月7日,舶望制药宣布,已与诺华就RNAi疗法达成两项交易潜在总价值高达41.65亿美元的独家许可合作协议。1月3日,瑞博生物及瑞博国际研发中心宣布与勃林格殷格翰达成合作协议,宣布将共同开发治疗非酒精性或代谢功能障碍相关脂肪性肝炎(NASH/MASH)的小核酸创新疗法,潜在总交易金额超过20亿美元。2024年刚开年,国产小核酸药物就迎来两起重磅出海交易,借此机会,我们梳理了国内30家小核酸企业。 01 小核酸药物市场规模小核酸药物(寡核酸药物,oligonucleotide)指长度小于30nt的寡核苷酸序列,可通过与靶分子的RNA结合,通过调控翻译,从而达到治疗疾病的效果。根据小核酸结构、药物机制、作用靶点的不同,小核酸药物类型主要分为5种,包括反义寡核苷酸(ASO)、小干扰RNA(siRNA)、微小RNA(microRNA或miRNA)、适配体(Aptamer)和CpG寡核苷酸(CpG oligonucleotides)。ASO和siRNA是目前研究最多的小核酸药物类型。从市场规模来看,据沙利文统计,小核酸药物全球市场规模从2016年0.1 亿美元已增长至2021年32.5亿美元,年复合增长率高达217.8%,预计2025年全球小核酸药物销售额将突破100亿美元。相比之下,我国小核酸药物市场起步较晚,仍处于发展的早期阶段,尚无国产小核酸药物获批上市,但国内患者人群基数大,未满足的临床需求较多,因此,随着国内核酸药物技术的不断开发和企业的不断成熟,我国的小核酸药物行业也将迎来快速发展期。预计到2030年我国小核酸药物市场也将达到100亿元[1]。 02 国内小核酸初创公司风起云涌正是看中这一巨大的市场前景,国内成立了很多小核酸药物公司,主要分布在长三角和珠三角地区,据全网统计梳理,我们整理出30家在研小核酸企业,如有疏漏,敬请补充。图1. 国内小核酸企业的概况瑞博生物和圣诺医药是最早成立的一批小核酸企业,都成立于2007年,分别分布在苏州和广州。圣诺医药已于2021年12月30日在港交所上市,成为国内RNA疗法第一股。早期小核酸药物因为易被核酸酶降解、肾清除率高,脱靶效应明显等缺点而导致开发难,直至LNP、GalNac递送系统和化学修饰等技术出现,小核酸药物领域再次迎来蓬勃发展,全球获批上市的小核酸药物中80%都是在2016年后获批上市。正是随着这些技术的突破和新型小核酸药物的上市给了投资者很大的信心,这才迎来国内小核酸初创公司成立的井喷期,2021年国内小核酸公司成立达到10家,包括艾码生物、赫吉亚、思合基因、舶望制药、圣因生物、星曜坤泽、微哲默理、欧利生物、科镁联和大睿生物。由于RNA干扰(RNAi)药物的作用时间更持久,安全性也更高。国内小核酸企业更倾向于布局RNA干扰药物而不是ASO药物,如维亚臻生物、瑞博生物、圣诺医药、腾盛博药、舶望制药和圣因生物等。 03 国产在研代表性小核酸药物据不完全统计,截止目前,全球已有17款小核酸药物获批上市(包括已退市的),大多数来源于Ionis、Alnylam和Sarepta三家公司,由于技术壁垒,国产小核酸药物起步较晚,尚无国产小核酸药物获批上市,但随着化学修饰和递送技术的突破,国产小核酸药物也处于蓬勃发展中(图2)。 图2. 部分在研国产小核酸药物代表性药物①VSA001(维亚臻生物)VSA001是由维亚臻生物研发的靶向载脂蛋白C-Ⅲ(APOC3)mRNA的siRNA药物,主要用于治疗家族性乳糜微粒血症综合征(FCS)和严重的高甘油三酯血症(HTG)。FCS是一种罕见的遗传性疾病,由脂蛋白脂肪酶(LPL)功能受损引起,而APOC3能够抑制LPL,调节血浆血清甘油三酯(TG)水平,是TG的关键调节因子,主要在肝脏中合成。因此通过siRNA药物降低APOC3蛋白表达,增强LPL功能,可治疗FCS疾病。此外,患有FCS的患者可能出现严重的高甘油三酯血症(HTG)和TG诱发的胰腺炎风险升高。所以维亚臻生物也在临床上开展全球多中心VSA001治疗严重高甘油三酯血症试验,围绕血脂异常主要布局两项适应症:分别是sHTG(重度高甘油三酯血症)和ASCVD CVOT(混合性血脂异常)。VSA001在中国成人FCS患者中开展的3期临床试验已于2023年7月份完成首例患者给药,目前该试验正在顺利进行中。随后2023年9月18日,VSA001被CDE纳入突破性治疗药物品种名单,其研发和审评速度会进一步加快,有望成为首个针对FCS的有效获批药物。维亚臻生物是一家成立于2022年的的小核酸药物疗法公司,并与国际领先的小核酸药物企业Arrowhead Pharmaceuticals建立战略合作关系。除了VSA001,维亚臻生物还有治疗纯合子型家族性高胆固醇血症的VSA003和治疗非酒精性脂肪肝炎的VSA006,其中VSA006 于2023年9月份获 CDE 临床试验默示许可(图3)。图3. 维亚臻生物的研发管线(官网)②RBD1007(瑞博生物)RBD1007是由瑞博生物研发的一种靶向Caspases 2视神经保护的siRNA药物,通过RNAi抑制靶基因的表达,阻止视网膜神经节细胞(RGC)凋亡和继发的神经轴突退化,从而防止视力和视野进一步恶化,达到保护视力的治疗效果。瑞博生物成立于2007年,是一家专注于小核酸创新技术和小核酸药物研究开发的公司。瑞博拥有自主研发的高效长效小核酸药物递送技术RIBO-GalSTAR®肝靶向递送技术,通过自主创新和国际合作打造了丰富的小核酸药物研发品种管线,涉及的疾病领域包括感染性疾病,代谢类疾病,血液系统疾病,罕见病和眼科疾病等(图4)。RBD1007是其研发管线中进展最快的,目前已处于临床三期阶段。 图4. 瑞博生物产品管线(官网)RBD1007首个开发的临床适应症为尚无临床标准治疗的非动脉炎性前部缺血性视神经病变(NAION),RBD1007有望成为 First-In-Class的视神经保护药物[2]。目前全球已经完成1个临床I期研究和1个Ⅱ/Ⅲ期国际多中心临床研究(其中包括34例中国受试者),临床试验数据分析结果支持针对具有极大未满足临床需求的NAION亚组患者人群开展III期确证性临床研究。③RBD1016(瑞博生物)RBD1016注射液是由瑞博生物采用N-乙酰氨基半乳糖(GalNAc)递送技术开发的靶向乙型肝炎病毒(HBV)siRNA药物,用于治疗慢性乙型肝炎。2023年EASL会议上瑞博生物公布RBD1016最新研究数据:0.3 mg/kg单剂量组第12周血清HBsAg平均下降幅度最大为0.48 log10 IU/mL,1 mg/kg单剂量组第12周平均下降0.75 log10 IU/mL,3 mg/kg单剂量组第16周平均下降 0.97 log10 IU/mL,3 mg/kg多剂量组第12周平均下降1.26 log10 IU/mL,安慰剂组为 0.00 log10 IU/mL(图5)。HBsAg 的这些下降在第 24 周保持稳定。所有服用1或 3 mg/kg RBD1016的参与者的 HBsAg 至少下降了半个对数[3]。 图5. HBsAg的水平变化HBV RNA的平均下降在3 mg/kg单剂量组和多剂量组中最大。在第6周和第12周,多剂量组接受3 mg/kg 治疗的患者的HBV RNA平均下降幅度最高,为 1.28 log10 copies/mL。乙型肝炎核心相关抗原(HBcrAg)的平均降幅最大,因为它反映了共价闭合的环状DNA(cccDNA)[3],出现在3mg/kg多剂量组(第12周时为0.62 log10 IU/mL)(图6)。图6. HBV RNA和HBcrAg水平变化④RBD4988(瑞博生物)RBD4988由Ionis开发靶向作用于于胰高血糖素受体(GCGR)mRNA 的ASO药物,通过双重作用机制发挥降糖作用,即在降低肝葡萄糖生成量的同时,又可升高GLP-1产生胰腺保护功能。瑞博生物于2017年获得大中华区开发和商业化权益,2022年2月份,瑞博生物宣布RBD4988注射液的两项II期临床试验按计划顺利完成。研究结果显示:RBD4988治疗组较安慰剂组可显著降低HbA1c水平,达到主要研究终点,且不增加低血糖事件和严重低血糖事件发生率。特别是在二甲双胍作为背景用药的基础上,该药品显示了更强的具有临床意义的降HbA1c能力。PK 特征与该药物前期临床试验相似,除在某些受试者上观察到可逆轻度肝酶升高现象外,药物安全性和耐受性良好[4]。⑤BW-20507(舶望制药)BW-20507是舶望制药自主研发的一种靶向HBV的siRNA药物,目前正在中国香港、澳大利亚和泰国进行I/II期临床,以评估在健康受试者及慢乙肝患者中的安全性、耐受性、药代特征及疗效。舶望制药成立于2021年4月,专注于siRNA药物的开发,如开头所述,舶望制药成立不足三年就受到诺华的青睐,抛下了总交易额高达40多亿美元的橄榄枝。舶望制药开发了行业领先的具有卓越活性、持续时间和安全性的RNAi分子RNAi平台技术RADS,在核酸序列设计、化学修饰、GalNAc递送技术、肝脏外递送技术、寡聚核酸合成、CMC等RNAi药物开发的全流程环节拥有多年专业经验,公司成立后完成多轮融资,累计金额高达7.3亿人民币。凭借超强的技术和专业的团队,舶望制药已经围绕心血管疾病、罕见病、病毒感染、代谢疾病和中枢神经系统疾病建立了20多条管线,公司已推进多个项目进入临床,如用于治疗心血管疾病的BW-01、BW-02、BW-05,用于治疗罕见病靶向PKK以及治疗乙型肝炎的小核酸药物(图7)。图7. 舶望制药研发管线(官网)⑥BRII-835(腾盛博药)乙型肝炎仍然是全世界死亡和发病的主要原因。全民儿童期免疫接种计划非常成功,但许多成年人仍然没有得到保护或没有得到最佳保护。BRII-835是Vir Biotechnology与Alnylam Pharmaceuticals合作开发的皮下注射靶向HBV的siRNA药物,有望刺激有效免疫应答,具有直接抗HBV病毒的活性。腾盛博药于2020年从Vir获得了BRII-835的大中华地区开发和商业化权益,目前处于临床II期开发阶段。2023年2月份,腾盛博药宣布了一项2期研究的中期结果,研究发现,BRII-835与BRII-179(基于重组蛋白质的新型HBV免疫治疗候选药物)联合疗法安全且耐受性良好,与单独使用BRII-835或BRII-179相比,联合疗法诱导了更强的抗HBsAg抗体应答,并改善了HBsAg特异性T细胞应答(图8)[5]。 图8. BRII-835与BRII-179联合治疗效果更好除此之外,腾盛博药还有很多研发管线,包括治疗乙型肝炎的BRII-179、BRII-837以及用于产后抑郁症的BRII-296等(图9)。 图9. 腾盛博药的研发管线(官网)⑦STP705(圣诺医药)STP705是由圣诺医药研发的一种siRNA(小干扰核酸)疗法,是由两个siRNA寡核苷酸组成的TGF-β1/COX-2双靶点抑制剂。圣诺医药开发了两种给药形式,包括瘤内给药(PNP-IT)和皮内给药(PNP-ID)两种形式,瘤内给药形式用来治疗鳞状细胞原位癌、面部鳞状细胞原位癌、基底细胞癌、肝癌(篮式)包括胆管癌、肝细胞癌、肝转移癌等,皮内给药形式用于治疗疤痕疙瘩无疤愈合、增生性瘢痕(HTS)和脂肪塑形等。2022年8月份,圣诺医药宣布STP705在治疗皮肤基底细胞癌(BCC )的Ⅱ期临床试验中,接受180μg剂量给药的队列实现100%完全清除(CR),表明该疗法具有良好的可行性。2022年12月份,圣诺医药公布正在进行的STP705用于治疗原位鳞状细胞皮肤癌(isSCC)的Ⅱb期第一阶段的中期临床数据。该中期数据结果显示,在32名使用STP705疗法的患者中,大多数(78%)到达了主要终点(肿瘤细胞完全组织学清除)。三组队列中,最优效果组实现了89%到达主要终点[6]。2023年6月5日,圣诺医药公布STP705用于成人腹部减脂医学美容治疗的I期临床试验中期数据。此项I期临床试验初步数据显示,STP705减少多余脂肪具有安全性且疗效显著[7]。图10. 圣诺医药产品管线(官网)⑧RBD7022(瑞博生物)RBD7022(SR043)是由瑞博生物基于具有自主知识产权的RIBO-GalSTARTM平台研发的靶向PCSK9的siRNA药物,也是国内首款进入临床的PCSK9 siRNA药物,于2022年9月19日被NMPA批准在中国开展首次人体临床试验,用于治疗高血脂症。PCSK9可与细胞表面的低密度脂蛋白受体(LDLR)结合将其转运至溶酶体,降解LDLR,从而使血浆中的 LDL-C水平因受体缺乏无法降解,导致血浆LDL-C水平升高,抑制PCSK9的功能可以降低血浆LDL-C水平,因此PCSK9成为新一代降脂明星靶点。截止目前,全球共有4款获批上市的抗PCSK9药物,其中诺华的Leqvio是唯一一款获批的siRNA疗法。相对于PCSK9单抗,Leqvio减少了给药频率,将给药间隔延长至半年,优于现有的单抗药物,Leqvio自2021年12月被FDA批准以来销售额急剧上升,2023年前九个月Leqvio销量额已达到2.32亿美元,放量增长(图11)[8],由此可见siRNA药物治疗高血脂症也有很大的市场。图11. Leqvio的销售额(官网)2023年12月15日,瑞博生物宣布与齐鲁制药签订总额超过7亿元人民币的技术许可协议,将RBD7022在大中华区(中国大陆、香港及澳门)的开发、生产和商业化权利授权许可给齐鲁制药。RBD7022目前处于I期临床阶段,旨在评价皮下注射RBD7022在低密度脂蛋白胆固醇正常或升高的受试者中的安全性、耐受性、药代动力学和初步药效学特征,目前正在招募中。⑨HC0201和HC0301(海昶生物)HC0201是由海昶生物研发的靶向AKT-1的不含递送系统的ASO药物,用于治疗原发性肾癌(RCC)。AKT-1属于AKT丝氨酸/苏氨酸激酶家族,AKT-1的异常与癌细胞的生长和增殖以及抗癌剂发生抗药性相关,而 HC0201 对抑制 AKT-1 表达具有高度的选择性。HC0201原来的给药方式需连续滴注14天,经给药系统改良后一周只需注射一次。另外,随着RCC治疗方案的不断改进,海昶生物已着手开发HC0201最优药物组合治疗方案,以提高疗效。此外,海昶生物利用QTsome™平台对HC0201针对肝癌进行了纳米脂质体优化,形成了抗原发性肝癌药物HC0301,两者为同一核酸API Mychexin。 2023年10月份,HC0301获得了FDA孤儿药资格认定(ODD),用于晚期肝细胞癌适应症,HC0301目前正在美国进行Ⅰ期晚期实体瘤的剂量爬坡临床研究(NCT05267899),已经接近尾声,并且显示出非常好的安全性和疗效。 图12. 海昶生物产品管线(官网)小核酸药物的市场规模前景可观,国内的企业虽处于起步阶段,随着技术的突破,未来必将迎来更多国产小核酸药物。参考文献1.小核酸药物行业图谱(科创金融研究中心)2. RBD1016, an siRNA, Lowers HBsAg for 24 Weeks in Phase 1 Placebo Trial3. 瑞博生物顺利完成针对2型糖尿病的反义核酸药物的两项II期临床试验4.Preliminary Safety and Efficacy of the Combination Therapy of BRII-835(VIR-2218) and BRII-179(VBI-2601) Treating Chronic HBV Infection5. Sirnaomics 宣布STP705用于治疗成人原位鳞状细胞皮肤癌的Ⅱb期临床试验获得积极中期数据6. Sirnaomics公布STP705用于成人腹部减脂医学美容治疗的 I期临床试验中期数据 | 圣诺医药 7.Q3 2023 Results Investor presentation-Novartis识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品微信群!请注明:姓名+研究方向!版权声明本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
上市批准核酸药物siRNA寡核苷酸
100 项与 上海微哲默理生物科技有限公司 相关的药物交易
登录后查看更多信息
100 项与 上海微哲默理生物科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年08月04日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
临床前
6
登录后查看更多信息
当前项目
登录后查看更多信息
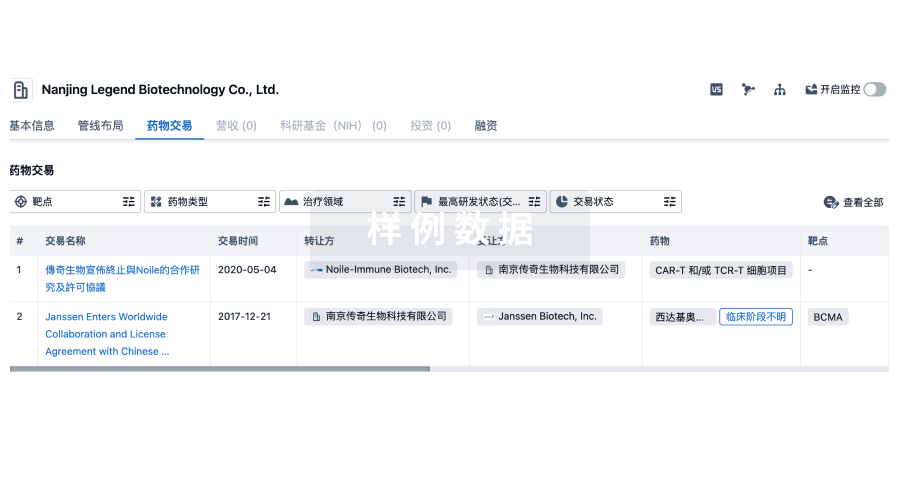
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
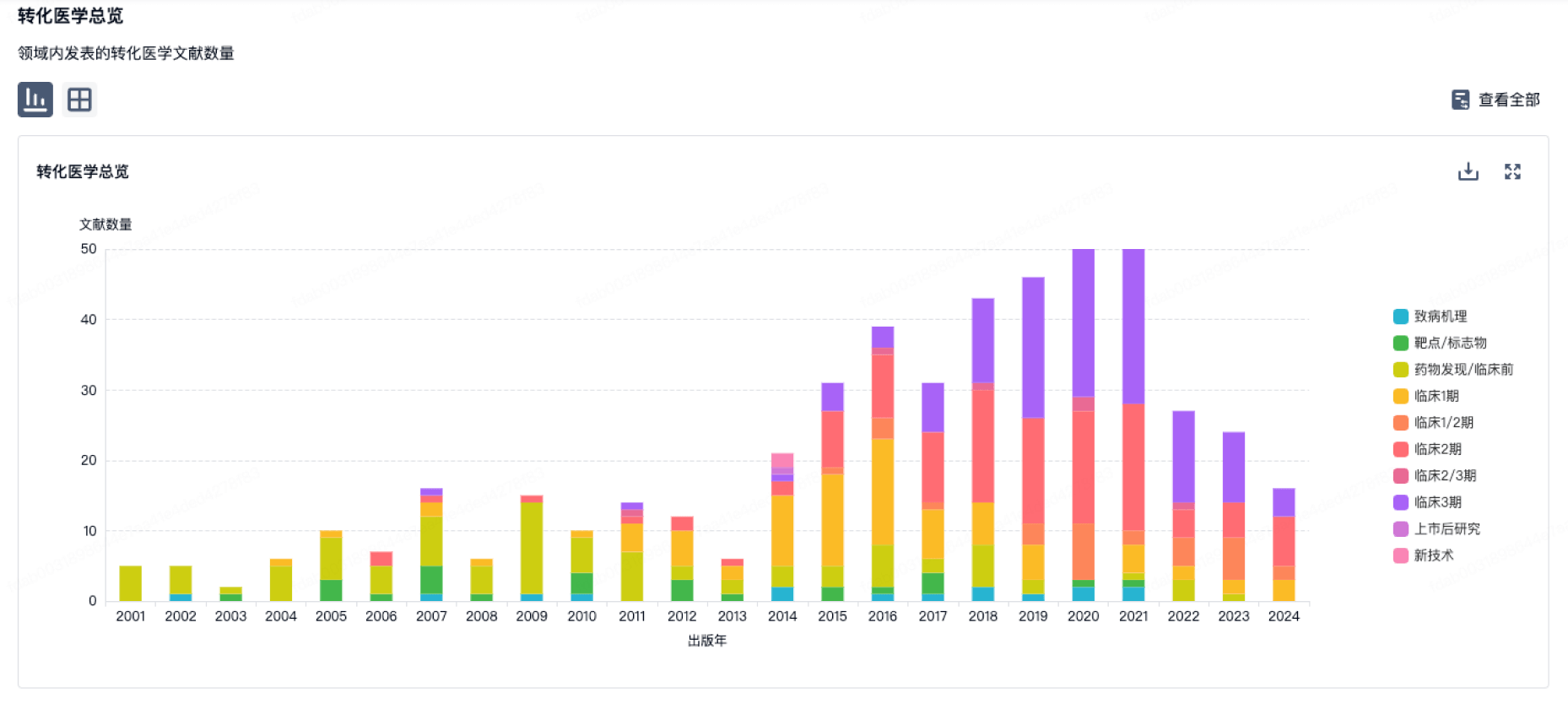
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
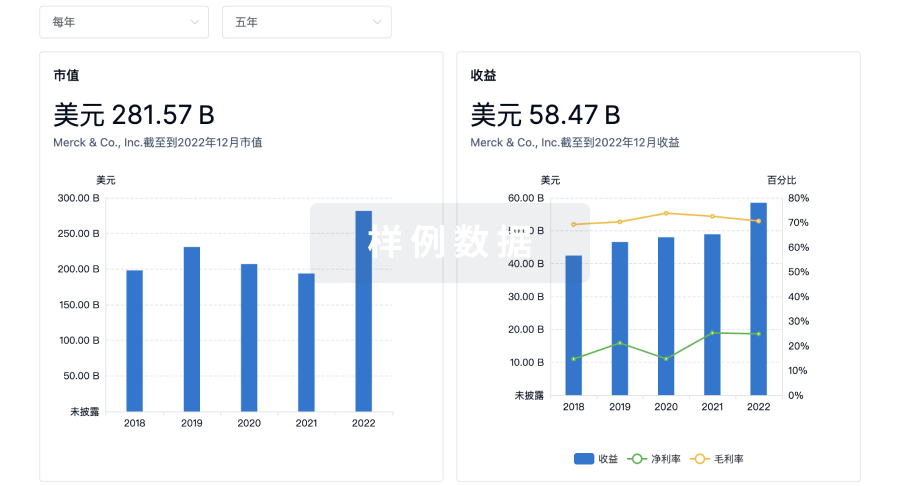
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
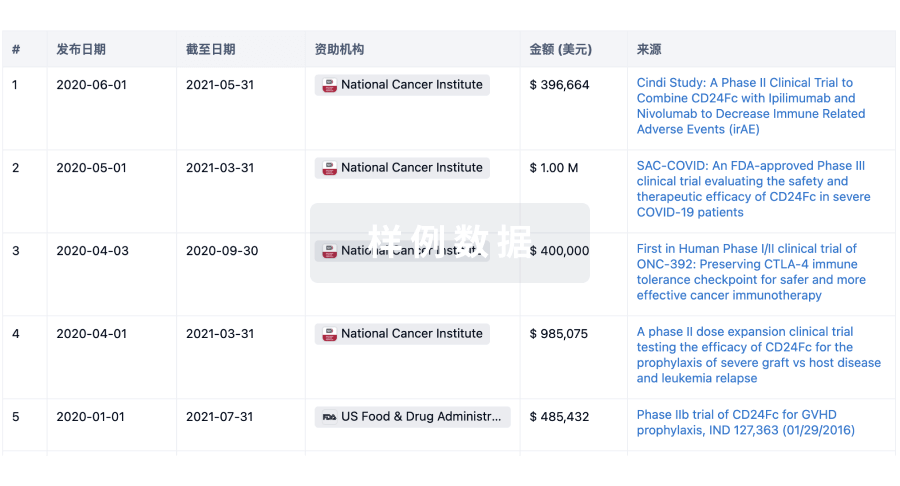
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用