“first-in-class”DMD新药获FDA批准!
2023-10-27
孤儿药基因疗法
今日,由Santhera Pharmaceuticals与ReveraGen BioPharma公司联合开发、用于治疗杜氏肌营养不良症(DMD)的创新疗法Agamree(vamorolone)获得美国FDA批准上市,用于治疗2岁及以上的DMD患者。

Preview
来源: 药明康德
DMD是最常见的儿童神经肌肉疾病之一。它是由于在X染色体上编码抗肌萎缩蛋白(dystrophin)的基因出现突变而导致的X连锁遗传病。抗肌萎缩蛋白的缺失最终导致肌纤维退化,组织纤维化和早夭。接近50%的患者每天使用糖皮质激素。这些激素虽然可以延缓疾病进展,但具有很多副作用。
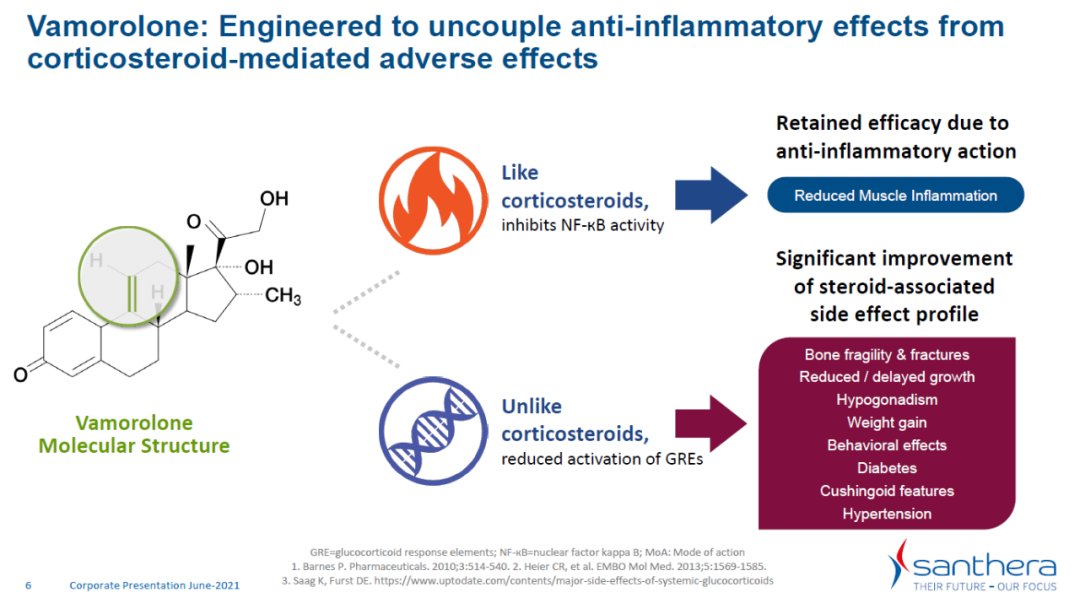
Vamorolone是最初由ReveraGen Biopharma公司研发的类固醇药物。它与普通类固醇药物的区别在于,能够有选择性地激活类固醇的某些信号通路。在DMD患者中,类固醇药物的抗炎症效果是介导药物疗效的主要机制,但是类固醇的其它活性会带来影响患者生活质量的副作用。Vamorolone能够在保持类固醇对DMD疗效的同时减少副作用的产生。Vamorolone获得美国与欧洲用以治疗DMD的孤儿药资格,并获得美国FDA快速通道资格与罕见儿科疾病认定。Santhera已将vamorolone在北美与中国的权益分别授权给Catalyst Pharmaceuticals与曙方医药(Sperogenix Therapeutics)。

Preview
来源: 药明康德
这次申请递交主要基于来自VISION-DMD关键临床2b期试验的积极结果,该试验检视与安慰剂和强的松(prednisone,0.75 mg/kg/day)相比,vamorolone(2-6 mg/kg/day)治疗DMD患者的疗效与安全性。
分析显示,试验达到主要终点,试验组患者在治疗24周后由卧位至站立所需时间(TTSTAND,DMD儿童患者疾病恶化的一项功能性指标)优于安慰剂组,且差异有统计学意义(p=0.002)。
Preview
来源: 药明康德
此外,与皮质类固醇不同,在临床研究中,48周后,通过骨生物标志物测量,vamorolone未导致患者的骨代谢降低,通过双能X线吸收测量法(DXA)测量时,也未发现该药物导致脊柱骨矿化显著减少。
参考资料:[1] Catalyst Pharmaceuticals Reports FDA Approval of AGAMREE® (vamorolone) for Duchenne Muscular Dystrophy Granted to Santhera Pharmaceuticals. Retrieved October 26, 2023 from https://ir.catalystpharma.com/news-releases/news-release-details/catalyst-pharmaceuticals-reports-fda-approval-agamreer
内容来源于网络,如有侵权,请联系删除。
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。




