预约演示
首创:东阳光GLP-1-FGF21双特异性融合蛋白FGF21双特异性融合蛋白获批临床
2021-04-14
First in Class仿制药
广东东阳光药业有限公司的全资子公司,东莞市东阳光生物药研发有限公司自主研发的,内部产品研发代号为HEC88473的GLP-1/FGF21双特异性融合蛋白FGF21双特异性融合蛋白于2021年4月7日获国家NMPA批准,成为全球首个获批进入人体临床试验的First-in-class候选药物。
HEC88473的1期临床试验将在中国与澳洲同步开展,两地同步的临床1期试验数据预计将于今年年底到明年年初完成。中美多中心临床2期试验有望在明年年中启动。

Preview
来源: 药融圈
Preview
来源: 药融圈
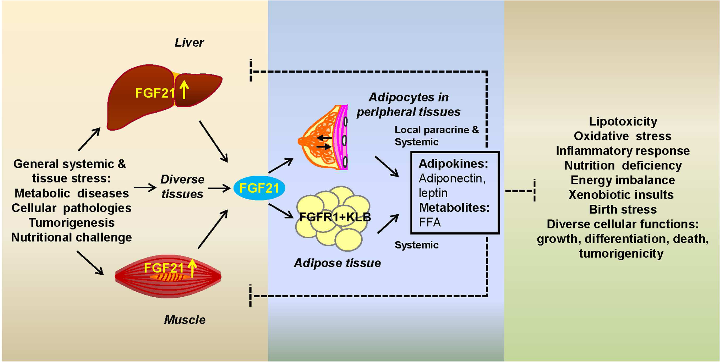
ByYongde Luo, Wallace L. McKeehan. Frontiers in Endocrinology
广东东阳光药业有限公司是国内领先的研发驱动性的生物医药企业公司以创新和国际化为核心竞争力,拥有强大的创新产品管线,22个在研临床一类新药项目,多个美国首仿药、改良型新药和生物类似物项目;1700多名研发人员,硕博比例接近50%;是科技部抗感染新药国家重点实验室,申请专利达1600多篇。东阳光研在欧美已经上市超过50个药品,建成了完善的欧美营销网络,在多个国家形成了销售额;是首家同时在美国、欧盟、世界卫生组织和中国上市药品的国内企业,具备全球化供应能力。
<END>
【关于药融圈】药融圈围绕我国生物医药产业链,针对生物医药大数据、技术和资本投资、药融园(产业园)等开展系列系统性工作,促进我国生物医药产业健康发展,完善产业链,共同面对全球合作和竞争。

Preview
来源: 药融圈

Preview
来源: 药融圈
点分享

Preview
来源: 药融圈
点点赞点在看
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。




