研究揭示剪接体进行分支位点选择、校正的分子机理
2024-03-20
基因疗法
西湖大学施一公团队在《自然结构与分子生物学》(Nature Structural and Molecular Biology)在线发表了题为“Structural Insights into Branch Site Proofreading by Human Spliceosome”的最新研究论文,报道了人源17S U2 snRNP复合物和剪接体pre-A复合物的高分辨率结构,并结合生化和功能实验,揭示了剪接体进行分支位点选择、校正的分子机理。

Preview
来源: 生物谷
mRNA剪接是真核生物基因表达的关键步骤,由剪接体催化完成。剪接体是一个巨大且高度动态的分子机器,其核心组成元件为5种核内小核糖核蛋白复合物(snRNP),分别为U1,U2,U4,U5和U6 snRNP。剪接体通过识别pre-mRNA上保守的剪接位点完成早期的组装。
首先,U1 snRNP识别5'剪接位点,剪接因子SF1识别分支位点(branch site, BS),形成E complex。随后,U2 snRNP替换SF1,识别分支位点,并且U2 snRNA与分支位点形成RNA双螺旋,完成A complex的组装1。在高等真核生物中,大部分基因都会发生可变剪接,这个过程需要剪接体选择不同的剪接位点。因此,研究这些早期复合物对于理解剪接反应的保真性和调控机制至关重要。近些年,随着冷冻电镜技术的突破,一系列人源和酵母的剪接体复合物结构获得解析,极大地促进了人们对mRNA剪接分子机制的认识2-5。但由于剪接反应早期的复合物具有高度的动态性和不稳定性,其结构研究进展缓慢。
Preview
来源: 生物谷
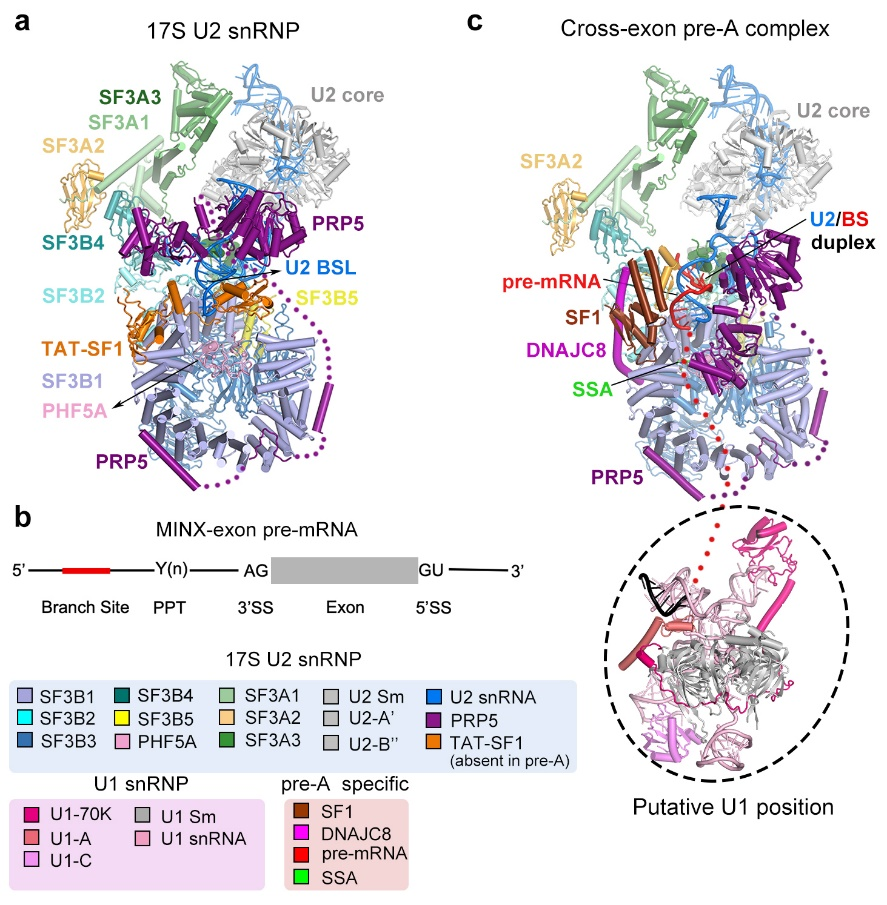
图1: 17S U2 snRNP和pre-A复合物的电镜结构
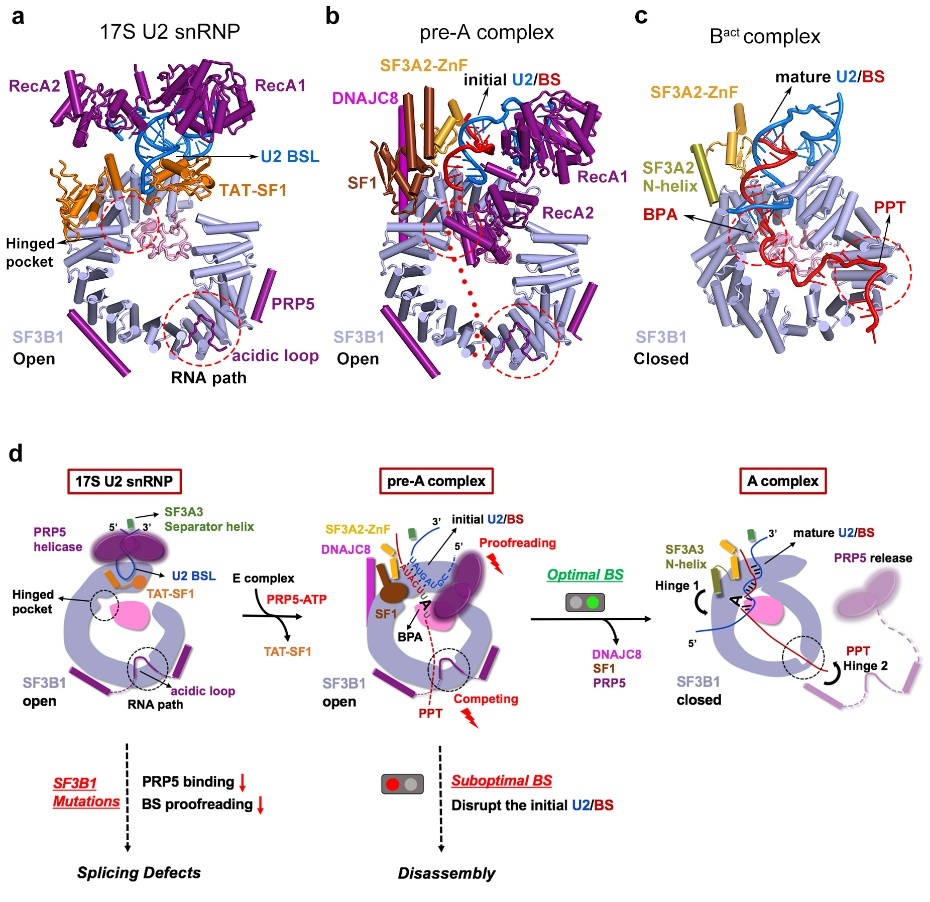
在17S U2 snRNP中PRP5主要通过其N端锚定在SF3B1外围,其中acidic loop占据了SF3B1的RNA通道,而它的解旋酶结构域则结合在U2 snRNA附近。剪接因子TAT-SF1通过其Linker domain将U2 snRNA的BS-interacting stem loop (BSL)包裹起来,从而避免BSL过早打开以及结合pre-mRNA。在pre-A复合物中,SF3B1仍然处于开放状态,PRP5的acidic loop依然结合在SF3B1的RNA通道中,但其解旋酶结构域发生了显著的构象变化。与之相应的,TAT-SF1从复合物中解离,并且U2 snRNA和pre-mRNA通过部分的互补配对,形成了一个初始的双链结构(initial U2/BS duplex)。剪接因子SF1和DNAJC8稳定了局部的构象。
Preview
来源: 生物谷
图2: 17S U2 snRNP到A complex过程中的结构变化以及PRP5校正U2/BS duplex的模型图
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
机构
适应症
药物
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



