预约演示
更新于:2025-05-07
Hereditary Leiomyomatosis and Renal Cell Cancer
遗传性平滑肌瘤病和肾细胞癌
更新于:2025-05-07
基本信息
别名 Cutaneous leiomyomata with uterine leiomyomata、FH Deficiency、Familial leiomyomatosis and renal cell cancer + [40] |
简介 An autosomal dominant inherited syndrome caused by germline mutations in the FH gene. It is characterized by predisposition to renal cell carcinoma, leiomyomas of the skin and uterus, and leiomyosarcoma of the uterus. |
关联
5
项与 遗传性平滑肌瘤病和肾细胞癌 相关的药物作用机制 PARP1抑制剂 [+1] |
在研机构 |
原研机构 |
在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2021-04-30 |
靶点 |
作用机制 VEGF-A抑制剂 [+1] |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2004-02-26 |
靶点 |
作用机制 PRKAB1激活剂 |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期1992-01-01 |
12
项与 遗传性平滑肌瘤病和肾细胞癌 相关的临床试验NCT05534854
Frequency, Clinical Phenotype and Genetic Analysis of Heritable Kidney Cancer Syndromes
This study will investigate the frequency, clinical phenotype, management and molecular genetic defects of heritable kidney cancer syndromes. Families with kidney cancer with known or suspected genetic basis will be enrolled. Affected individuals or individuals suspected of having a germline kidney cancer will undergo periodic clinical assessment and genetic analyses for the purpose of: 1) definition and characterization of phenotype, 2) determination of the natural history of the disorder, and 3) genotype/phenotype correlation. Genetic linkage studies may be performed in situations in which the genetic basis of the disorder has not been elucidated. This research will have a significant impact on the overall management of heritable kidney cancer syndromes patients and family members who are at risk for heritable kidney cancer syndromes. The study will ultimately facilitate the development of novel screening, prevention and treatment strategies for these individuals with the syndrome. In addition this study could have impact on the management of patients with personal and/or family history of heritable kidney cancer syndromes.
开始日期2022-10-01 |
申办/合作机构  上海仁玑医院管理有限公司 上海仁玑医院管理有限公司 [+9] |
NCT04981509
A Phase 2 Study of Bevacizumab, Erlotinib and Atezolizumab in Subjects With Advanced Hereditary Leiomyomatosis and Renal Cell Cancer (HLRCC) Associated or Sporadic Papillary Renal Cell Cancer
This phase II trial studies the effects of combination therapy with bevacizumab, erlotinib, and atezolizumab in treating patients with hereditary leiomyomatosis and kidney cancer that may have spread from where it first started to nearby tissue, lymph nodes, or distant parts of the body (advanced). Bevacizumab is in a class of medications called antiangiogenic agents. They work by stopping the formation of blood vessels that bring oxygen and nutrients to tumors. This may slow the growth and spread of tumors. Erlotinib is in a class of medications called kinase inhibitors. It works by blocking the action of a protein called EGFR that signals cancer cells to multiply. This helps slow or stop the spread of cancer cells. Immunotherapy with monoclonal antibodies, such as atezolizumab, may help the body's immune system attack the cancer, and may interfere with the ability of tumor cells to grow and spread. Combination therapy with bevacizumab, erlotinib, and atezolizumab may stabilize or shrink advanced hereditary leiomyomatosis and kidney cancer.
开始日期2022-06-10 |
申办/合作机构 |
NCT04603365
A Phase 2 Study of Pamiparib (BGB-290) Plus Temozolomide for Hereditary Leiomyomatosis and Renal Cell Cancer (HLRCC)
This phase II trial investigates how well pamiparib and temozolomide work in treating patients with hereditary leiomyomatosis and renal cell (kidney) cancer. Poly adenosine diphosphate-ribose polymerase (PARPs) are proteins that help repair DNA mutations. PARP inhibitors, such as pamiparib, can keep PARP from working, so tumor cells can't repair themselves, and they may stop growing. Chemotherapy drugs, such as temozolomide, work in different ways to stop the growth of tumor cells, either by killing the cells, by stopping them from dividing, or by stopping them from spreading. Giving pamiparib and temozolomide may help treat patients with hereditary leiomyomatosis and renal cell cancer.
开始日期2021-10-18 |
申办/合作机构 |
100 项与 遗传性平滑肌瘤病和肾细胞癌 相关的临床结果
登录后查看更多信息
100 项与 遗传性平滑肌瘤病和肾细胞癌 相关的转化医学
登录后查看更多信息
0 项与 遗传性平滑肌瘤病和肾细胞癌 相关的专利(医药)
登录后查看更多信息
725
项与 遗传性平滑肌瘤病和肾细胞癌 相关的文献(医药)2025-05-01·European Journal of Surgical Oncology
Intraoperative electron radiotherapy (IOERT) in colorectal cancer: Updated systematic review of techniques, oncological outcomes and complications
Review
作者: West, Malcolm A ; West, Charles T ; Woyton, Michal ; Yano, Hideaki ; MacCabe, Tom ; Lee, Sheah Lin ; Micklethwaite, Rohan ; Tiwari, Abhinav ; Mirnezami, Alex H
2025-04-01·Pediatric Nephrology
Bone impairment in atypical hemolytic and uremic syndrome treated by long-term eculizumab
Article
作者: Bacchetta, Justine ; Desjonqueres, Marine ; Tenenbaum, Julie ; Chavassieux, Pascale ; Leclerc, Anne-Laure Sellier ; Regnier, Maitena ; Fremeaux-Bacchi, Véronique ; Farlay, Delphine
2025-03-01·IJU Case Reports
Postmortem genetic diagnosis of hereditary leiomyomatosis and renal cell carcinoma syndrome: Identification through normal kidney tissues after surgical removal
Article
作者: Suzuki, Shodai ; Miyamura, Takako ; Matsui, Takahiro ; Hatano, Koji ; Hashimoto, Kae ; Nonomura, Norio ; Kawashima, Atsunari ; Nagashima, Yoji ; Kato, Taigo ; Yamamoto, Yoshiyuki
3
项与 遗传性平滑肌瘤病和肾细胞癌 相关的新闻(医药)2024-07-29
·生物探索
引言
粘膜驻留共生菌在生物地球化学循环(biogeochemical cycles)和人类健康中起着至关重要的作用【1】。微生物群落的生物学特性是由它们的分类组成决定的。例如,肠道菌群的变化与多种慢性炎症性疾病 (包括癌症) 直接相关【2,3】。肿瘤发生可诱发应激性回肠病,促进肠道生态长期失调,且主要特征为比例显著上升的免疫抑制性肠闭菌属,这一菌属通常参与诱导PD-1阻断耐受【4】。然而,粪便微生物移植(fecal microbial transplantation,简称FMT) 可以通过诱导不同的肠道微生态变化,改善宿主肠道菌群和肿瘤微环境的炎性、免疫原性以及代谢水平,从而避免对黑色素瘤免疫治疗的原发性耐药性【5,6】。事实上,免疫检查点抑制剂或嵌合抗原受体- T细胞疗法的临床疗效与各种恶性肿瘤患者的肠道共生菌有关【7】。值得注意的是,抗生素 (万古霉素除外)、质子泵抑制剂和益生菌可能改变肠道菌群的分类组成,导致对免疫治疗产生耐药性。
健康的肠道生态系统,包括一些毛螺旋菌科和瘤胃球菌科的成员,以及来自粪杆菌属、阿克曼氏菌属和双歧杆菌属的物种,拥有模式识别受体配体,产生对应代谢产物 (如短链脂肪酸、l -精氨酸、肌苷或色氨酸),并表达癌症抗原模拟物,可在免疫治疗期间引发1型干扰素 (IFN) 或白细胞介素-12 (IL-12) 介导的TH1或滤泡T辅助细胞免疫响应。尽管在至少18项辅助研究中有令人信服的证据表明有益和有害的宏基因组物种与临床结果相关,但关于微生物组特征通常与疗效的相关性却很少达成共识。此外,相关技术仍需迭代,以期对用户更为友好,来支持常规肿瘤学检查中合并微生物组分析。
导致上述情况的因素较为复杂,例如技术局限性 (粪便样本收集方法和DNA提取方案)、患者群体的地理差异 (不同国家的饮食和药物不同)、统计原因 (例如患者之间的差异、小样本量)、治疗结果的不同定义 (例如,将稳定的疾病分为无响应者或响应者,或使用无进展生存期 (PFS) 而不是最佳临床反应作为结果衡量标准),以及由不同物种驱动的功能相关微生物信号。尽管共生肠道菌群越来越受到关注,但对微生物群落内相互作用的理解仍然有限。此外,很难预测哪些微生物群会形成一个稳定的群落,以及一个给定的群落如何对内在 (病理) 或外部 (治疗) 扰动作出反应。还有,尽管资源竞争、相互喂食(metabolic cross-feeding)和生态位可用性是微生物群落聚集的主要驱动因素,但宿主合并症和药物对肠道菌群的影响仍有待阐明。而通过丰度网络分析识别种类多样且相互合作的细菌功能群,有可能作为标准宿主代谢状态以及疾病进展情况的有效方法。
近日,来自法国ClinicObiome的Laurence Zitvogel研究组在Cell上发表题为Custom scoring based on ecological topology of gut microbiota associated with cancer immunotherapy outcome 的文章,通过肠道菌群的丰度网络分析,建立了肠道菌群与肿瘤免疫疗法疗效之间的相关性。
基于粪便宏基因组学测序,作者构建了一个共丰度网络,描述了245例晚期非小细胞肺癌患者的相对丰度相互关系。该网络确定了几个微生物亚群落,称为“物种相互作用群” (species-interacting groups,简称SIGs),并鉴定出两个主要的SIGs,可以驱动晚期非小细胞肺癌对PD-1阻断的临床反应,即“SIG1”包括37个与不良反应相关的细菌,“SIG2”包括45个与良好反应相关的细菌。个体SIG1/SIG2比率可以反映个体的菌群平衡水平。而分数落在中间类别 (“灰色地带”,既不是SIG1也不是SIG2) 的个体可以根据Akkermansia spp(Akk)的相对丰度进一步分离。接下来,作者通过SIG1/SIG2比值和Akk丰度的结合产生了拓扑评分 (TOPOSCORE) ,预测了254名NSCLC患者 (一线或二线治疗)、216名肾细胞癌 (RCC) 和尿路上皮癌 (UC) 患者对PD1/PDL-1阻断疗法的可行性。通过拓扑评分,作者观察到分别为20%、53%、58%、35%和57%的健康志愿者、1期LNSCLC、2期NSCLC、2期LRCC和2期UC,表现出肠道生态失调。作者最终将拓扑评分的计算缩小到21个种属,并建立了一个基于qPCR的用户友好测试,能够准确识别所选的21种细菌的粪便存在。这21组基于宏基因组测序的拓扑评分与黑色素瘤和结直肠癌患者的免疫治疗疗效相关。通过将拓扑评分转换为基于qPCR的48小时测试,将有可能在常规临床实践中采用该评分来分流患者。
综上所述,作者的工作建立了基于粪便宏基因组测序的拓扑评分与黑色素瘤和结直肠癌患者的免疫治疗疗效的相关性。此外,本文报道的观察性队列共包括872例非小细胞肺癌、泌尿生殖系统癌和结直肠癌患者,也为免疫疗法响应与肠道菌群的相关性提供了资源。
模式图(Credit: Cell)
参考文献
1. Cho, I., and Blaser, M.J. (2012). The human microbiome: at the interface of health and disease. Nat. Rev. Genet. 13, 260–270. https://doi-org.libproxy1.nus.edu.sg/10. 1038/nrg3182.
2. Gilbert, J.A., Blaser, M.J., Caporaso, J.G., Jansson, J.K., Lynch, S.V., and Knight, R. (2018). Current understanding of the human microbiome. Nat. Med. 24, 392–400. https://doi-org.libproxy1.nus.edu.sg/10.1038/nm.4517.
3. Gacesa, R., Kurilshikov, A., Vila, V.A., Sinha, T., Klaassen, M., Gacesa, R., Kurilshikov, A., Vich Vila, A., Sinha, T., Klaassen, M.A.Y., Bolte, L.A., An- dreu-Sa ́ nchez, S., Chen, L., Collij, V., Hu, S., et al. (2022). Environmental factors shaping the gut microbiome in a Dutch population. Nature 604, 732–739. https://doi-org.libproxy1.nus.edu.sg/10.1038/s41586-022-04567-7.
4. Yonekura, S., Terrisse, S., Alves Costa Silva, C.A.C., Lafarge, A., Iebba, V., Ferrere, G., Goubet, A.-G., Fahrner, J.-E., Lahmar, I., Ueda, K., et al. (2022). Cancer induces a stress ileopathy depending on B-adrenergic re- ceptors and promoting dysbiosis that contribute to carcinogenesis. Cancer Discov. 12, 1128–1151. https://doi-org.libproxy1.nus.edu.sg/10.1158/2159-8290.CD- 21-0999.
5. Davar, D., Dzutsev, A.K., McCulloch, J.A., Rodrigues, R.R., Chauvin, J.- M., Morrison, R.M., Deblasio, R.N., Menna, C., Ding, Q., Pagliano, O., et al. (2021). Fecal microbiota transplant overcomes resistance to anti– PD-1 therapy in melanoma patients. Science 371, 595–602. https://doi. org/10.1126/science.abf3363.
6. Baruch, E.N., Youngster, I., Ben-Betzalel, G., Ortenberg, R., Lahat, A., Katz, L., Adler, K., Dick-Necula, D., Raskin, S., Bloch, N., et al. (2021). Fecal microbiota transplant promotes response in immunotherapy-refrac- tory melanoma patients. Science 371, 602–609. https://doi-org.libproxy1.nus.edu.sg/10.1126/ science.abb5920.
7. Routy, B., Le Chatelier, E., Derosa, L., Duong, C.P.M., Alou, M.T., Daille` re, R., Fluckiger, A., Messaoudene, M., Rauber, C., Roberti, M.P., et al. (2018). Gut microbiome influences efficacy of PD-1-based immuno- therapy against epithelial tumors. Science 359, 91–97. https://doi-org.libproxy1.nus.edu.sg/ 10.1126/science.aan3706.
https://doi-org.libproxy1.nus.edu.sg/10.1016/j.cell.2024.05.029
责编|探索君
排版|探索君
文章来源|“BioArt”
End
往期精选
围观
一文读透细胞死亡(Cell Death) | 24年Cell重磅综述(长文收藏版)
热文
Cell | 是什么决定了细胞的大小?
热文
Nature | 2024年值得关注的七项技术
热文
Nature | 自身免疫性疾病能被治愈吗?科学家们终于看到了希望
热文
CRISPR技术进化史 | 24年Cell综述
免疫疗法微生物疗法临床研究
2023-06-12
关注并星标CPHI制药在线 淋巴瘤是一种起源于淋巴造血系统的恶性肿瘤,其中约有10%为霍奇金淋巴瘤(HL),含有RS(Reed-Sternberg)细胞为特征,其余不含RS细胞的淋巴瘤均属于非霍奇金淋巴瘤。尽管联合化疗和放疗的初始治疗使得HL的治愈率较高,但仍有约5%-10%的患者对于初始治疗无反应,且一线治疗后仍有15%-20%的患者出现进展或复发,这部分患者对创新的治疗药物和方案有着迫切需求。 在这种背景下,Seagen公司的Adcetris(brentuximab vedotin,维布妥昔单抗)应运而生。 Adcetris由靶向CD30的单抗brentuximab和小分子毒性药物MMAE,通过一种蛋白酶敏感连接子Vat-Cit偶联而成,属于第二代ADC代表药物。其作用机制为:通过brentuximab的靶向作用,Adcetris富集于CD30表达的肿瘤细胞表面,经抗体介导的细胞内吞作用内化。此时,连接子被胞内蛋白酶水解、释放毒性药物,MMAE与细胞质的微管蛋白结合,抑制细胞分裂、杀死肿瘤细胞。CD30在HL的RS细胞表面特异性表达,而在其他普通细胞中表达有限,因此成为治疗HL的理想靶点。 2011年8月,Adcetris获FDA批准,用于ASCT(自体干细胞移植)失败或至少2种多药化疗方案治疗失败且不适合ASCT 的 R/R HL(复发/难治性HL)患者以及系统性间变性大细胞淋巴瘤(sALCL)患者。Adcetris成为自1977年以来首个获批用于治疗HL的新药,也重新定义了HL的治疗格局。 此次批准基于一项单臂II期临床试验,102例ASCT后复发或难治性经典型霍奇金淋巴瘤(cHL)患者经Adcetris治疗后,客观缓解率(ORR)达75%,完全缓解率(CR)达34%,疾病控制率(DCR)为96%。 鉴于良好的治疗效果,此后,Adcetris继续拓展适应症。2018年3月,Adcetris联合化疗方案AVD(阿霉素、长春新碱和达卡巴嗪),获FDA批准作为CD30阳性初治HL成人患者的一线治疗。 此次批准基于一项名为 ECHELON-1的试验,研究共纳入1334例R/R cHL患者,与ABVD(阿霉素、博来霉素、长春碱、达卡巴嗪)治疗组相比,Adcetris+AVD治疗组显著改善了患者的中位无进展生存期(mPFS)(HR=0.770,p=0.035)。 2020年,Adcetris被NMPA批准用于治疗复发或难治性sALCL和CD30阳性HL患者,是第二款国内获批上市的ADC。 迄今为止,Adcetris围绕cHL和sALCL,已获批六个适应症。随着适应症的拓展和商业化区域的增加,Adcetris的销售额也一路高涨。2019年,Adcetris在北美的销售额达6.3亿美元。2022年,Seagen全年总营收为20亿美元,其中Adcetris贡献了8.39亿美元,同比增长19%。今年第一季度Adcetris销售额为2.43亿美元,同比增长34%。 除了Adcetris外,Seagen的ADC管线中还有Padcev、Tukysa和Tivdak等,深受资本关注。今年3月,辉瑞以430亿美元的高价收购了Seagen。就在Seagen平步青云的时候,这个ADC领域的头部玩家遭到了来自PD-1的打击。 2023ASCO:Opdivo冲击HL的一线治疗 在今年的ASCO大会上,百时美施贵宝公布了其PD-1抑制剂Opdivo(Nivolumab,纳武利尤单抗,俗称O药)与Adcetris的“头对头”研究结果。在这项名为SWOG-S1826的研究中,共招募近1000例未接受过既往治疗的III或IV期HL儿童和成人患者,旨在评估新诊断HL患者中的N-AVD(Opdivo组)与BV-AVD(Adcetris组)的疗效和安全性。 试验结果显示,相比于BV-AVD组合疗法,N-AVD组合疗法能够将HL患者进展或死亡风险降低52%。在治疗1年后,N-AVD组PFS率为94%,BV-AVD组为84%。 在安全性方面,N-AVD组看起来也更具优势。BV-AVD观察到11例死亡(7例死于不良事件),N-AVD组死亡4例(3例死于不良事件)。N-AVD组≥3级血液学不良反应发生率为48.4%,BV-AVD组为30.5%。发热性 中性粒细胞减少(5.6% Opdivo vs 6.4% Adcetris)、肺炎(2.0% Opdivo vs 3.2% Adcetris)、ALT升高(30.7% Opdivo vs 39.8% Adcetris)和结肠炎(1% Opdivo vs 1.3% Adcetris)的发生率(任何级别)相似。 根据试验数据可知,与Adcetris组相比,O药组具有更好的疗效和安全性,有望跻身HL一线治疗队列。Dana-Farber癌症研究所医学博士Oreofe Odejide在一份声明中表示,与Adcetris加AVD相比,Opdivo加AVD是“一种耐受性更好、持久缓解患者比例更高的新型护理标准”。这对于Adcetris来说,无疑是一个较大的打击。 不过目前为止,本试验的OS数据尚未成熟,O药在HL一线治疗中的优势仅局限在PFS获益,最终能否转换为OS获益,还需继续观察。 KEYNOTE-204研究:K药“头对头”战胜Adcetris 事实上在O药之前,PD-1领跑者K药(Keytruda, 帕博利珠单抗)就已经头对头挑战Adcetris了。在一项名为KEYNOTE-204的研究中,Keytruda与Adcetris“头对头”比较在治疗复发/难治性经典型霍奇金淋巴瘤(R/R cHL)患者中的疗效,主要终点为PFS和OS。研究共纳入304例cHL成人患者,随机分配至Keytruda组或Adcetris组。 结果显示,Keytruda组与Adcetris组相比,PFS显著延长:13.2个月vs 8.3个月;客观缓解率(ORR)显著提高:65.6% vs 35.6%;部分缓解率(PR):41.1% vs 30.1%;中位缓解持续时间(mDOR):20.7个月 vs 13.8个月。另外Keytruda组疾病进展或死亡风险显著降低了35%。 安全性方面,Keytruda组和Adcetris组的不良事件发生率相似:74.3% vs 77.0%。最常见的3-5级不良反应包括肺炎(Keytruda 4% vs Adcetris 1%),中性粒细胞减少(2% vs 7%)以及周围神经病(1% vs 3%)等。接受Keytruda治疗的患者中有13%的患者因治疗相关不良反应而造成停药,而接受Adcetris治疗的患者中有16%的患者因治疗相关不良反应而停药。 基于该研究结果,2020年,FDA全面批准Keytruda用于既往经治HL患者的治疗。 目前在后线治疗HL领域,国内的派安普利单抗、卡瑞利珠单抗等PD-1抑制剂,都已经成功获批。而在市场空间更大的一线治疗HL领域,O药是首个挑战成功的免疫抑制剂。为了应对即将到来的危机,Adcetris聪明地选择了与O药联合。在CheckMate 812研究中,Seagen测试了Adcetris和O药组合用药在新诊断HL患者中的疗效,该研究旨在减少化疗的应用。数据显示,Adcetris+O药的响应率超过90%,88%的晚期HL患者和92%的早期HL患者对联合治疗产生了完全反应。 从Adcetris在淋巴瘤的遭遇可以看出,就算发展如日中天的ADC药物也会遇到瓶颈,它并不能在每个肿瘤领域都得心应手。而开创了肿瘤免疫治疗的PD-1抑制剂虽然具有响应率不高的局限性,但它已然成为肿瘤免疫治疗的基石。在冲击HL一线治疗的研究中,O药已然显示出了疗效和安全性优势,下一步O药与Adcetris联合又将擦出怎样的火花,值得期待。 参考来源: 1.A novel enediyne-integrated antibody-drug conjugate shows promising antitumor efficacy against CD30lymphomas+.Mol Oncol.2018 Mar;12(3):339-355.2.Bristol Myers' Opdivo keeps cancer at bay in more lymphoma patients than Seagen's Adcetris in PhIII: #ASCO23(endpts).3.Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021 Apr;22(4):512-524. doi: 10.1016/S1470-2045(21)00005-X.【企业推荐】智药研习社近期课程报名来源:CPHI制药在线声明:本文仅代表作者观点,并不代表制药在线立场。本网站内容仅出于传递更多信息之目的。如需转载,请务必注明文章来源和作者。投稿邮箱:Kelly.Xiao@imsinoexpo.com▼更多制药资讯,请关注CPHI制药在线▼点击阅读原文,进入智药研习社~
抗体药物偶联物上市批准临床结果细胞疗法临床2期
2022-08-17
点击上方的 行舟Drug ▲ 添加关注肾癌发病率居中国泌尿生殖系统肿瘤的第3位,仅次于膀胱癌和前列腺癌,占成人恶性肿瘤的2%~3%,发病率呈现逐年上升的趋势。2%~4%的肾癌患者由易感基因胚系突变导致,表现为发病年龄早、双侧、多灶性肾癌比例高、肾癌家族史阳性,被称为家族遗传性肾癌综合征。目前发现的家族遗传性肾癌综合征及相应的易感基因包括:VHL综合征(VHL基因)、结节性硬化综合征(TSC1/TSC2基因)、遗传性乳头状肾癌(MET基因)、遗传性平滑肌瘤和肾细胞癌综合征(FH基因)、Birt-Hogg-Dubé综合征(FLCN基因)、染色体3易位所致的家族透明细胞癌、BAP1癌症综合征(BAP1基因)、Cowden综合征(PTEN基因)、琥珀酸脱氢酶缺乏型肾癌(SDH基因)等。1. VHL综合征VHL综合征发病率约为1/36 000,主要临床表现有中枢神经系统(脑、脊髓)血管母细胞瘤、视网膜血管母细胞瘤、肾癌或肾囊肿、胰腺肿瘤或囊肿、肾上腺嗜铬细胞瘤、内淋巴囊肿瘤和生殖系统囊肿等,其中肾细胞癌(renal cell carcinoma,RCC)是VHL综合征患者重要的临床表现之一,也是患者死亡的主要原因之一。据国内外报道,VHL综合征患者RCC发生率为25%~60%,平均发病年龄为40~45岁,比散发性肾癌平均发病年龄约早20年,且随着患者年龄的增长患者双侧肾脏会不断有新的RCC发生,呈双肾多发。VHL综合征患者RCC的病理类型几乎全部为透明细胞癌,组织学分级大多为Ⅰ级。与散发性肾癌相似,VHL综合征相关RCC早期通常不引起特殊症状,患者肾功能和尿常规检查多为正常,多数通过影像学检查被发现。晚期患者可出现血尿、疼痛、腹部肿块等症状体征。VHL综合征相关肾囊肿多为双肾多发,病理学上分为单纯性肾囊肿、不典型增生性肾囊肿以及囊性肾透明细胞癌。有研究认为,在VHL综合征中肾囊肿为肾细胞癌的癌前病变。附睾囊肿及囊腺瘤是男性VHL综合征患者的常见表现,可累及单侧或双侧,双侧受累是其与散发性附睾肿瘤鉴别的重要依据;国外文献报道的发生率为25%~60%,平均发病年龄约24岁,尚无国内患者数据报道,一般不会影响患者的生育功能。2. 遗传性乳头状肾细胞癌与其他遗传性肾癌综合征不同,遗传性乳头状肾细胞癌(HPRC)不会出现肾以外的器官受累,肾脏是该疾病唯一的受累器官。同其他遗传性肾癌一样,HPRC通常表现为双侧、多发病灶,甚至有上百个微小病灶的报道。晚期患者常合并慢性肾功能衰竭,从而可出现尿毒症相关的一系列临床表现。此类患者由于缺乏肾外表现,因此临床表现与一般肾癌相似。早发与迟发的HPRC均有报道,然而对于不足30岁出现HPRC Ⅰ型伴家族史的患者,需要考虑到遗传性肾癌的可能性。3. 遗传性平滑肌瘤病及肾细胞癌综合征遗传性平滑肌瘤病和肾细胞癌(HLRCC)多发于年轻女性,肾肿瘤多为早发、单侧、单发病灶。临床上这类肿瘤具有早期广泛转移倾向,即使小的肿瘤也可发生转移,预后较差。同时此类患者易发生皮肤平滑肌瘤、多发性和早发性的子宫肌瘤。皮肤平滑肌瘤常表现为躯干和四肢上多个坚硬的肉色结节(一般为10个以上,甚至100个以上,大小0.4~2.5 mm),有时呈节段状,通常出现症状,表现出疼痛和感觉异常。皮肤病变的平均发病年龄约为25(10~47)岁。皮肤平滑肌瘤患者中有较大比例出现子宫平滑肌瘤(子宫肌瘤)。患者可出现多个子宫肌瘤(甚至多达20个),大小1.5~10 cm。症状包括月经不调、月经过多和疼痛,并且发病较早(中位年龄28~32岁)。4. 风险评估及基因检测家族遗传性肾癌综合征由于涉及易感基因较多,且其易感基因突变率相对其他遗传性肿瘤较小,目前尚未有较为系统、规范的风险评估及基因检测体系可供参考。但是,对于普通人群中具有遗传性肾癌风险的患者进行确切的胚系遗传风险评估,有助于识别特定患者,制定相应的随访及基因检测方案。对于肾透明细胞癌患者,若VHL综合征家族史或其他相关器官临床表型,可进行VHL基因突变检测。然而,对于无VHL综合征临床表型的遗传性肾透明细胞患者,可进行胚系核型分析以评估是否存在3号染色体易位,或进行SDHC基因胚系突变检测。对于有HPRC风险的患者,由于其具有发病较晚的特点,因此可从21岁起开始进行MET基因胚系突变检测。BHD综合征(Birt-Hogg-Dube syndrome)是一种罕见的家族遗传性显性疾病。此类患者的初诊通常是因其典型的临床表现而诊断。在BHD综合征患者中,90%有皮肤纤维滤泡瘤,而84%的患者被发现有肺囊肿,近30%的患者有气胸史。虽然BHD综合征相关肾癌的病理表型可以是多变的(多为嫌色细胞型、嗜酸细胞型和透明细胞型单独或混合),但近60%的肿瘤为混合嗜酸细胞型肾细胞癌。因此,对于有皮肤纤维滤泡瘤、家族性肺囊肿、气胸和(或)有嗜酸细胞型肾细胞癌的患者,建议从21岁开始进行FLCN基因胚系突变检测。HLRCC的临床表现更为多变,患者有罹患皮肤和子宫肌瘤以及侵袭性的Ⅱ型乳头状肾癌的风险,其病因学特征是三羧酸循环中富马酸水合酶(fumarate hydratase,FH)的基因发生胚系突变。对于患有皮肤、子宫肌瘤和(或)Ⅱ型乳头状肾癌患者,可从8岁开始进行FH基因胚系突变检测。HLRCC患者一旦出现肾癌,侵袭性往往较高,早期即可能出现转移,因此FH基因胚系突变检测对有HLRCC风险的患者十分重要。专家组意见:对于发病较早(46岁以下)、双侧、多发肾癌的患者,以及具有肾癌家族史的患者,推荐进行易感基因胚系突变检测。同时以临床表现、年龄和病理类型为指导,选择检测何种基因。对于遗传性肾透明细胞癌患者,推荐检测VHL、SDHC、BAP1、TCS1和TSC2基因。对于Ⅰ型HPRC患者,推荐检测MET基因。对于Ⅱ型HPRC患者,推荐检测FH基因。对于遗传性嗜铬细胞瘤和肾癌,推荐检测FLCN、TSC1、TSC2基因。对于早发的疑似遗传性肾癌患者,可考虑SDH和FH基因突变检测。5. 治疗策略不同于其他遗传性肿瘤疾病,遗传性肾癌综合征的临床生物学特征多样,涉及多个器官病变,决定了其诊疗过程中不仅需要临床学科,还需要其他基础学科包括分子诊断、遗传学、生物信息学等的参与,才能制定出综合的诊断、监测和治疗方案。因此对于遗传性肾癌,在多学科模式下开展诊治是其首选策略,根据患者病情,充分发挥各学科优势,才能使得患者的临床治疗利益最大化。本共识主要阐述遗传性肾癌综合征关于肾脏病变的相关治疗策略。VHL综合征相关肾癌1) 主动监测由于VHL综合征相关肾癌具有双侧多发且不断新生的特点,患者一生可能经历多次肾脏手术,对其生存质量、心理健康、肾功能保护均带来不利影响,同时也不断增加手术难度、医疗风险和花费。临床中应在保证肿瘤可控的前提下尽可能减少患者的手术次数。目前对于肿瘤最大直径<3 cm的患者,推荐主动监测。专家组意见:推荐肿瘤最大直径<3 cm的患者行主动监测,推荐患者每年进行1次腹部增强CT或MRI检查,对于肿瘤最大直径接近3 cm、既往肿瘤每年平均线性生长率>5 mm或肿瘤进展风险较高的患者应缩短复查间隔。2) 手术治疗对于VHL综合征肾癌患者,手术目标是在控制肿瘤进展的前提下尽可能保存正常肾组织。干预过早将增加治疗次数、手术风险和花费,同时会损失更多的肾功能;干预过晚将增加保留肾单位的难度、增加肾切除的风险,同时可能会出现肾癌转移、危及患者生命。VHL综合征相关肾癌3 cm以下基本未见转移,因此3 cm一直是学术界比较公认的肾癌手术干预标准。近年来,大量国内外研究提出将手术干预标准提高至4 cm。对于T1~T2期肾癌,根治性肾切除术只有在患肾已无功能或残余肾组织无保留价值时才是推荐的手术方案,对于肿瘤位置特殊、肾部分切除术风险过高的患者,根治性肾切除术也是可选。对于T3~T4期肾癌,若出现肉眼血尿,也应采取根治性切除手术。当双侧均有肿瘤达到界值需要手术治疗时,以尽量避免对孤立肾行肾部分切除术而增加围术期肾功能不全及相关并发症风险。专家组意见:VHL综合征相关肾癌在可行条件下尽量实行保留肾单位手术,以维持患者的生存质量。手术方案(保留肾单位手术或根治性肾切除术)、手术入路选择(经腹膜后或经腹膜腔)、术式选择(开放或腹腔镜或机器人)及术中规划,需要临床医师充分了解患者病情,根据患者本身病灶的位置、大小、个数等因素进行选择,原则是最大化患者获益和减少手术风险。3) 局部能量治疗减少手术次数、减少对肾周结构的干扰是局部能量治疗的优势之一。目前常用的方式包括射频、微波、冷冻和高能聚焦超声等,以射频消融术研究较多。对于T1a期肾肿瘤,射频消融与肾部分切除术有相似的无病生存率,且有较少的并发症。其对肾周结构基本不存在干扰,不增加后续手术难度,且无需阻断肾动脉,不增加肾脏缺血时间。其常见的并发症以血尿、腰痛为主,通常症状程度较轻。对于部分完全内生型占位,因肿瘤与集合系统关系密切,术后可能会造成迟发性尿瘘,可通过术前留置输尿管支架管(double J ureteral catheter,DJ管)进行预防。专家组意见:T1a期肾肿瘤可选择射频消融治疗,完全内生型占位肾肿瘤可通过术前留置DJ管以预防迟发性尿瘘。4) 药物治疗VHL综合征肾癌的药物治疗包括化疗、靶向治疗、免疫治疗等,其中抗血管生成的靶向治疗已经成为散发性的晚期肾癌的一线方案,而散发性肾癌和VHL综合征相关肾癌最重要的发病机制均是VHL蛋白失活导致缺氧诱导因子上调、促进血管生成因子表达升高。因此,以血管生成为靶点的多激酶抑制剂(如舒尼替尼、索拉菲尼等)理论上对VHL综合征相关肿瘤应有较好的效果。目前研究认为舒尼替尼在VHL综合征相关肾癌中较散发性肾癌可能具有更好的效果;帕唑帕尼对VHL综合征相关肾癌疗效确切。专家组意见:推荐晚期VHL综合征相关肾癌选择抗血管生成的靶向治疗。5) 处理肾囊肿VHL综合征相关肾囊肿的囊壁和囊液中均可能存在癌细胞,囊肿恶性的概率高于散发性病例,需仔细甄别并谨慎处理。术前需要依据增强CT等对肾囊性病变进行Bosniak分级,预测其恶性风险。对于囊实性病变、多发厚壁分隔的复杂囊肿、高密度囊肿等恶性风险较高的Bosniak ⅡF~Ⅳ级囊肿建议按照恶性肿瘤进行肾部分切除术。对于Bosniak Ⅰ级囊肿及部分体积较大、位置较深或邻近肾蒂的Ⅱ级囊肿可以选择进行囊肿去顶术。专家组意见:推荐Bosniak ⅡF~Ⅳ级囊肿进行肾部分切除术,Bosniak Ⅰ级囊肿及部分体积较大、位置较深或邻近肾蒂的Ⅱ级囊肿可以选择囊肿去顶术。HPRC由于此病罕见,目前尚缺乏相关的研究资料,无相应的治疗指南。肿瘤最大直径<3 cm的HPRC可采取积极监测的方法,无需立即手术治疗。当病变的最大直径≥3 cm时,需采用外科治疗。尽管本病具有双侧、多病灶发病的特点,肾部分切除术仍是HPRC首选的治疗方法。保护患者的肾功能、避免或延迟透析对于改善患者的预后和提高生存质量十分重要。针对TKI及mTOR通路的靶向药物在转移性Ⅰ型乳头状肾细胞癌中的疗效差于透明细胞癌。目前用于HPRC的靶向药物主要针对HGF/MET通路,可分为抗MET单抗(rilotumumab)、抗HGF单抗(onartuzumab)和抗MET TKIs类药物(amuvatinib、卡博替尼等)3类。专家组意见:直径<3 cm的HPRC可选择主动监测,直径达到≥3 cm时在可行条件下尽量实行选择肾部分切除术,针对HGF/MET通路的靶向药物是HPRC的主要靶向治疗。HLRCCHLRCC与其他综合征的肾癌不同,具有独特的分子发病机制和更具侵袭性的生物学行为,即使原发病灶小也可发生远处转移。不推荐对其采用主动监测。Menko等提出优选开放性肾部分切除术,并保证手术切缘充分,同时行腹膜后淋巴结清扫术。若术前评估肾部分切除术不能达到治疗效果,建议行根治性肾切除手术。对于HLRCC患者,不推荐射频消融和冷冻治疗。目前,FH基因胚系突变引起的转移性Ⅱ型乳头状肾细胞癌患者暂无标准疗法。针对血管内皮生长因子(VEGF)和表皮生长因子受体(EGFR)为靶点开展的贝伐珠单抗和厄洛替尼治疗晚期HLRCC的Ⅱ期研究正在进行。文章信息源于公众号医世象,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或对其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若无意侵犯版权,请联系小编删除。学如逆水行舟,不进则退;心似平原走马,易放难收。行舟Drug每日更新 欢迎订阅+医药大数据|行业动态|政策解读
免疫疗法
分析
对领域进行一次全面的分析。
登录
或
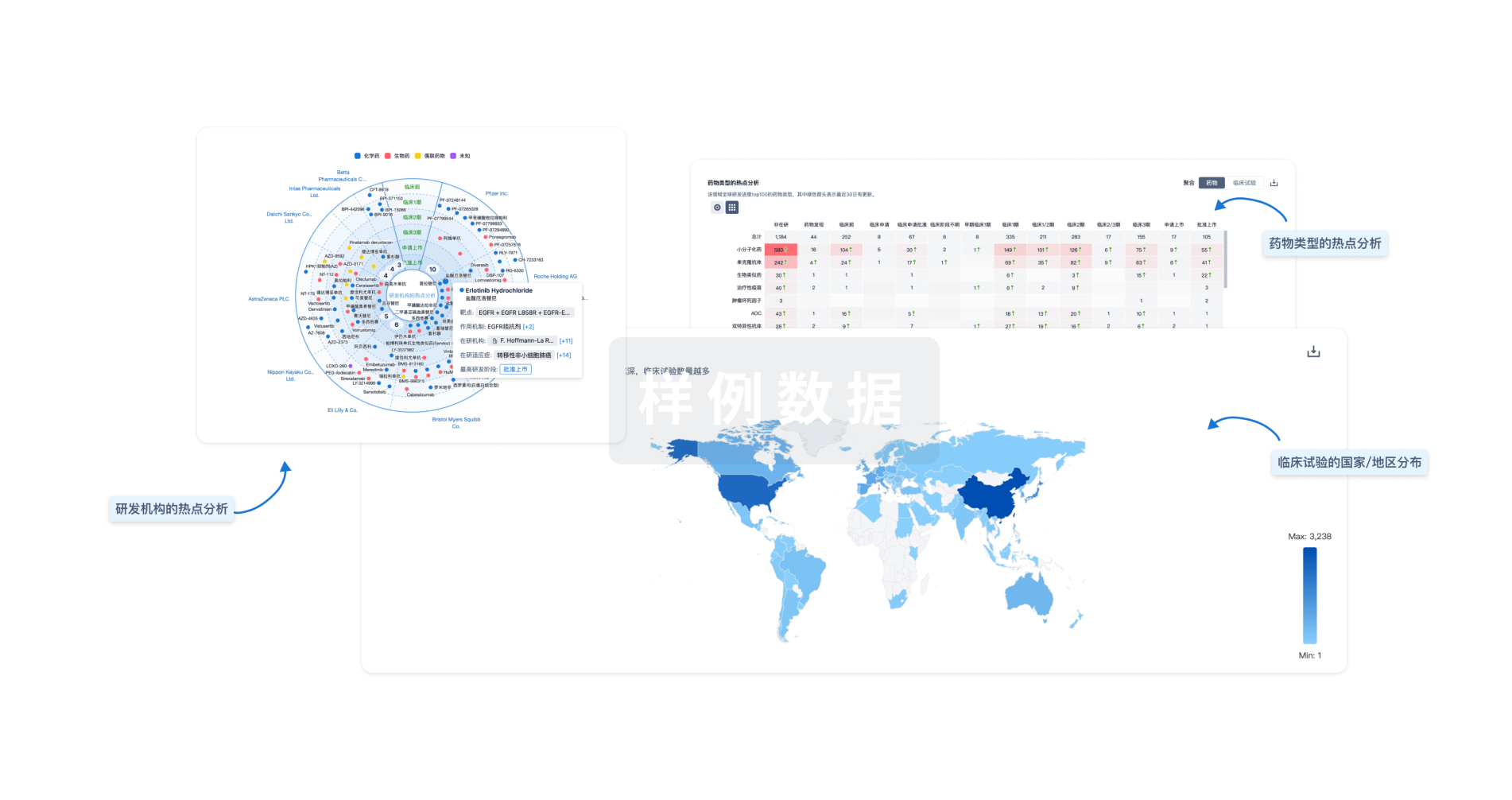
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用


