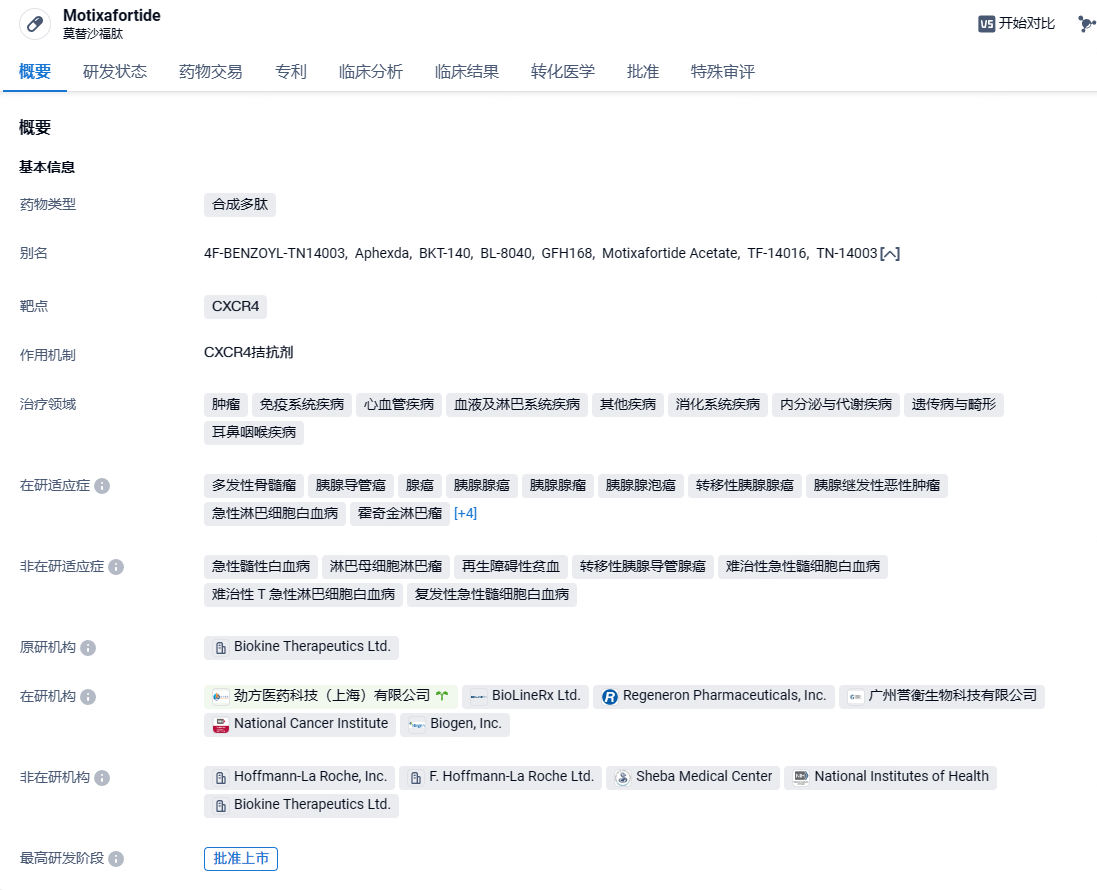
誉衡生物引进的CXCR4拮抗剂莫替福肽落地海南博鳌地区
2024年7月1日,誉衡生物宣布其核心产品创新细胞驱动因子受体CXCR4拮抗剂莫替福肽(motixafortide)近日经海南省药品监督管理局批准,获得临床急需特许药品进口批件,成功落地博鳌乐城先行区,将首先在博鳌超级医院应用于临床使用。
莫替福肽由BioLineRx公司研发的一种皮下注射给药的CXCR4拮抗剂,2023年7月份,劲方医药与BioLineRx达成合作开发协议,双方将共同拓展莫替福肽适应症范围。2023年9月11日,莫替福肽被FDA批准与粒细胞集落刺激因子(G-CSF)联合使用,以动员造血干细胞用于多发性骨髓瘤患者的收集和随后的自体移植。一剂莫替福和粒细胞集落刺激因子filgrastim在大多数多发性骨髓瘤患者中实现收集≥600万造血干细胞的目标。
莫替福肽全球多中心注册3期临床试验GENESIS研究结果显示,莫替福肽+粒细胞集落刺激因子(G-CSF)组有92.5%的患者达到主要终点,即一次注射,最多两次采集,92.5%的患者就可采集到了理想数量的干细胞(6×106 CD34+细胞/公斤)。一次单采收集的细胞中位数是单独使用G-CSF的5倍(~11M v.s ~2M),保证了自体造血干细胞移植所需的细胞数量,且安全性良好。GENESIS研究结果已于2023年4月发表在《自然-医学》(Nature Medicine)杂志。
2024年5月,基于临床3期GENESIS研究中亚洲受试者数据预期无种族差异,誉衡生物获得中国国家药品监督管理局药品审评中心(CDE)批准,开展一项在多发性骨髓瘤患者中联合G-CSF动员造血干细胞用于自体移植的桥接3期临床研究,并于同期启动中国澳门地区及新加坡等地区的新药上市注册申请。
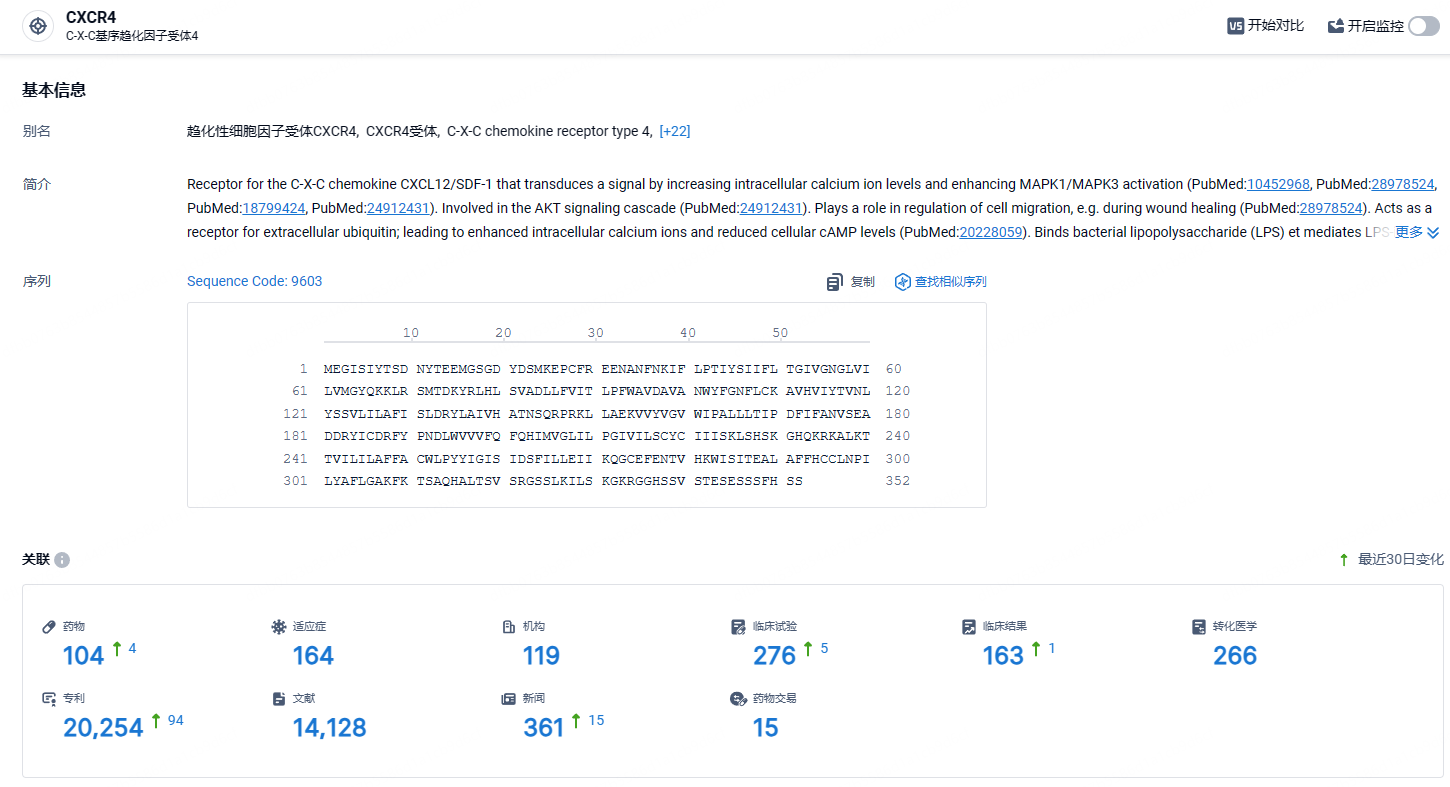
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CXCR4 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月3日,CXCR4靶点共有在研药物104个,包含的适应症有164种,在研机构119家,涉及相关的临床试验276件,专利多达20254件……多发性骨髓瘤是第二常见的血液恶性肿瘤,亚洲人口规模庞大,2022年新发病例数为 51,400 例,我国发病率约为1.6/10万,发病率逐年增加。GLOBOCAN 报道我国每年新增患者约2万,死亡约1.5万。根据Cancer Statistics Review初步预计我国总患者超过10万人。此次莫替福肽在乐城先行区的特许药械政策下,正式获得批准,标志着中国在多发性骨髓瘤治疗及干细胞移植领域的治疗又一重要进展,在此治疗领域的技术和药物应用实现了全球创新同步使用,为更多需要造血干细胞移植的患者提供了更多的选择和希望。