齐鲁制药公布PD-1/CTLA-4靶向组合抗体QL1706 2期临床数据,针对宫颈癌!
近日,齐鲁制药宣布,在2024年欧洲妇科肿瘤学会(ESGO)年会上,该公司将以口头报告形式公布其1类新药艾帕洛利托沃瑞利单抗注射液(QL1706)治疗宫颈癌的2期临床试验研究结果。
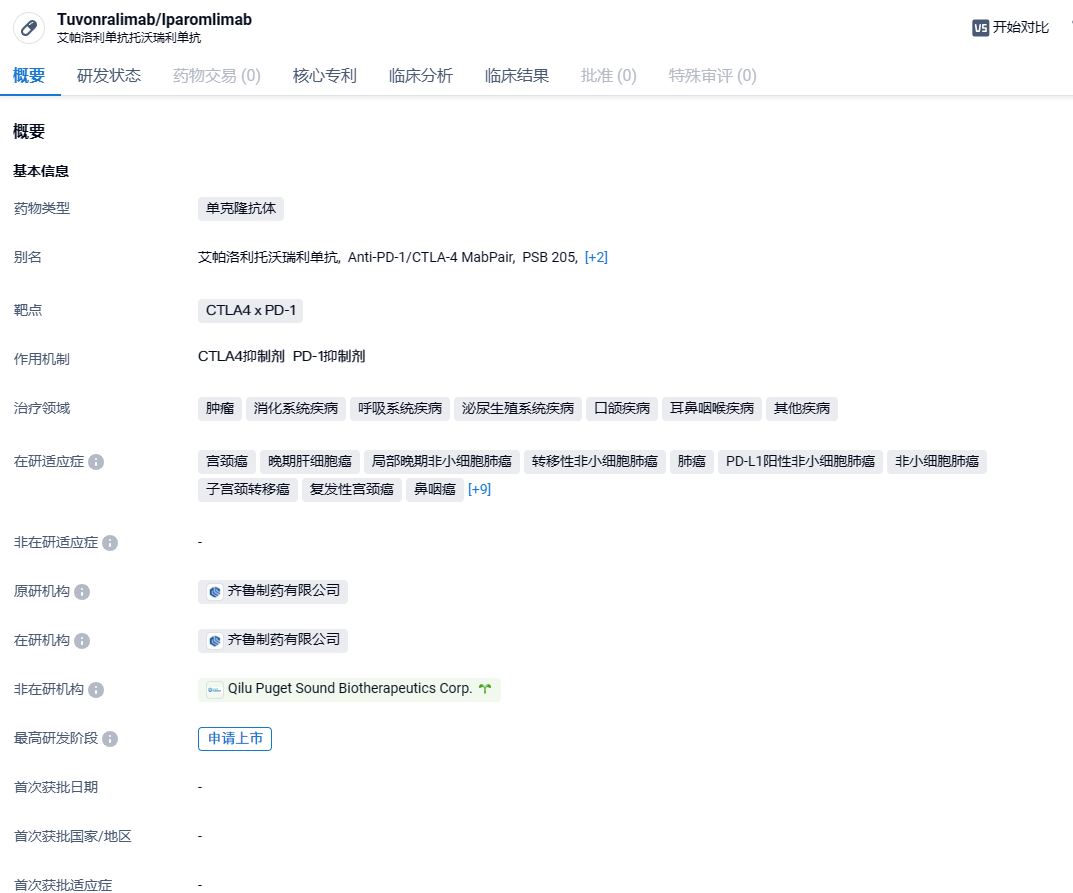
艾帕洛利托沃瑞利单抗(QL1706)为一种新型CTLA4 x PD-1组合抗体,由靶向PD-1的IgG4抗体艾帕洛利单抗(QL1604)和靶向CTLA-4的IgG1抗体托沃瑞利单抗组成。QL1706中的抗PD-1单抗组分的分子序列、宿主细胞、构建、转染及单克隆筛选过程与QL1604单抗相同。即QL1706是在获得QL1604单克隆的基础上,进一步将抗CTLA-4抗体重组质粒转染至QL1604单克隆中,通过筛选最终获得QL1706单克隆细胞株。临床前已对二者进行过初步的析因分析试验。该候选药可同时抑制PD-1和CTLA-4,并且CTLA-4抗体成分在体内具有更短的清除半衰期、在一个给药周期内抗体暴露时间较短。因此,艾帕洛利托沃瑞利单抗既有同时阻断PD-1和CTLA-4的协同作用机制,又降低了CTLA-4抗体产生的毒性。
本次入选ESGO口头报告的是一项多中心、单臂2期临床试验,研究纳入一线含铂化疗±贝伐珠单抗失败且未接受过免疫治疗的复发/转移宫颈癌患者。至数据截止日期,中位随访时间为11.0个月。主要终点独立评价委员会(IRC)评价的客观缓解率(ORR)为33.8%,达预设主要终点。安全性方面,共计104例(70.3%)受试者发生了治疗相关不良事件(TRAE)。36例(24.3%)受试者发生了≥3级TRAE,其中最常见的是贫血(4.1%)。3例受试者(2.0%)因为TRAE停止治疗。无导致死亡的TRAE。
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CTLA4 x PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月5日,CTLA4 x PD-1靶点共有在研药物20个,包含的适应症有101种,在研机构36家,涉及相关的临床试验953件,专利多达24761件……2023年8月,艾帕洛利单抗托沃瑞利单抗注射液的上市申请获CDE受理,为全球首款申报上市的PD-1/CTLA-4靶向组合抗体,有望将为宫颈癌患者带来新的治疗选择。