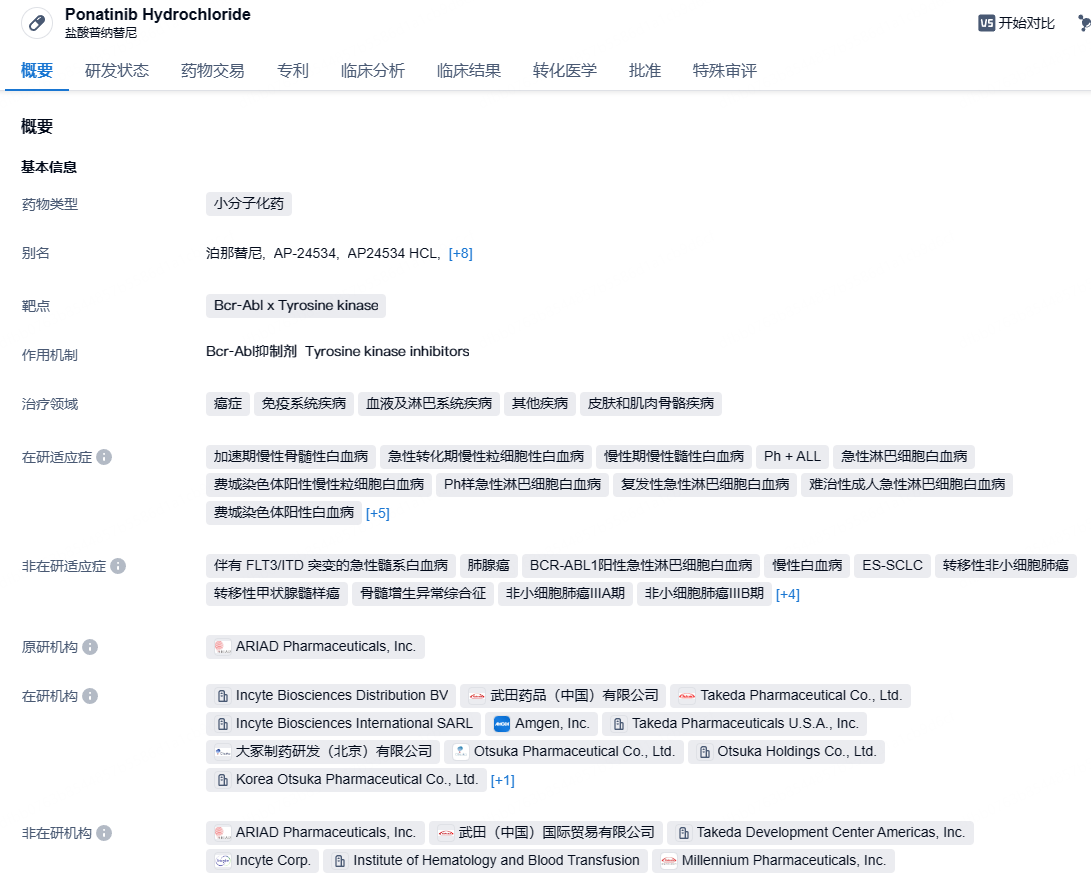
大冢制药第三代Bcr-Abl抑制剂「泊那替尼」国内获批上市,针对慢性髓性白血病
9月9日,NMPA官网显示,大冢制药的泊那替尼(ponatinib)的上市申请已获得批准,用于:1)既往用药耐药或不耐受的慢性髓性白血病(CML);2)复发或难治性费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL);3)T315I阳性慢性髓性白血病(CML)或T315I阳性费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)。
泊那替尼是一款克服T315I突变的第三代Bcr-Abl抑制剂,对T315I突变型Bcr-Abl激酶具有高效特异性抑制作用,可有效解决现有Bcr-Abl抑制剂普遍存在、因激酶突变引起耐药性的缺陷,该药还对其他激酶有一定的抑制作用,包括VEGFR、PDGFR、FGFR、EPH受体和SRC家族的激酶,以及KIT、RET、TIE2和FLT3。泊那替尼最早于2012年12月获FDA批准上市。2014年,大冢制药与ARIAD Pharmaceuticals达成合作,大冢制药以7750万美元的预付款和后续的里程金获得了在10个亚洲国家共同开发和商业化泊那替尼的权益。据医药魔方数据库,2023年泊那替尼为大冢制药带来了5340万美元的收入,2023年泊那替尼的全球收入为5.82亿美元。
两项使用泊那替尼临床试验(PACE和OPTIC)的最新结果,重点关注CML-CP患者,PACE和OPTIC试验中分别有63%和18%的患者以及34%和4%的患者。发生严重治疗引起的不良事件和严重动脉闭塞事件(AOE);然而,在OPTIC试验患者中,接受较低剂量(15mg/d)普纳替尼的94名患者中,只有3名(3.2%)在第1年至第3年之间出现AOE,并且3年总生存率与最初患者相似分配给45或30mg/d的剂量水平。
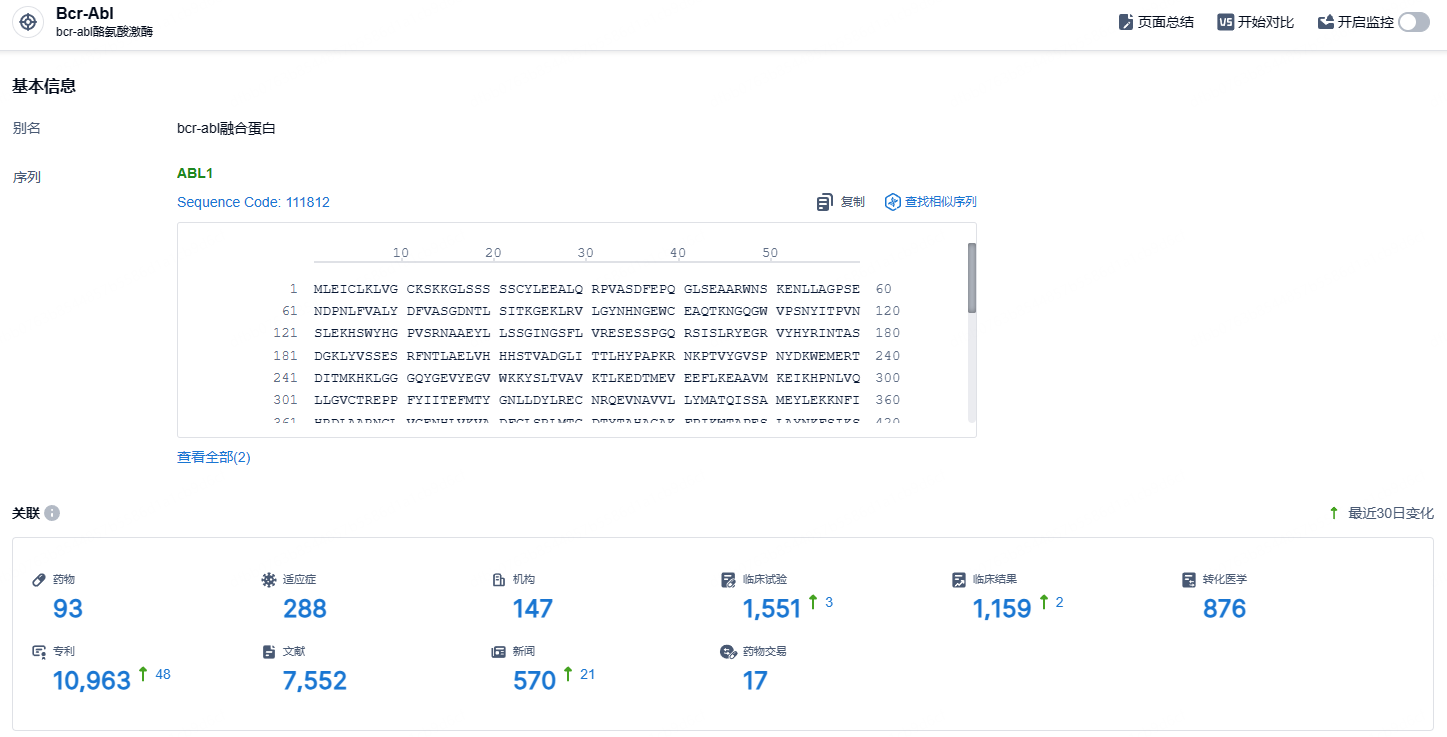
根据智慧芽新药情报库所披露的信息 (点击下方图片直达Bcr-Abl靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年9月10日,Bcr-Abl靶点共有在研药物93个,包含的适应症有288种,在研机构147家,涉及相关的临床试验1551件,专利多达10963件……泊那替尼是国内第二款上市的第三代 Bcr-Abl 抑制剂,第一款是亚盛医药的奥巴雷替尼。期待泊那替尼早日开出处方,为患者带来新的治疗选择。