礼来单抗mirikizumab III期试验达共同主要终点,治疗克罗恩病
2023年10月13日,礼来(Eli Lilly and Company)宣布,在3期试验VIVID-1中,与安慰剂相比,其在研单抗mirikizumab达到共同主要终点和所有主要次要终点,接受治疗的中度至重度活动性克罗恩病成人患者获得显著临床缓解。礼来打算递送这项积极的3期试验数据给美国FDA以及其他全球监管单位,作用该疗法用于治疗克罗恩病的上市申请基础。
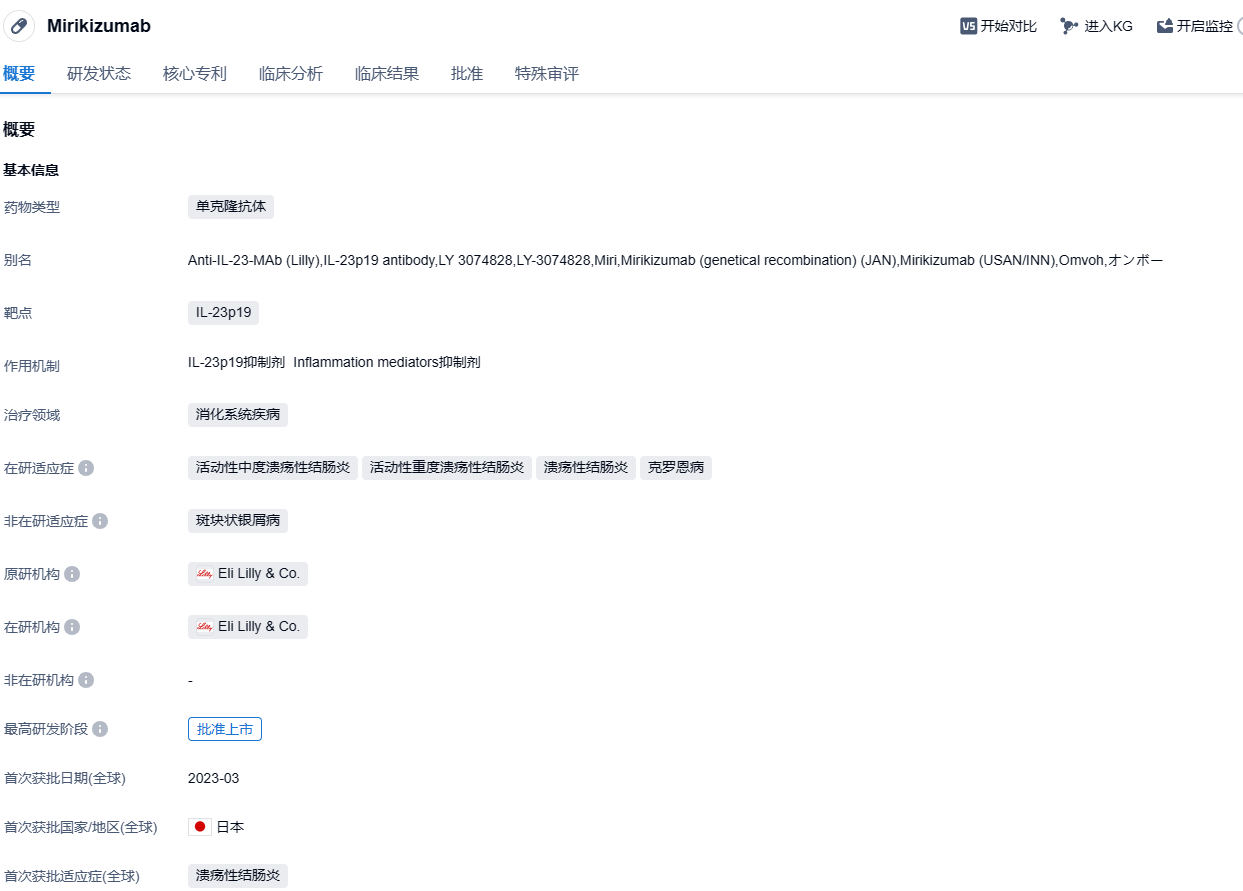
Mirikizumab由礼来公司开发,是一种针对IL-23p19的单克隆抗体。2023年3月27日,该药物首次获得日本厚生劳动省(MHLW)批准上市,作为中度至重度活动期溃疡性结肠炎成人的首创治疗药物。此外,欧洲药品管理局(EMA)人用药品委员会(CHMP)对mirikizumab作为对常规治疗或生物治疗应答不足、应答消失或不耐受的中度至重度活动期溃疡性结肠炎成年患者的首选治疗方案发表了积极意见。欧盟委员会于2023年5月26日授予mirikizumab的上市许可。今年6月底,基于LUCENT-1和LUCENT-2III期试验的成功结果,mirikizumab在英国成功获批。
在VIVID-1试验中,在12周诱导期接受活性药物治疗的所有患者继续其原始治疗,并进入研究的维持部分直至第52周。第12周未出现临床应答的安慰剂组患者(无应答者)则转换为盲态mirikizumab的治疗。该研究达到共同主要终点,即:与安慰剂组相比,在mirikizumab组中,在第12周达到临床缓解(定义为克罗恩病活动指数[CDAI]总分<150)并在第52周达到临床缓解的比例在统计学上更高(45.4%对比19.6%,p<0.000001)。与安慰剂组相比,在mirikizumab组中,在第12周达到临床缓解以及在第52周达到内镜缓解(定义为简单内镜评分-克罗恩病[SES-CD]总分较基线降低≥50%)的比例在统计上更高(38.0%对比9.0%,p<0.000001)。
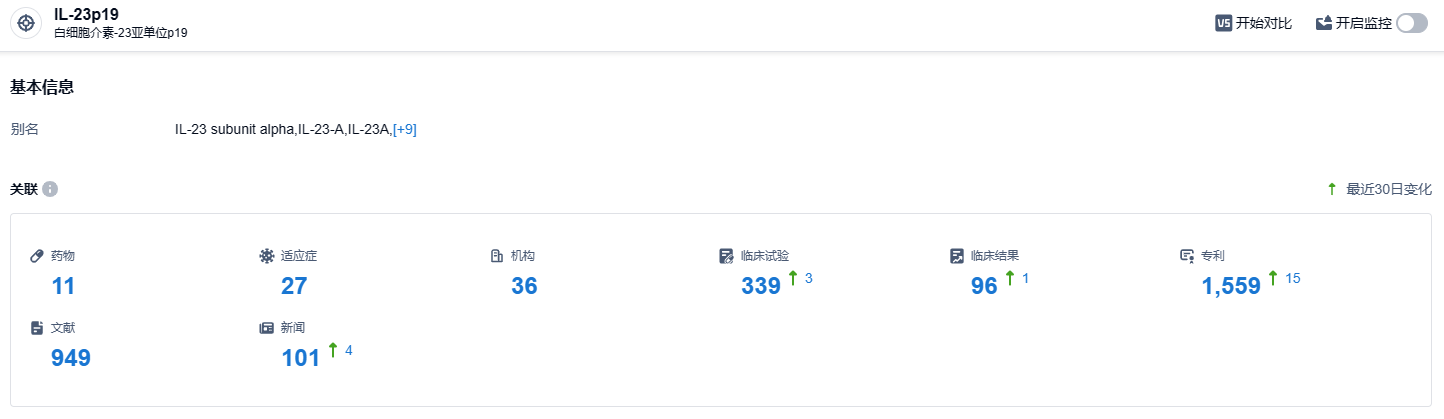
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-23p19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月14日,IL-23p19 靶点共有在研药物11个,包含的适应症有27种,在研机构36家,涉及相关的临床试验339件,专利多达1559件……期待mirikizumab的后续表现。据统计,全世界有超过1000万人患有克罗恩病和溃疡性结肠炎,这两种疾病被统称为炎症性肠病。在中国,溃疡性结肠炎的患病率约为11.6/10万,克罗恩病患病率约为2.29/10万,预计2025年中国的炎症性肠病患者将达到150万,已经由少见病发展为常见病。期待mirikizumab的后续研发顺利,为更多患者带来新的治疗选择。