葛兰素史克抗PD-1单抗Jemperli在新加坡获批上市,针对结肠癌
8月7日,葛兰素史克(GSK)新加坡公司宣布,新加坡卫生科学管理局(HSA)已批准Jemperli(dostarlimab)的一项新适应症,即与卡铂和紫杉醇联合使用,随后Jemperli作为单一药物用于治疗原发性晚期或复发性子宫内膜癌患者,这些患者存在错配修复缺陷(dMMR)或高度微卫星不稳定性高(MSI-H)。
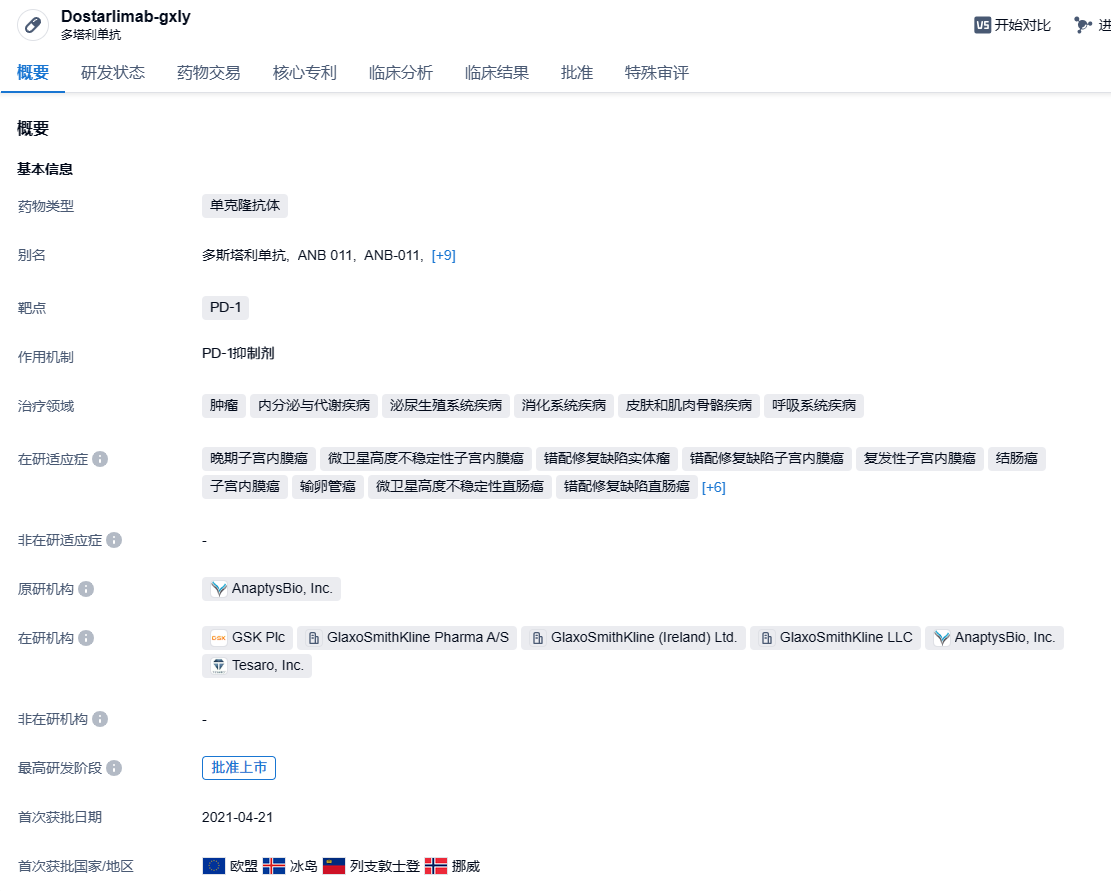
Dostarlimab(Jemperli)是葛兰素史克(GSK)旗下的PD-1单抗,能够与PD-1受体结合,并阻断其与配体PD-L1和PD-L2交互作用的抗体。2021年4月,FDA加速批准Dostarlimab用于治疗此前接受含铂化疗后疾病进展,且存在DNA错配修复缺陷(dMMR)的成人复发性或晚期子宫内膜癌。2021年8月,FDA又加速批准Dostarlimab新适应症上市申请,用于治疗dMMR复发或晚期实体瘤患者。2023年8月1日,美国FDA批准Jemperli(Dostarlimab)与卡铂和紫杉醇联合用药,并接续Jemperli作为单药以治疗由美国FDA批准的检测方法确定为错配修复缺陷型(dMMR)或高度微卫星不稳定性(MSI-H)的原发性晚期或复发性子宫内膜癌成人患者。Dostarlimab是首个获批与化疗联合用于该患者群体一线治疗的免疫肿瘤疗法。2024年8 月 1 日,葛兰素史克宣布,FDA 批准 Dostarlimab 联合卡铂和紫杉醇,随后 Dostarlimab 作为单一药物治疗原发性晚期或复发性子宫内膜癌的成人患者。在此之前,Dostarlimab 已获批用于联合化疗治疗具有错配修复缺陷(dMMR)或微卫星不稳定性高(MSI-H)的原发性晚期或复发性子宫内膜癌成年患者。
本次GSK向新加坡监管机构提交的文件包括3期RUBY/ENGOT-EN6/GOG3031/NSGO试验第一部分的中期分析结果,中位随访时间为25个月。该试验达到了研究者评估的无进展生存期(PFS)的主要终点,表明在dMMR/MSI-H人群中,接受Jemperli +卡铂和紫杉醇治疗的患者具有统计学意义和临床意义的益处。
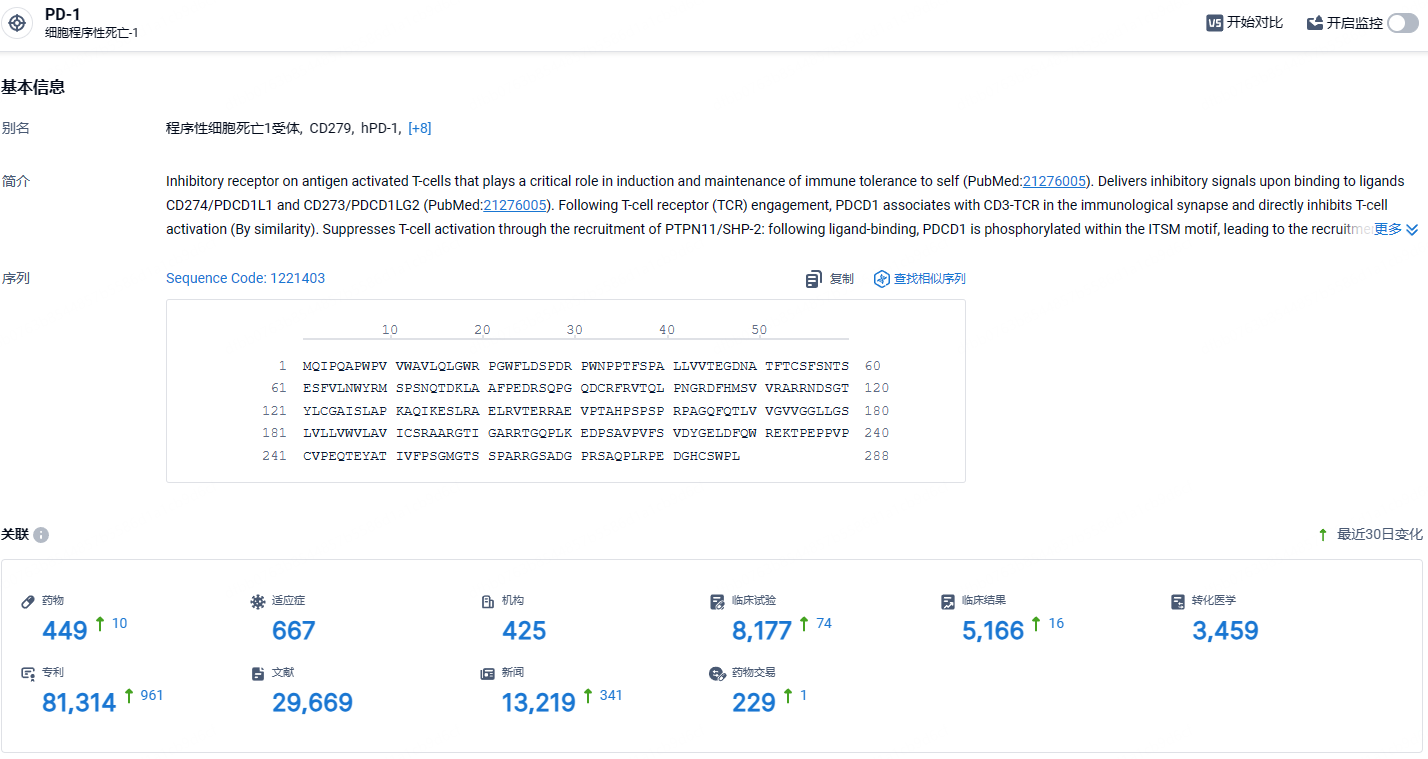
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月8日,PD-1靶点共有在研药物449个,包含的适应症有667种,在研机构425家,涉及相关的临床试验8177件,专利多达81314件……Jemperli早前已获得新加坡HSA的批准,作为dMMR复发或晚期子宫内膜癌成人患者的单药治疗,这些患者在任何情况下在先前含铂方案中或之后进展,并且不适合治疗性手术或放疗。此次扩大适应症,有助于Dostarlimab商业化进程的加快,期待Dostarlimab的后续表现。