JMC|阿斯利康入脑KRAS抑制剂解析
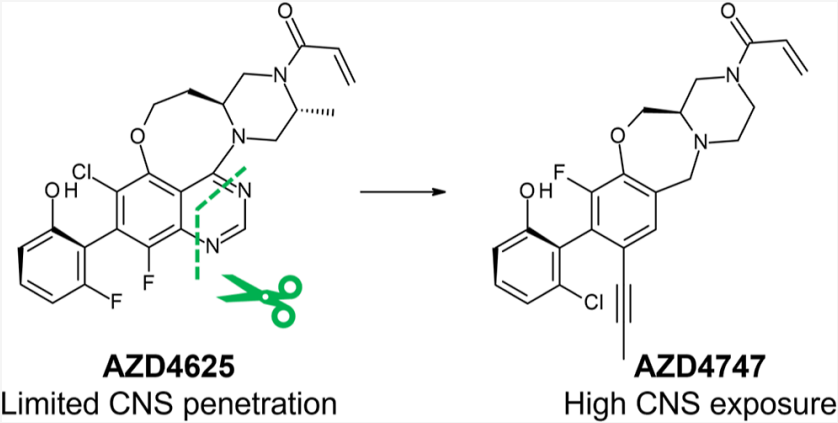
最近,顶级期刊JMC公布了一篇研究报告,介绍了阿斯利康研发的透脑KRAS G12C抑制剂AZD4747的研究进展。从图1可以看出,阿斯利康对自家开发的G12C抑制剂AZD4625进行了改进,摆脱了嘧啶环,降低了分子的平面性,引入炔甲基,从而得到了具有高CNS暴露的AZD4747(临床前阶段)。
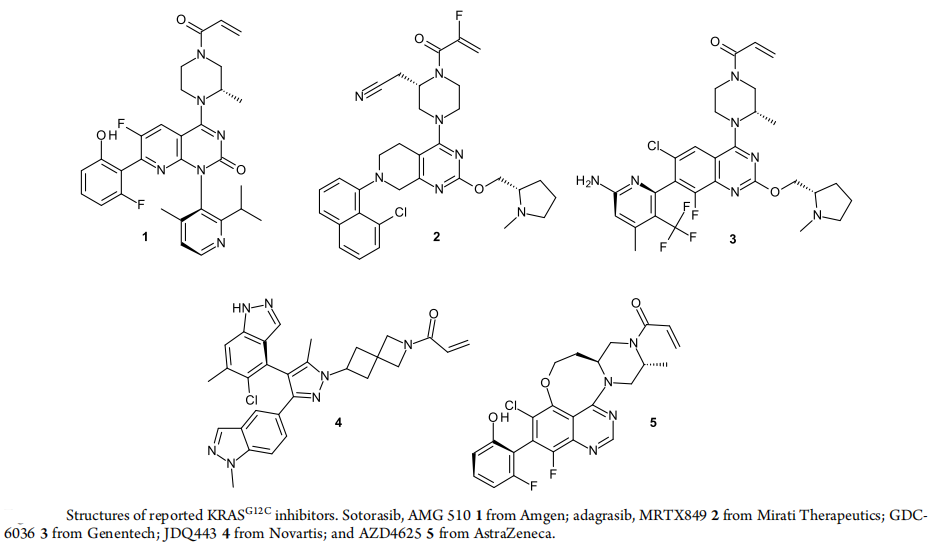
KRAS G12C抑制剂的研发市场竞争激烈,市场上已经有多种药物在研发和评估阶段。上市的药物中包括AMG510和MRTX849,在国内外还有多种抑制剂正在临床阶段。公开公告的药物包括基因泰克的GDC-6036、诺华的JDQ443、以及AZD4625,还有一些尚未公开结构的药物正在临床试验中,包括礼来公司的LY3537982、勃林格殷格翰公司的BI 1823911和InventisBio公司的D-1553。礼来的早期分子LY3499446和强生的JNJ-74699157由于毒性问题已经停止了临床试验。KRAS的其他亚型如G12D、G12V、G13D等也都在火热研发中,panKRAS和RAS on抑制剂也是焦点。
2023年7月4日,加科思公布,由于资产与战略考量,艾伯维决定终止与其的合作协议,退回SHP2抑制剂的全球权益。诺华的SHP2抑制剂单药的临床失败已久,加科思的权益被退是早晚的事情。KRAS抑制剂与SHP2抑制剂的联用已经成为SHP2的救命稻草。
来自安进的财报显示,Sotorasib在2021年和2022年的销售额分别为0.9亿美元和2.85亿美元,不及华尔街分析师预期。临床试验中,Sotorasib和Adagasib的缓解率均在40%左右,无进展生存期(PFS)中位数增加约6个月。这对于靶向突变的特异性治疗而言并不理想,也不如其他靶向药物(如EGFR和ALK抑制剂)的效果。
此外,已经出现了对治疗的耐药性,耐药机制多种多样,包括KRAS、NRAS、BRAF、EGFR、FGFR2、MYC等基因突变。基因扩增和点突变发生在KRAS和NRAS以及MEK等下游效应物中,导致直接抵抗抑制或通过旁路信号通路重新激活。先天和潜在获得性耐药的另一个主要机制是中枢神经系统(CNS)的转移性疾病的存在,特别是对于无法透脑的药物。比方说,NSCLC的一个常见特征是转移性脑疾病,高达20%的患者会出现这种状况。颅内疾病可以通过放射治疗来控制,但毒性较大。KRAS G12C阳性NSCLC中也常有CNS转移,高达28%的患者在诊断时可以检测到CNS疾病,随访时发生率可上升至40%。因此,能入脑的KRAS G12C抑制剂具有明显的临床优势。
在中枢神经系统中实现药物暴露是数十年来的难题,比简单地达到口服暴露要困难得多。这是因为血脑屏障对于外源药物构成了强大的屏障,它表达高水平的外排转运蛋白和紧密的细胞内连接,防止大部分药物被动渗透。阿斯利康总结出筛选入脑药物的一般要求为分子量(MW) < 450,极性表面积(PSA) < 90 Å2、LogD在1-4之间,还有更严格的需求是PSA < 70 Å2。进一步提高入脑的可能需要PSA < 90 Å2,氢键供体(HBD) < 3, LogD在2 ~ 5范围内,MW <500。目前被提出的CNS药物设计指南包括PSA < 76 Å2(但优选在25 - 60 Å2范围内)和HBD < 3(理想情况下为0或1)。Sotorasib (MW = 561, PSA = 92 Å2,HBD = 1, Log D = 2.3)和Adagasib (MW = 604, PSA = 71 Å2,HBD = 0, Log D =3.6)距离这些理想的特性还有一段距离。
阿斯利康在开发透脑药物上有成功的经验,包括突变型EGFR激酶抑制剂osimertinib(已上市)、EGFR激酶抑制剂AZD3759(申请上市)、ATM激酶抑制剂AZD1390(临床I期)、PARP1选择性抑制剂AZD9574(临床I/II期)。此外,有阿斯利康合资企业迪哲开发的HER2小分子抑制剂DZD1516(临床I期)。
AZ经过多次优化后,确定了AZD4747作为目标分子,其KRASG12C IC50=15 nM,Log D7.4= 2.9,PSA = 53 Å2,HBD = 1,嘧啶环的移除使分子权重减至441。AZD4747显示出可以进入CNS系统的性质,对人体的P-gp和BCRP外排效果低。
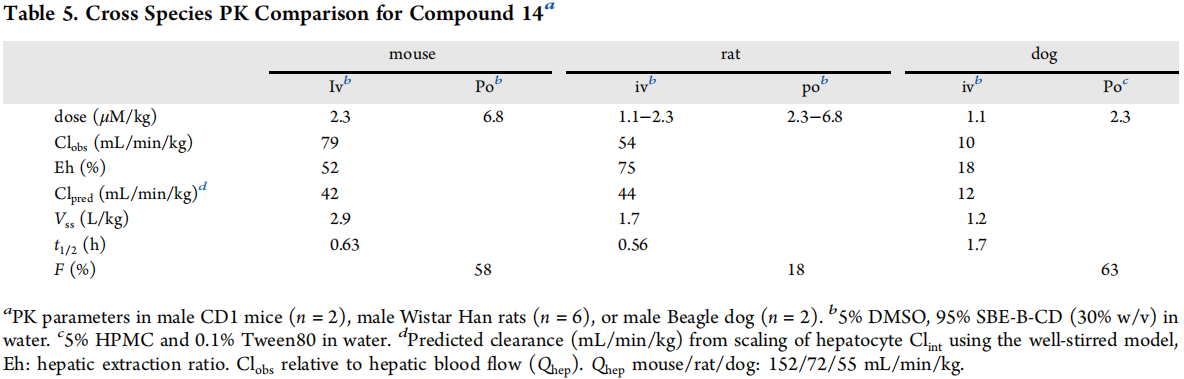
如图3所示,在啮齿类动物中,观察到的清除率从中等到高,小鼠和大鼠的肝血流量分别为52%和75%。小鼠的口服生物可利用度(58%)较大鼠(18%)高。在犬身上,清除率相对较低,仅占肝脏血流量的18%,口服生物可利用度为63%。种群间的稳态分布体积适中,介于1.7 ~ 2.9 L/kg之间。大鼠的脑内Kpu,u为0.1低于预期,而犬和猴的Kpu,u分别为0.7和1.6,符合筛选标准。
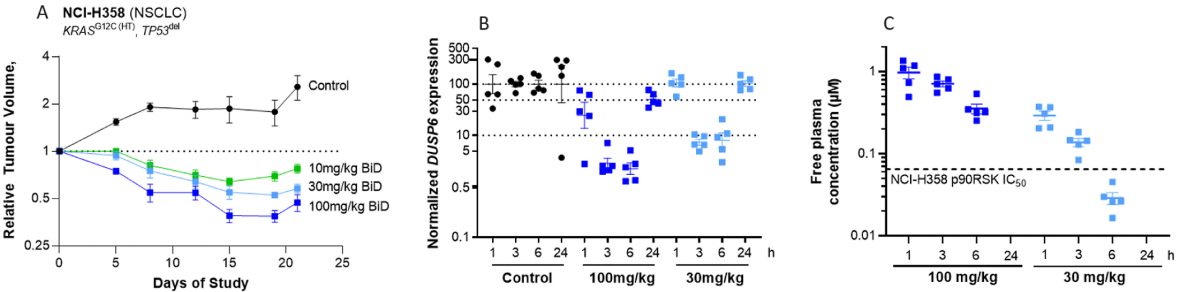
如图4展示,AZD4747在动物模型的药效进行了验证。小鼠每日口服AZD4747,剂量分别为100mg /kg、30mg /kg和10mg /kg,对KRAS G12C突变体H358异种移植瘤的生长表示良好的耐受,且高剂量的使用表现出显著的消退效果,AZD4747在游离血浆中的浓度与剂量成线性关系。用AZD4747处理的小鼠肿瘤表现出DUSP6表达的剂量和暴露依赖性下降。
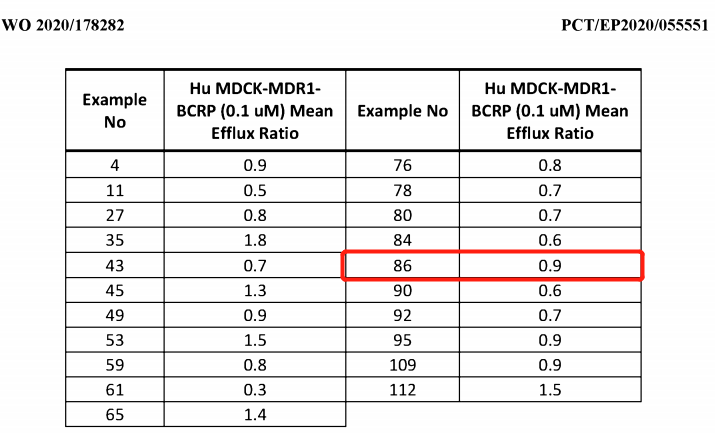
以KRAS、AstraZeneca为关键词查询智慧芽专利数据库,找到4篇WO专利:WO2020178282、WO2019215203、WO2019110751、WO2018206539。后三篇专利与KRAS入脑抑制剂的关系较小,专利WO2020178282中的实施例85和86之一为AZD4747。这两个化合物为两个轴手性异构体。只测了86的活性和外排数据,86应该为AZD4747。转染的细胞系MDCK_MDR1_BCRP表达了两种主要的外排泵,这两种泵积极地排除化合物穿过血脑屏障的转运,通过该方法测量的具有2或更小的外排比的化合物被确定为具有良好血脑屏障渗透特性的潜力。图5所示的化合物都有潜力,后续根据其他评价数据确定了化合物86具有均衡的成药潜力。专利WO2020178282的最早优先权日为2019年3月5日,国际申请时间为2020年3月3日,国际公布日为2020年9月10日,国内公开文本CN113508118A预期到期时间为2040年3月3日。
在KRAS G12C已上市的两个药物中,已有发表的sotorasib研究没有包括CNS转移活跃的患者,因此关于sotorasib中枢神经系统渗透的数据较少。Sabari等人首先对KRAS突变NSCLC患者的脑转移进行了回顾性分析,然后对adagrasib的药理学和临床前数据进行了全面回顾,发现在多个临床前脑脊髓炎模型中,adagrasib能渗透到脑脊液中,表现出肿瘤消退和生存期的延长。在2例非小细胞肺癌和未经治疗的脑脊髓炎患者中,adagrasib脑脊液浓度高于靶细胞IC50。这两名患者均表现出相应的脑转移,支持adagrasib在脑中的潜在临床活性。只有2名脑转移患者的数据,也遭到外界批评。主要是因为脑转移的治疗和预防对患者预后至关重要。
这些数据支持adagrasib在KRAS G12C突变的非小细胞肺癌合并未经治疗的脑转移患者中的进一步发展(NCT03785249)。该项I/II期临床试验招募了822名患者,评估MRTX849 (adagasib)在KRAS G12C突变的晚期实体肿瘤患者中的安全性、耐受性、药物水平、分子效应和临床活性,预计完成时间为2024年9月。
此外,益方生物开发的D-1553在临床试验中发现,其中3名具有基线脑转移的患者中,有一名患者达到部分缓解,客观缓解率为17%,接受治疗前脑部的转移灶已经超过了20mm,接受治疗后肿瘤病灶缩小了近一半,另外两名病程稳定,疾病控制率达到100%。
然而,发生脑转移的患者可能因CNS系统受损,血脑屏障功能受损,使得临床前动物模型评估中无法进入脑部的化合物,在临床试验中表现出透脑的效果。AZ凭借多款成功开发的入脑药物的经验,期待其研究能继续为临床患者带来更多收益。

参考资料:
1.Oliver Steward et.al; Discovery of AZD4747, a Potent and Selective Inhibitor of Mutant GTPase KRASG12C with Demonstrable CNS Penetration.doi.org/10.1021/acs.jmedchem.3c00746.
2.Nagasaka et al;Penetrating the central nervous system sanctuary of KRAS, a target once thought “undruggable”.Transl Lung Cancer Res 2023;12(4):665-668.
3.专利 WO2020178282、CN113508118A公开文本.
4.https://clinicaltrials.gov/study/NCT03785249?term=NCT03785249&rank=1.