化学药品原料药生产工艺的开发与控制
前言
新药从发现到开发再到上市,需要原料药“质”方面的持续提升,以及“量”方面的成倍放大。物质基础犹如大厦之基,如若出现研究过程中的重大偏差及变更,可能会波及非临床和临床结果的客观评价,及其背后的资本投入与开发进程。这其中,原料药自始至终的生产工艺研究非常重要,是药学工作的核心内容之一。
1.原料药生产工艺开发-核心内容
原料药生产工艺开发的目的:1)早期是要开发出可以制备符合阶段性质量标准的原料药的开发工艺;2)后期须建立一个能够持续生产出预期质量原料药的商业化生产工艺。基于上述工艺开发逻辑,现重点罗列工艺开发过程中的一些核心内容和重点工具。
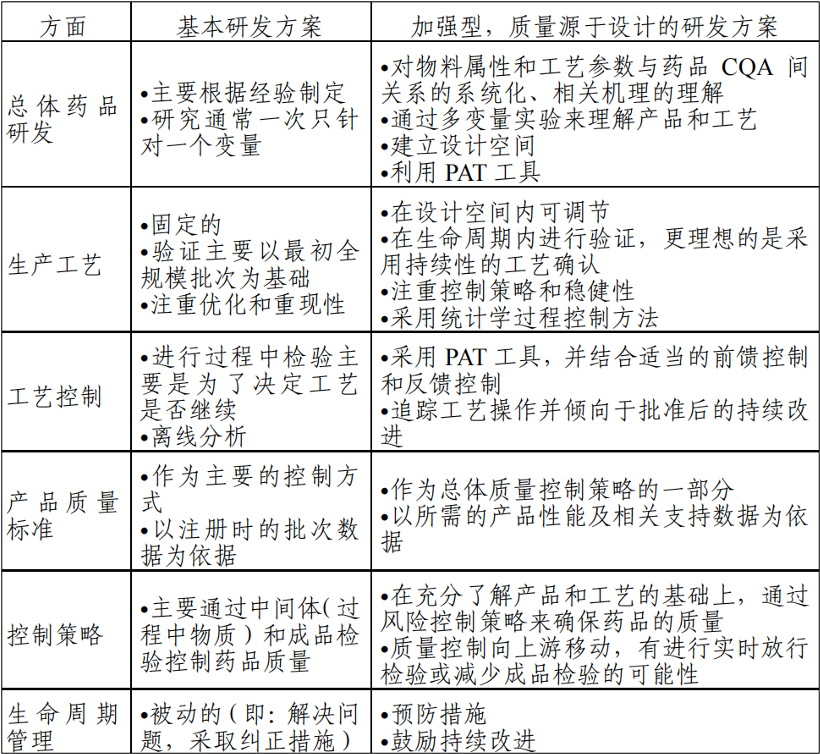
➣ 工艺开发方法
生产工艺开发至少应当包括以下要素:1)确定与原料药相关的潜在关键质量属性,以便于研究和控制这些对药物制剂质量产生影响的属性;2)确定一个合适的生产工艺;3)确定一个控制策略,以确保工艺的实施和原料药质量;4)评估、理解和改进生产工艺的系统方法;5)采用增强方式结合质量风险管理来建立一个合适的控制策略,例如,其中可以包括对设计空间的建议。另,申请人在原料药的开发中可以选择采用传统的方式或增强的方式,或同时使用两种方式。
➣ 原料药的关键质量属性
关键质量属性(CQAs):是一个物理、化学、生物学或微生物学属性或特征,其应该被限定在一个合适的限度、范围或分布内,以确保所需的产品质量。原料药的关键质量属性通常包括那些影响鉴别、纯度、生物活性和稳定性的属性或特征。当物理性质对药物制剂的生产或性能产生重要影响时,也可将其指定为关键质量属性。由于杂质可能会对药物制剂的安全性产生潜在的影响,因此杂质是原料药一类重要的关键质量属性。
➣ 物料属性&工艺参数&关键质量属性的关联
生产工艺的开发程序应当确认哪些物料的属性(例如原材料、起始原料、试剂、溶剂、工艺助剂、中间体的属性)和工艺参数应该被控制。
如采用增强方式,确定合适的物料质量标准及工艺参数范围需要遵循以下步骤:1)确认工艺变化的潜在源头;2)确认可能会对原料药质量产生最大影响的物料属性及工艺参数,可基于知识和风险评估工具;3)设计并进行研究(例如,机理和/或动力学评价、多变量试验设计、模拟、建模)来识别与确定物料属性和工艺参数与原料药关键质量属性之间的关联和关系;4)对数据进行分析与评估,来设定合适的范围,包括必要时建立的设计空间。
表1-1 生产工艺开发信息的递交内容
重点信息 | 详细内容 |
工艺开发 总结 | 推荐在生产工艺开发部分的开始,用一个叙述性地概要对工艺开发过程中的重要里程碑进行描述。该概要中应包括以下内容:1)原料药关键质量属性目录;2)生产工艺的演变阶段及控制策略的相关变更方面的简述;3)确认对原料药的关键质量属性产生影响的物料属性及工艺参数的简述;4)任何设计空间开发方面的简述。 |
原料药 关键质量属性 | 应当列出原料药的关键质量属性,并给出设定这些性质或特性作为关键质量属性的理由。某些与药物制剂关键质量属性相关的原料药关键质量属性的讨论可适当体现在申报资料的药物开发部分。 |
生产工艺 历史 | 应当描述并讨论生产工艺的重要变更或者是用于支持上市申请的原料药批次和生产规模批次制备地址的变更。通常按照时间顺序描述,从开始直至拟定的商业化生产工艺为止。应该提供批信息(批量或规模、生产地点与日期、使用的路线与工艺,以及用途)以及从相关原料药批次的对比分析中获得的支持性数据,或者提供参考的资料。 |
工艺开发 研究 | 在申报资料中引用的、用于确立商业化生产工艺重要特征和控制策略的研究和风险评估应该被列出。应提供每个被引用的研究或风险评估的目的或最终用途。每个引用的研究或风险评估都应当有充分详细的总结,以便于理解研究的目的、收集的数据、如何进行分析、得到的结论以及研究对生产工艺或生产工艺的进一步开发的影响。应该结合商业化生产工艺(3.2.S.2.2)中的目标操作条件或设计空间,对其中的特定参数及其范围的研究进行描述和讨论。应该对确立设计空间所用的风险评估工具和研究结果进行充分描述。 |
➣ 设计空间
设计空间是输入变量(例如,物料属性)和已被证明能够提供质量保证的工艺参数的多维组合和相互作用。在设计空间范围内的活动不被视为变更。超出设计空间的活动被视为变更,通常需要启动监管部门批准该变更。
可以确定每个单元操作(例如,反应、结晶、蒸馏、精制)的设计空间,或者确定选用的单元操作的组合的设计空间。包含这样设计空间的单元操作的选择通常基于它们对关键质量属性的影响,且不必是连续的。一个跨多个单元操作的设计空间可以提供更大的操作灵活性。
2.生产工艺开发--质量控制
无论是通过传统方式开发还是通过增强方式开发(或者两者兼有),每个原料药的生产工艺都有相关的控制策略,其包括但不限于以下内容:1)对物料属性的控制(包括原材料、起始原料、中间体、试剂、直接接触原料药的内包材等);2)内含在生产工艺设计中的控制(例如,精制步骤的顺序,或试剂的加入顺序);3)过程控制(包括过程检测及工艺参数);4)原料药的控制(例如放行检测)。
控制策略的开发可以结合各种方法进行,对一些关键质量属性、步骤或单元操作采用传统的方式;对其他方面采用增强的方式。在产品的生命周期中,随着对工艺的理解水平不断加深,可以通过多次循环的方式来开发控制策略。在解决操作范围的变化情况方面,基于增强方式的控制策略可以为工艺参数提供灵活的操作范围。
控制策略应该保证每个原料药的关键质量属性处于合适的范围、限度或分布区域内,以确保原料药的质量。原料药的质量标准是整个控制策略的一部分,而且并非所有的关键质量属性都需要被列入原料药的质量标准中。关键质量属性可以是:1)包括在质量标准中,并通过对最终原料药的检测加以确定;或2)包括在质量标准中,并通过上游控制(例如,通过实时放行检测)加以确定;或3)不包括在质量标准中,但通过上游控制来提供保证。在一些情况下,可用过程分析技术(PAT)来加强过程控制,保证产品的质量。
所提供的控制策略方面的信息应包括对控制策略单个要素的详细描述,在适当的时候,还要加上原料药控制策略的整体总结。可以采用表格形式或图例形式,这样比较直观化,便于理解。理想的总结应能够解释控制策略的各个要素是如何共同作用以确保原料药的质量。
表2-1 ICH M4推荐的原料药控制策略位置(红色标注)
3.2.S 原料药 | 3.2.S.1 基本信息 | 3.2.S.1.1 药品名称 |
| 3.2.S.1.2 结构 | ||
| 3.2.S.1.3 基本性质 | ||
| 3.2.S.2 生产 | 3.2.S.2.1 生产商 | |
| 3.2.S.2.2 生产工艺和工艺控制 | ||
| 3.2.S.2.3 物料控制 | ||
| 3.2.S.2.4 关键步骤和中间体的控制 | ||
| 3.2.S.2.5 工艺验证和/或评价 | ||
| 3.2.S.2.6 生产工艺的开发 | ||
| 3.2.S.3 特性鉴定 | 3.2.S.3.1 结构和理化性质 | |
| 3.2.S.3.2 杂质 | ||
| 3.2.S.4 原料药的质量控制 | 3.2.S.4.1 质量标准 | |
| 3.2.S.4.2 分析方法 | ||
| 3.2.S.4.3 分析方法的验证 | ||
| 3.2.S.4.4 批分析 | ||
| 3.2.S.4.5 质量标准制定依据 | ||
| 3.2.S.5 对照品 | ||
| 3.2.S.6 包装系统 | ||
| 3.2.S.7 稳定性 | 3.2.S.7.1 稳定性总结和结论 | |
| 3.2.S.7.2 批准后稳定性研究方案和承诺 | ||
| 3.2.S.7.3 稳定性数据 |
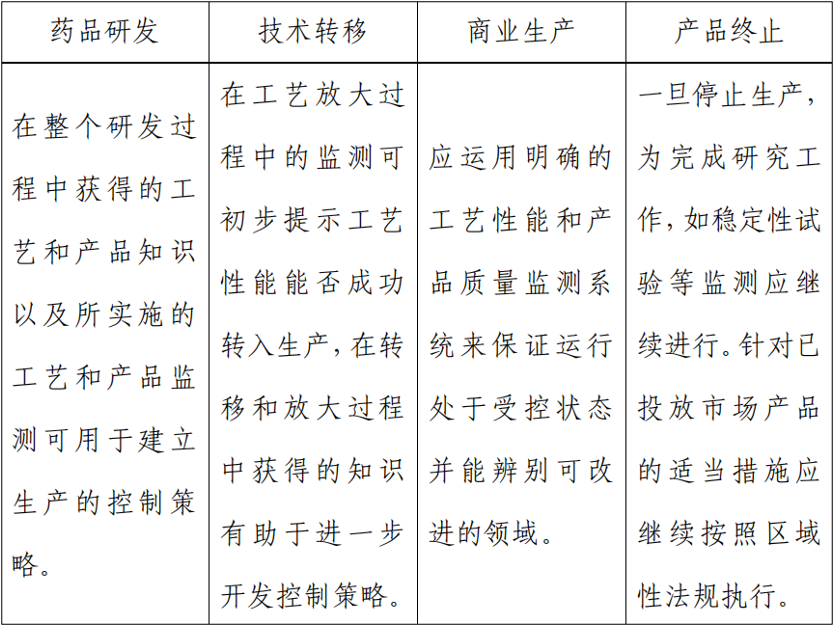
3.生产工艺开发-生命周期管理
原料药生产工艺的开发与改进通常持续在其整个生命周期。应该对生产工艺的执行情况,包括对控制策略的效果进行定期评估。从商业化生产中获得的知识可以用来进一步加深对工艺及其性能的理解,并对控制策略进行调整以确保原料药的质量。从其他产品或革新技术中获得的知识也有助于这些目标的完成。持续的改进和成功的工艺验证,或连续的工艺确认,需要适宜和有效的控制策略。
知识管理应该包括但不限于工艺开发活动、内部场地与协议生产商的技术转移活动、原料药生命周期的工艺验证研究、以及变更管理活动。应根据需要对知识和工艺理解进行分享,以在原料药生产所涉及的不同产地实施生产工艺和开展控制策略。如,在最初的申报资料中,申请人可以提交一个在产品的生命周期中如何对未来特定的变更进行管理的方案。
4.经典案例
对于原料药生产工艺的开发与控制,基于ICH指导原则,通过以下2个经典案例进行介绍与解释。
➣ 案例1:物料属性&工艺参数&关键质量属性的关联(设计空间开发)
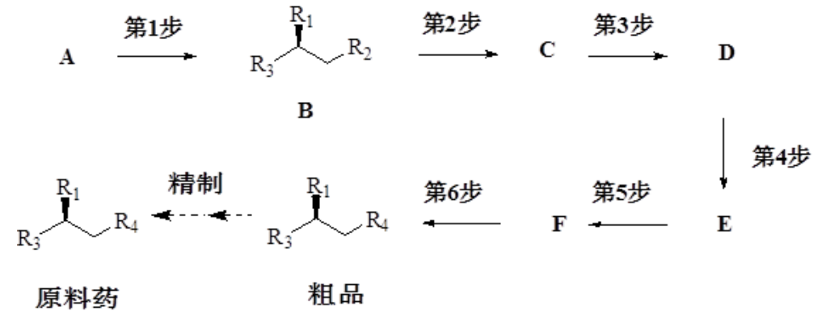
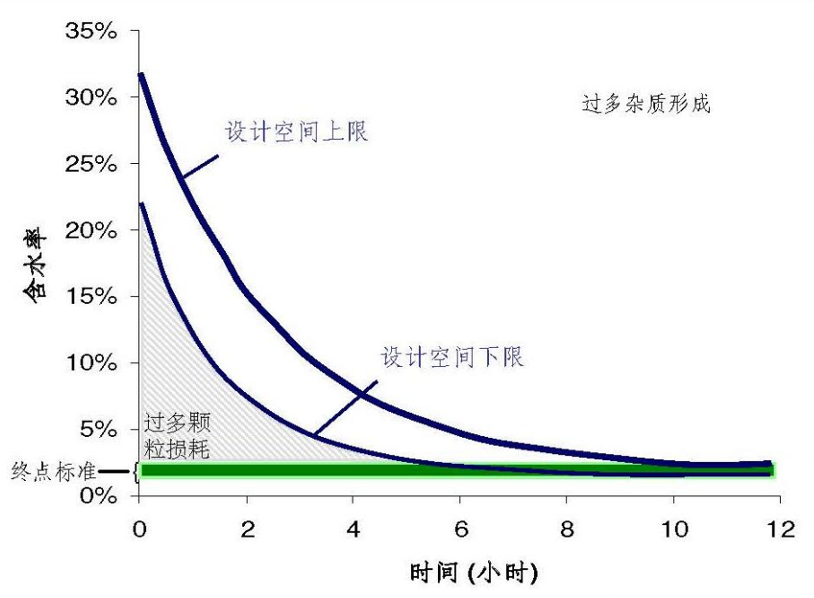
在第5步反应中间体F形成后,反应混合物加热至回流。在回流过程中,中间体F发生水解而形成1个杂质。简化案例~在该回流过程中,仅有中间体F发生了反应。下列假设被用于设计反应的过程:1)中间体F的浓度保持近乎恒定;2)温度保持恒定;3)中间体F中水解杂质的可接受限度为0.3%;4)回流混合物中的初始含水量取决于中间体E中的含水量,而中间体E中的含水量可以通过干燥来控制。
回流时间和水的浓度被确定为影响中间体F水解的最重要参数。基于之前的知识和风险评估,其他的潜在因素被认为是无关紧要的。该反应预期遵循二级动力学原理,其中[F]表示中间体F的浓度通过简单的实验研究可以归纳出下面的图示,其中可以将水解程度与时间和中间体E中的含水量联系起来:
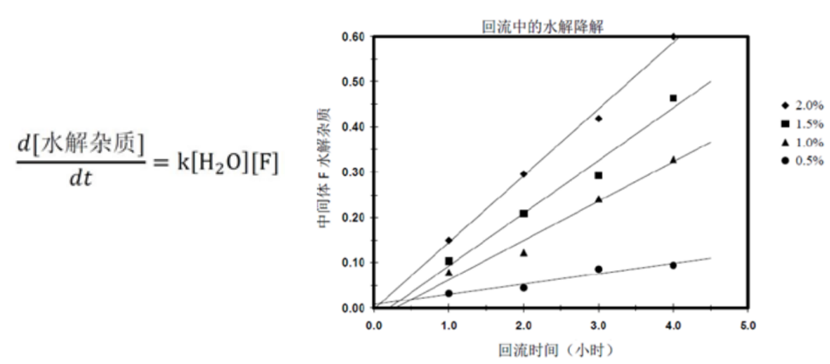
传统方法:典型的做法是设定一个目标值和最大值,例如:1)干燥中间体E,使之含水量最大值为1.0%;2)目标回流时间为1小时,最长回流时间为3小时。
增强方法:以下二级速率方程可以被积分和精确求解,时间(t)为变量对方程求解可以得到初始含水量和水解杂质目标水平的任意一种组合的最大允许回流时间(回流混合物中中间体F的初始浓度批与批之间基本保持不变)。下图中给出了为确保中间体F中水解杂质的量低于0.30%所需的不同条件组合。下图中曲线下的区域可以被建议为设计空间。
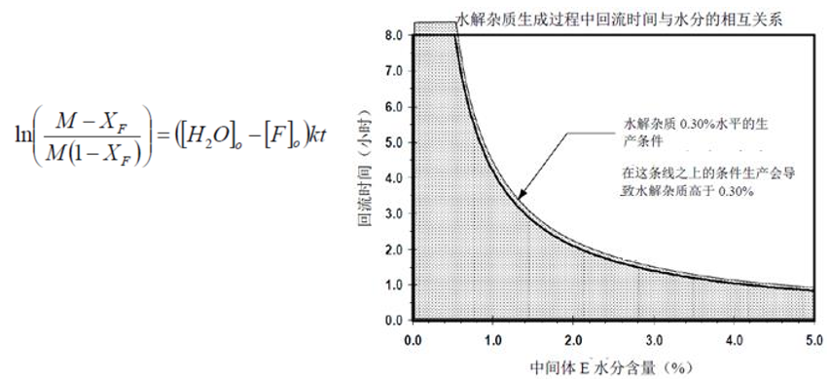
案例结果:尽管传统的方法和增强的方法都可以提供控制水解杂质形成所需的含水量和时间范围,然而增强的方法具有更好的生产灵活性。
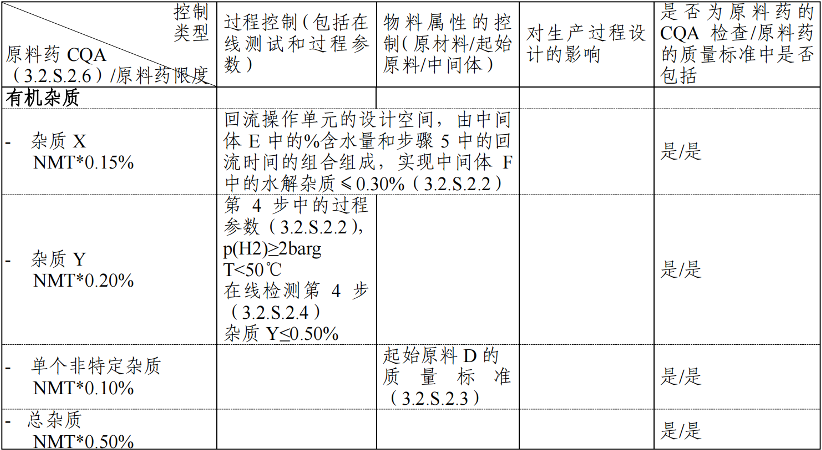
➣ 案例2:用于选择关键质量属性的控制因素的概述
本案例展示了原料药的部分控制策略是如何以列表的形式进行总结的。该表展示了申请人是如何在原料药控制策略的多重因素方面传递信息的,引导审评人员找到通用技术文档(CTD)的相关部分,在这些地方描述或论证了控制策略的详细因素。这样的控制策略总结表不应该包含基本原理和对控制的论证,仅应该简单的指出信息在上市申请申报资料的哪部分能够被找到。
有多种方式来递呈这个信息,两种如下所示。其中的一个表格在递呈信息的可能性范围方面比另一个表格给出的信息更为详细,用以演示可以有不同的表达方式来呈现这些信息。在控制策略总结表中所包含的细节的数量由申报人决定,而与原料药的类型无关。申报资料包含有质量标准制定依据(3.2.S.4.5)的部分是一个很好的位置来总结整体原料药控制策略。
5.阶段小结
上述,即为在ICH指导原则框架下,对生产工艺的内容要求与质量控制要求,其本质整体上仍是在QbD理念下的原料药生产工艺开发。虽然,QbD理念、增强型设计,在国内已被行业广泛接受,但实操中,更多的还是传统型的试验设计方案,以此来实现快速上市的阶段性目的。真正意义上基于科学的、理论充沛的、统计学范畴内的生产工艺开发,占比还是相对较少。不过,从长远来看,一条管线的长期布局,需要上述内容的多方位加持,从而实现科学、高效、经济、安全。所以,更多的、更有效的方法和工具需要被持续的应用与实施,以实现原料药生产方面的工艺特点。

参考资料
1.ICH Q3A - Q3D Impurities/杂质
2.ICH Q6A- Q6B Specifications/规格
3.ICH Q7 Good Manufacturing Practice/GMP
4.ICH Q8 Pharmaceutical Development/药物研发
5.ICH Q9 Quality Risk Management/质量风险管理
6.ICH Q10 Pharmaceutical Quality System/药物质量体系
7.ICH Q11 Development and Manufacture of Drug Substances/化学药品的研发与生产
8.ICH Q12 Techinical And Regulatory Considerations For Pharmaceutical Product Lifecycle Management药品生命周期管理的技术和监管考虑