挑战度拉糖肽!石药GLP-1-Fc融合蛋白TG103启动头对头降糖III期临床
2024年1月31日,clinicaltrials.gov网站显示,石药集团启动了GLP-1-Fc融合蛋白TG103(SYSA1803)对比度拉糖肽治疗2型糖尿病患者的头对头III期临床试验(SYSA1803-009),针对2型糖尿病成人患者。
TG103(SYSA1803)注射液是创新型长效重组人源胰高血糖素样肽-1(GLP-1)Fc融合蛋白,为胰高血糖素样肽-1受体(GLP-1R)激动剂。TG103具有两周注射1次的超长效潜能,优势明显,有望在糖尿病、减肥等领域造福广大病患。TG103注射液的取得可追溯至2018年12月,石药集团与生物新药研发公司天境生物达成战略合作。石药集团全资附属公司石药百克与天境生物科技(上海)订立协议,协议内容为天境生物开发的注射用长效重组GLP-1Fc融合蛋白(TG103)的授权及商业化。根据该协议,石药百克获得天境生物授出该产品的独家权利,在中国(不包括香港、澳门及台湾)进行该产品有关的所有适应症开发与商业化,而天境生物须提供必要的技术支援。同时石药百克将向天境生物支付1500万元首付款及根据该产品于该地区开发进度支付最多1.35亿元的开发里程碑付款。TG103于2023年8月第一次进入III期临床阶段,首发适应症为肥胖。除了已经推进至III期阶段的肥胖和2型糖尿病适应症,石药集团也正在探索将TG103用于治疗非酒精性脂肪性肝炎(NASH)和阿尔兹海默病的潜力。
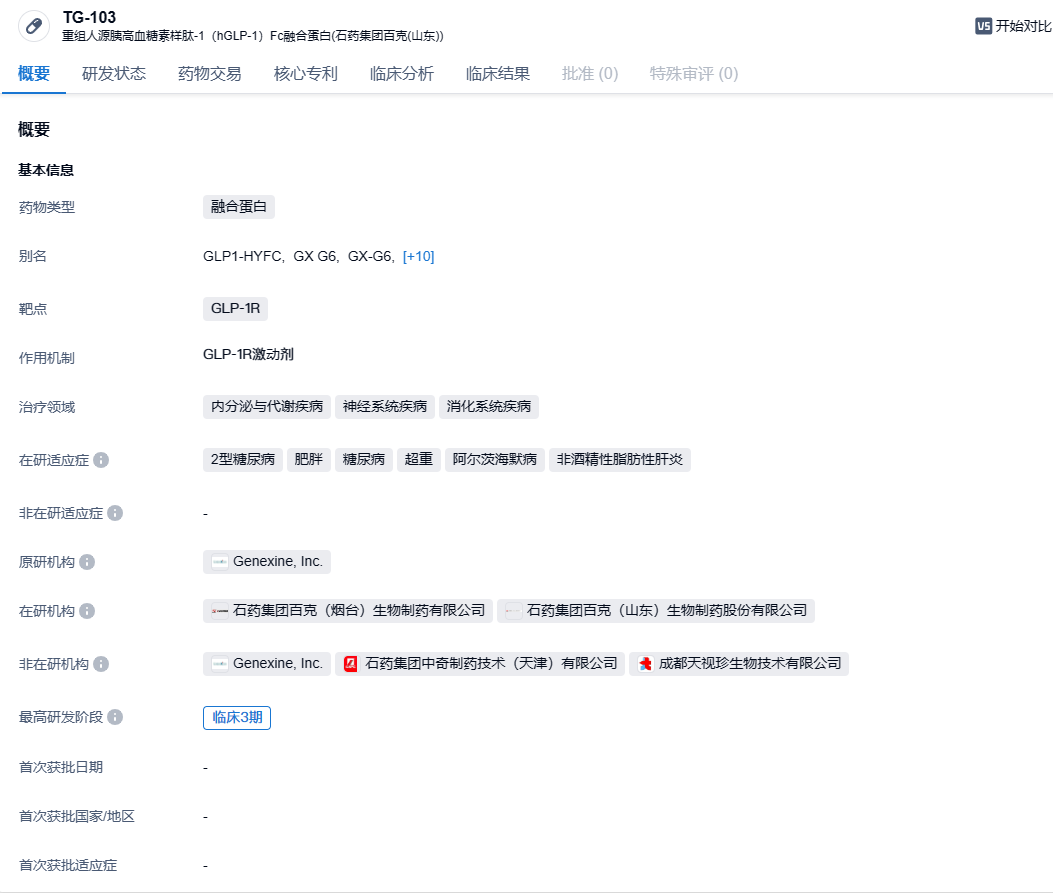
该研究是一项多中心、随机、开放标签、阳性药物对照临床试验,拟纳入618例接受二甲双胍单药治疗后血糖控制不佳的2型糖尿病成人患者,旨在对比TG103(7.5/15mg,每周1次,皮下注射)和度拉糖肽(每周1次,皮下注射)的疗效、安全性和免疫原性。研究的主要终点为第28周糖化血红蛋白(HbA1c)水平相比于基线的变化。
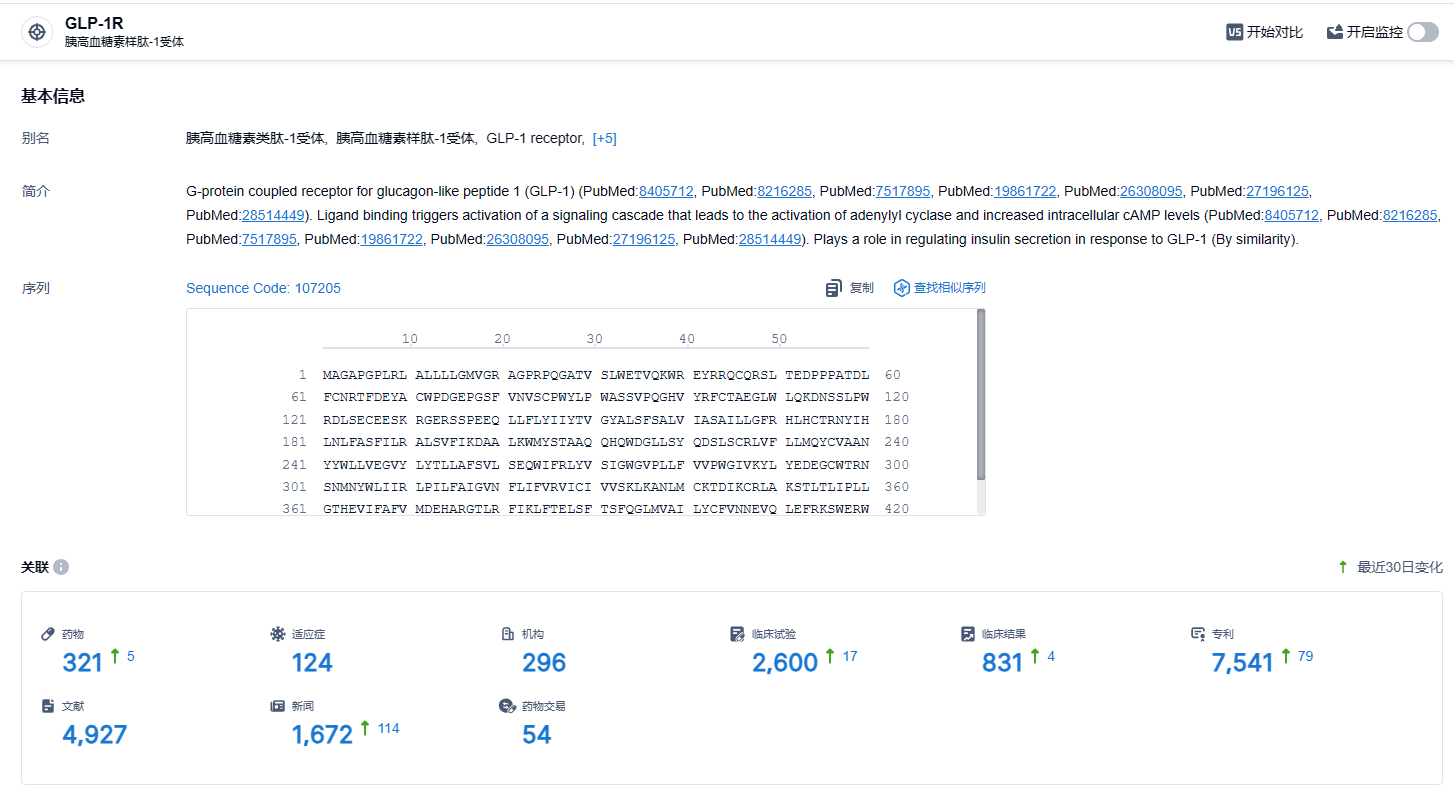
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年2月4日,GLP-1R靶点共有在研药物321个,包含的适应症有124种,在研机构296家,涉及相关的临床试验2600件,专利多达7541件……2023年8月,石药集团公告,其开发的GLP-1R激动剂司美格鲁肽注射液适应症为成人2型糖尿病患者的血糖控制已获国家药监局批准,可在中国开展临床试验。两款GLP-1R激动剂的管线布局有望帮助石药集团在GLP-1R赛道站稳脚跟,期待石药集团的未来表现。