预约演示
更新于:2025-05-07
HER2 x VEGFR2 x HER4 x EGFR T790M
更新于:2025-05-07
关联
1
项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的药物100 项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的临床结果
登录后查看更多信息
100 项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的转化医学
登录后查看更多信息
0 项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的专利(医药)
登录后查看更多信息
1
项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的文献(医药)2012-04-01·Molecular Cancer Therapeutics2区 · 医学
SKLB1206, a Novel Orally Available Multikinase Inhibitor Targeting EGFR Activating and T790M Mutants, ErbB2, ErbB4, and VEGFR2, Displays Potent Antitumor Activity Both In Vitro and In Vivo
2区 · 医学
Article
作者: Wang, Bing-Lin ; Ji, Pan ; Yu, Yang ; Yang, Jiao ; Zhang, Shuang ; Cao, Zhixing ; Chen, Xin ; Wang, Zerong ; Yang, Sheng-Yong ; Wang, Xiaoyan ; Pan, Youli ; Xu, Yong ; Yang, Han-Yu ; Feng, Shan ; Zheng, Renlin ; Wang, Lijiao ; Liu, Jingjing ; Zhong, Lei ; Wei, Yu-Quan ; Luo, Shidong
1
项与 HER2 x VEGFR2 x HER4 x EGFR T790M 相关的新闻(医药)2021-01-16
·药事纵横
肺癌是最常见的癌症之一,每年的新发和死亡病例都非常高,其中80%以上都是非小细胞肺癌。对于该病的治疗,传统放化疗仍在使用,但靶向治疗已经成为疾病管理的重要手段,免疫治疗的出现进一步改变了治疗格局。本文回顾和分析了最近的文献,讨论了肺癌的靶点通路和正在进行的肺癌临床试验。在将来,在了解患者肿瘤组织分子特征的基础上,结合靶向疗法、免疫疗法和化学疗法的治疗方式可能是最佳的治疗方式。
1. 引言
肺癌是世界上最致命、最常见的癌症之一。2018年,有170万人死于肺癌。基于细胞起源,大约80-85%的肺癌属于非小细胞肺癌。根据其组织学特征,非小细胞肺癌进一步分为肺腺癌,鳞状细胞癌和大细胞癌。随着基因组医学的出现,与传统化学疗法相比,肿瘤的精准医疗有助于改善患者的治疗效果和生活质量。近年来,有关信号通路的知识、可用于检测基因突变的技术以及抑制信号通路的药物等方面的进展,使医生们可以根据病人的情况调整治疗方案。
在肺癌中,已经确定了许多可靶向的通路,例如EGFR、PI3K/ AKT / mTOR,RAS–MAPK和NTRK/ ROS1通路。目前,已经开发出了许多针对这些信号通路的药物,并显示出临床疗效,其中一些药物已取代化疗药物,成为一线治疗药物,例如EGFR抑制剂厄洛替尼、吉非替尼;PI3K/ AKT / mTOR抑制剂依维莫司和NTRK/ ROS1抑制剂恩曲替尼。
虽然非小细胞肺癌的靶向治疗已经可以控制病情,但肿瘤不可避免地会产生耐药性。理解耐药机制和开发联合疗法对于改善治疗效果至关重要。目前,非小细胞肺癌的耐药机制已经确定,例如TK域突变(T790M)、MET扩增、RAS突变。其他靶向治疗药物正在临床开发中,并在耐药性肿瘤治疗方面显示出可喜的结果,例如可以激活并靶向EGFR敏感突变和T790M耐药性突变的第三代EGFR-TKI(奥希替尼)。
随着检查点抑制剂的出现,许多非小细胞肺癌患者对抗PD-1抗体纳武单抗和帕博利珠单抗等抗体有应答。此外,一些研究报道称,靶向疗法联用免疫疗法用于治疗非小细胞肺癌是有效的。
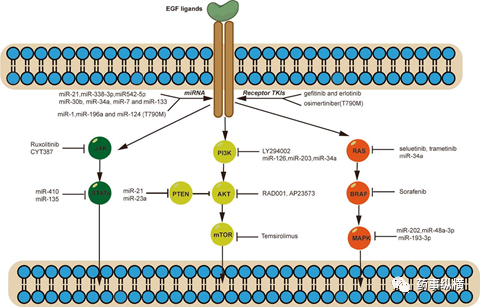
因此,本文将重点探讨非小细胞肺癌的重要通路,并讨论了针对这些肿瘤的新兴疗法(图.1)。
图1.肺癌中关键致癌信号通路的靶向治疗
2. 非小细胞肺癌的靶向通路
2.1 EGFR (表皮生长因子受体)通路
EGFR是I型酪氨酸激酶受体家族的成员,其基因位于人类7号染色体的短臂上。在EGFR中,有28个外显子形成一种蛋白质,该蛋白质分布在各种上皮细胞的细胞膜上,它与表皮生长因子或肝素结合型EGF结合并调节细胞的生长。
就非小细胞肺癌中的EGFR突变而言,外显子20号插入和外显子18位点突变不如19号外显子缺失和外显子21L858R错义替换常见。激活和调节EGFR及其下游基因可导致细胞增殖、凋亡和血管生成。已经开发出一些靶向EGFR治疗方法,例如酪氨酸激酶抑制剂(TKI),BRAF抑制剂。
在过去的几十年中,酪氨酸激酶抑制剂一直被认为是治疗非小细胞肺癌的有效药物,并已成为优秀的靶向药物。已经出现了多种靶向EGFR的药物,例如吉非替尼,厄洛替尼,西妥昔单抗和帕尼单抗。一些研究表明,与化疗作为一线治疗相比,两种第一代EGFR-TKI(吉非替尼和厄洛替尼)在PFS(无进展生存时间)方面具有明显的益处。不幸的是,晚期非小细胞肺癌患者的化疗后,EGFR-TKI治疗对OS的影响并不明显。一些研究表明,患者在接受第一代EGFR-TKI治疗后的10-14个月就产生了耐药性。目前已经确定了非小细胞肺癌的耐药机制,例如TK域突变(T790M),MET扩增,RAS突变。TK域突变(T790M)是非小细胞肺癌患者中最常见的获得性耐药突变。有一部分T790M突变的非小细胞肺癌患者从未接受过EGFR-TKI治疗。这些发现表明,T790M突变是非小细胞肺癌患者的潜在靶点。因此,需要开发新的治疗手段来克服耐药性。
近年来,奥希替尼已经成为第三代EGFR-TKI,可以激活并靶向敏感的和耐药(T790M)EGFR突变。在FLAURA研究中,用奥希替尼治疗的非小细胞肺癌患者的中位PFS(18.9个月)明显长于使用第一代EGFR-TKI(吉非替尼和厄洛替尼)的患者(10.2个月)。其中,携带EGFR外显子19缺失或L858R突变的非小细胞肺癌的患者,在未经治疗的情况下出现了疾病进展。另一项研究(AURA3)显示,与奥希替尼治疗相关的PFS为10.1个月,而与培美曲塞/铂双重化疗相关的PFS为4.4个月。奥希替尼组的客观缓解明显更高。
尽管奥希替尼在临床试验中显示生存益处令人欣喜,但仍然需要做出选择,即优化EGFRTKI的治疗顺序,进而实现临床受益最大化。奥希替尼,然后是第一代或第二代EGFR-TKI,或者是培美曲塞/铂族双重化疗可能是一个合理的选择。关于用药顺序的争论仍在继续,需要更多的临床试验来阐明EGFR突变阳性的非小细胞肺癌患者最合适的后续治疗。
不幸的是,一项研究表明奥希替尼的耐药性已经出现。在45例患者中,发现了EGFRC797S突变,PIK3CA、KRAS、BRAF中的突变和MET扩增突变。在EGFR突变的非小细胞肺癌中,5-20%EGFR-TKI耐药的患者发生MET扩增。MET扩增可增加非小细胞肺癌中HCC827细胞系的增殖和迁移。结果表明,针对MET扩增可以促进治疗效果。MET抑制剂(克唑替尼或SGX532)可以增加非小细胞肺癌对吉非替尼的敏感性。此外,KRAS是RAS突变的成员之一,已经确定其是非小细胞肺癌中最常见的致癌基因。之前的研究表明,KRAS突变是非小细胞肺癌EGFR-TKI耐药性的机制之一。因此,靶向KRAS突变的治疗策略可能会克服耐药性并提高治疗效果。已经筛选出一些KRAS抑制剂,例如KRASG12C突变蛋白在体外试验中显示出优异效果。因此,靶向EGFR通路的不同治疗策略显示出不同的治疗效果,这可以克服耐药性和癌症进展。
2.2 PI3K / AKT /mTOR通路
PI3K / AKT /mTOR通路被认为是非小细胞肺癌中的潜在靶点。PI3K信号通路调节各种细胞过程,包括细胞增殖、分化和凋亡以及基因转录和蛋白质合成。研究表明,PI3K/ AKT / mTOR通路可激活上游受体(EGFR和PDGFR)并在多种癌症(包括乳腺癌,胃癌和非小细胞肺癌)中发生突变。研究表明,大约4%的非小细胞肺癌肿瘤发生PIK3CA突变,表达PTEN蛋白,进而抑制PI3K/ AKT / mTOR通路。有几种方法试图靶向非小细胞肺癌中的PI3K/ AKT / mTOR通路。据报道,PI3K抑制剂(LY294002)可增强非小细胞肺癌对化疗和放疗的敏感性。此外,另一种mTOR抑制剂替西罗莫司(CCI-779),可以靶向PI3K通路下游的分子,在非小细胞肺癌的I期临床试验中显示出抗肿瘤活性,有望用于该疾病的治疗。另外一种PI3K/ AKT / mTOR抑制剂依维莫司(RAD001或AP23573)也在临床前研究中。研究表明,非小细胞肺癌中miR-93的下调会抑制细胞增殖和凋亡。已有研究显示,miRNA-223可通过靶向非小细胞肺癌中的EGFR/ AKT2通路抑制癌细胞。一些研究表明,PI3K / AKT /mTOR通路是EGFR-TKI耐药的重要因素。PTEN基因的蛋白产物在PI3K/ AKT / mTOR通路的下游起作用,已有研究证明在EGFR突变的非小细胞肺癌中,PTEN基因的缺失对厄洛替尼和吉非替尼耐药性起重要作用。此外,miRNA可以通过靶向PI3K/ AKT / mTOR通路来调节非小细胞肺癌的耐药性。有研究者证明miRNA‑328的过表达,通过PTEN赋予了A549细胞对顺铂的耐药性。有趣的是,miRNA‑328抑制剂增加了PTEN的表达,使非小细胞肺癌细胞恢复了对顺铂的敏感性。此外,另外一项实验中,miR-21在诱导非小细胞肺癌的吉非替尼耐药具有重要作用。通过抑制PTEN/ PI3K / AKT通路,剔除miR-21,可提高体内外肿瘤对吉非替尼的敏感性。已有研究证明了miR-23a可以作为在PC9非小细胞肺癌细胞系中PTEN抑制剂。miR-23a的下调逆转了厄洛替尼的耐药性。因此,miR-23a可能是克服非小细胞肺癌对EGFR-TKI耐药的潜在靶标。此外,有几种靶向PI3K/ AKT / mTOR通路的miRNA已显示出抗肿瘤作用和逆转EGFR-TKI耐药性的能力。已经证明,敲除miR-126,miR-203和miR-34a可以通过PI3K/ AKT信号传导调节耐药性。此外,miRNA可以调节非小细胞肺癌中PI3K/ AKT / mTOR通路的上游因子。已知C-MET基因参与了对EGFR-TKI的耐药性,并且在HCC827和PC-9细胞中被miR-34a靶向。miR-34a在非小细胞肺癌中成功抑制了EGFR / PI3K / AKT通路并逆转了吉非替尼耐药性。
2.3 RAS–MAPK通路
人类RAS基因家族(包括KRAS、NRAS和HRAS)编码细胞膜上的低分子量G蛋白(GTPase),这些蛋白通过不同的通路调节细胞的增殖和分化。一些上游膜受体与RAS基因家族有关,例如EGFR和FGFR。另外,一些下游通路(RAS–MAPK和PI3K–AKT–mTOR通路)通过RAS参与细胞分化和存活。
肺癌中,最为常见的RAS家族基因突变是KRAS突变。20-40%的肺腺癌中有KRAS突变。在西方国家,约占20%的肺腺癌拥有KRAS突变,在亚洲国家,这一比例约占10%。一些研究表明,KRAS突变可能是非小细胞肺癌靶向治疗中EGFR-TKI耐药性的原因。因此,各种药物试图通过靶向非小细胞肺癌中的RAS通路以克服耐药性。
多项临床试验将RAS通路的下游受体,包括RAF、MEK和mTOR,作为非小细胞肺癌的治疗靶点。索拉非尼是一种多激酶抑制剂口服药物,靶向RAF和其他受体(包括VEGFR-2、VEGFR-3和PDGFR-b)。在早期的临床试验中,索拉非尼显示出潜在疗效,耐受性良好,并在患者中具有良好的稳定性。但是,索拉非尼在临床研究中显示对非小细胞肺癌无效,客观缓解率(ORR)低于10%。此外,其他BRAF抑制剂在临床试验中也显示了相似的结果,在BRAF突变型患者中表现良好,但在KRAS突变型非小细胞肺癌中却表现不佳。对于MEK抑制剂,塞卢替尼的临床研究结果显示,在未经治疗的非小细胞肺癌中,塞卢替尼对基于培美曲塞的化疗没有益处。在联合多西他赛化疗的研究中,曲美替尼也有类似的结果。缺乏有效性的原因可能是因为目前的Raf抑制剂只识别一个结合位点,从而降低了对其他位点的亲和力。
因此,迫切需要一种治疗方法或新的靶向药物来解决RAS突变患者的这些问题。目前,已经开发出来一些基因方法用于发现非小细胞肺癌的潜在靶点。有研究者试图联用siKRAS、miR-34a和顺铂来靶向非小细胞肺癌中KRAS/P53的突变。他们的结果表明,miRNA和化疗的联合使用增强了肿瘤细胞系的毒性,提高了治疗效果,延长了小鼠的生存时间。其他研究表明miR-202通过靶向Ras/MAPK通路增强顺铂对非小细胞肺癌的抗肿瘤作用。在他们的研究中,miR-202的表达水平提高可以增强NCI-H441和A549非小细胞肺癌细胞对顺铂的敏感性。此外,miR-202的过表达可以通过靶向KRas基因进而抑制Ras/MAPK通路。在其他miRNA中也观察到类似的现象,包括miRNA-48a-3p和miR-193a-3p。也有研究人员发现miR-148a-3p通过Ras/MAPK/Erk信号通路降低SOS(一种信号分子抗体)的表达,从而抑制非小细胞肺癌的进展。此外,在NSCLS肿瘤组织中,miR-193a-3p表达降低,可以抑制细胞增殖和进展。此外,miR-193a-3p的表达与KRASmRNA相关,提示miR-193a-3p可能通过靶向KRAS在非小细胞肺癌中发挥抑瘤作用。
2.4 JAK-STAT通路
信号传导与转录活化因子(STAT)蛋白是一个由7种不同蛋白的蛋白家族(STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6和STAT7),它们通过激活不同的蛋白质来动员Janus激酶(JAK)。JAK–STAT通路存在各种实体瘤中并被激活,这也包括非小细胞肺癌。IAK–STAT通路在细胞分化、增殖和癌症进展中起重要作用。
STAT3是研究最多的STAT家族成员,被发现在各种类型的恶性肿瘤中发挥作用。此外,在肺癌中,STAT通路调节凋亡基因,抑制细胞生长,提高EGFR-TKI的治疗效果。有报道表明,EGFR-TKI或化疗药物与JAK/STAT通路抑制剂用可增强非小细胞肺癌的抗肿瘤效果,降低耐药性。有研究者在非小细胞肺癌细胞系和异种移植瘤模型中,研究了JAK/STAT通路抑制剂在顺铂耐药中的作用。作者证明,在顺铂耐药的肿瘤模型中,JAK2抑制剂(鲁索替尼)通过抑制肿瘤生长和诱导caspase-3表达来抑制顺铂耐药的H1299细胞的生长并增强抗肿瘤活性。然而,需要进一步研究JAK2抑制剂联合治疗的有效性和安全性。
此外,有研究者研究了JAK-2抑制剂(CYT387)和西妥昔单抗联用于非小细胞肺癌体内外模型的抗肿瘤效果。当西妥昔单抗与CYT387连用时,在耐药细胞系(H1975和H1650)中的细胞毒性增加。此外,在耐药模型中,JAK/STAT通路抑制剂与西妥昔单抗联合使用可提高抗肿瘤活性。因此,JAK-STAT通路抑制剂可以用于非小细胞肺癌的单独治疗,或与EGFR-TKI联合用药。
有研究者研究了细胞因子信号转导抑制因子3(SOCS3)和miR-410在非小细胞肺癌中调节增殖的作用。SOCS3可以负调节JAK–STAT通路。与正常组织相比,其在非小细胞肺癌组织中降低。他们发现,在抗miR-410和SOCS3处理后的肺癌细胞,STAT3磷酸化显著降低。这些结果表明miR-410可以调节JAK/STAT通路,因此是非小细胞肺癌患者潜在的治疗靶点。然而,仍然需要进一步的疗效研究和临床试验,来探索这种可能性。
另一项研究探讨了miR-135在非小细胞肺癌细胞中的潜在作用。作者发现miR-135在非小细胞肺癌细胞中的表达增加,并且抑制miR-135可以抑制细胞的增殖、侵袭和迁移。随后的一项研究发现,抑制miR-135,可以通过JAK/STAT通路上调TRIM16的表达,从而增强非小细胞肺癌细胞系对吉非替尼的敏感性。
其他研究试图将JAK/STAT抑制剂与基因治疗或免疫疗法联用,以增强抗肿瘤活性。有研究者使用JAK/STAT抑制剂(鲁索替尼)和水泡性口炎病毒(VSV)联合治疗肺癌。在体外和体内的研究表明,在耐药型或敏感型非小细胞肺癌细胞中,鲁索替尼都能增强病毒疗法的治疗效果。此外,联合治疗还增强了肺癌患者PD-L1的表达和肿瘤免疫浸润水平。这些结果为非小细胞肺癌的治疗提供了一种新方法,但JAK/STAT抑制剂与病毒疗法或免疫疗法联合应用的尚需进一步临床评价。
2.5 HER3
在过去的二十年里,HER3在癌症生物学中扮演着越来越重要的角色。HER3(也称为ERBB3)是其家族中一个独特的成员,被认为是一个非活性受体。EGFR和HER4都有几个配体,而HER3只有一个配体,称为调蛋白(HRG)或神经调节蛋白(NRG)。当配体与EGFR或HER3/4的胞外区结合时,受体相互作用可导致二聚。二聚化是HER受体激活下游信号通路的首要关键步骤,如JAK/STAT、MEK/MAPK和PI3K/AKT通路等。为了防止二聚,EGFR、HER3和HER4通常以分子折叠单体的形式存在(非活性状态)。与HER的其他家族成员(EGFR、HER2和HER4)不同,HER3受体几乎没有酪氨酸激酶活性。HER3的过表达会增加各种癌症转移的可能性,促进肿瘤进展,进而导致治疗失败。研究发现,在非小细胞肺癌中高度激活的HER3,伴随携带EGFR突变的体细胞。HER3可能通过与突变的EGFR结合而被反式磷酸化和激活,并介导PI3K/AKT通路。因此,EGFR-TKI可以通过抑制HER3/PI3K/AKT信号通路的激活,在EGFR突变的非小细胞肺癌中实现有效的抗肿瘤活性。即使在EGFR-TKI治疗的过程中,HER3也可以通过与扩增的MET癌基因结合而被激活,这可以永久激活PI3K/AKT通路。因此,由于HER3的这些特性及其在细胞存活信号通路中的活性,它可能成为EGFR突变非小细胞肺癌的一个有希望的治疗靶点。
HER3在非小细胞肺癌对EGFR-TKI的耐药中起重要作用。研究表明,导致EGFR-TKI治疗耐药的一个重要机制可能是HER3的代偿性上调,并伴随持续的PI3K/AKT信号传导。因为HER3缺乏激酶活性,采用阻断抗体靶向HER3成为癌症治疗的临床前研究中的一种潜在策略。一些I期临床研究,正在评估针对HER3的单克隆抗体,如帕曲妥单抗,Lumretuzumab, SAR256212及LJM716。结果显示这些药物作为单一疗法或联合疗法的安全性可接受。
U3-1287(更名为帕曲妥单抗)是第一个完全人源化的抗HER3抗体。它的疗效已经在一些晚期实体瘤患者的临床试验中得到检验。目前正在进行非小细胞肺癌治疗的研究。帕曲妥单抗在体外和体内均能克服非小细胞肺癌对EGFR-TKI的HRG依赖性耐药。这些数据进一步支持了正在进行的临床试验,这些试验探索帕曲妥单抗联合EGFR-TKI(如厄洛替尼)治疗HRG高表达的非小细胞肺癌患者。然而,研究发现,对于治疗后EGFR-TKI耐药的患者,帕曲妥单抗联用厄洛替尼的抗肿瘤活性有限。帕曲妥单抗与厄洛替尼联合应用的一期临床试验结果显示,日本晚期非小细胞肺癌患者经治疗后,总缓解率为4.2%,疾病控制率62.5%。同样,帕曲妥单抗联合厄洛替尼治疗EGFR野生型局部晚期或转移性非小细胞肺癌患者的III期研究也被终止,这些患者至少接受过一次系统治疗。因此,EGFR突变的非小细胞肺癌治疗尝试另外的HER3靶向治疗。
U3-1402是一种新的HER3靶向抗体偶联药物(ADC),具有全人源HER3靶向抗体、新的可剪切肽基连接体和拓扑异构酶I抑制剂药物。目前正在进行一项针对非小细胞肺癌患者应用U3-1402治疗的I期试验。在现有的一项研究中,首次报道U3-1402是治疗EGFR突变型非小细胞肺癌的有效方法。一项正在进行的多中心I期剂量递增和扩大研究中,正在评估U3-1402在转移性或不可切除的EGFR突变的非小细胞肺癌患者中的安全性/耐受性和初步活性。这些患者在经厄洛替尼、格列替尼或阿法替尼治疗时,出现疾病进展并呈现T790M阴性;或无论T790M状态如何,在服用奥希替尼期间出现疾病进展。在13例可评估的病例中,除1例患者外,所有患者的SLD均降低,2例患者证实了部分缓解。U3-1402在EGFR-TKI耐药的非小细胞肺癌中显示出初步的抗肿瘤活性和可控的安全性。
3. 不断进展的肺癌临床研究
分子机制分析显示转移性非小细胞肺癌患者存在可靶向的驱动突变。基于分子特征,转移性非小细胞肺癌患者的治疗策略发生了重大转变。酪氨酸激酶抑制剂(TKI)在癌基因依赖的肺癌患者的靶向治疗中,是一个具有代表性的成功案例。除了这些靶向治疗外,免疫检查点抑制剂(ICI)用于治疗转移性非小细胞肺癌,显著改变了晚期患者的预后。合适的治疗方案也需要通过临床试验来证实。
3.1 EGFR/ALK TKI
在所有NSCLS患者中,约10-20%的非东亚裔患者中观察到EGFR突变,而40%的亚洲患者中观察到EGFR突变。EGFR基因突变主要发生在腺癌、年轻女性和女孩以及从不吸烟者中。虽然在吸烟的肺癌病例中很少发现,但这些患者的肺癌恶性程度相比于不吸烟患者更高。
第一代可逆性抗EGFR酪氨酸激酶抑制剂厄洛替尼和吉非替尼最初被批准作为化疗后晚期患者的二线治疗。多项临床试验证实,一些化疗后的患者应用这些药物具有疗效。而如今,这些药物被推荐为EGFR突变型晚期肺癌患者的一线治疗。
第二代TKI是EGFR突变阳性非小细胞肺癌的一线治疗。LUXLung 7研究比较阿法替尼和吉非替尼在未接受过治疗的EGFR突变阳性非小细胞肺癌患者中的疗效与安全性。结果显示PFS改善(HR=0.73,95%可信区间:0.57–0.95,p=0.017)。阿法替尼和吉非替尼组患者的中位PFS值分别为11.0月和10.9月。然而,EGFR-TKI相关的3-4级毒性,包括皮疹、腹泻和口腔炎,阿法替尼比吉非替尼更常见。不可逆的第二代TKI是为了克服这些耐药肿瘤的复制而开发的,但是相关的临床试验结果显示,第二代TKI并没有提高T790M突变患者的总生存率(OS)。
在鳞状细胞肺癌中,EGFR突变很少见。对于晚期鳞状细胞肺癌,LUXlung 8 III期随机对照试验(N=795)报道阿法替尼与厄洛替尼作为二线治疗的对比研究。阿法替尼可以改善PFS(2.6vs.1.9月,HR=0.81,p=0.0103)和OS(7.9vs. 6.8月,HR=0.81,p=0.0077)。FDA和EMA已经批准晚期鳞状细胞肺癌患者一线化疗后使用阿法替尼。
超过60%的患者会对第一代或第二代TKI产生耐药性。EGFRT790M突变是获得性抗EGFR-TKI的共同机制。第三代TKI在靶向T790M的同时,保留了靶向外显子19DEL和L858R突变的活性(图.2)。奥希替尼(AZD9291)是一种第三代酪氨酸激酶抑制剂,因其靶向EGFRT790M突变而获得FDA的加速批准。奥希替尼首次获得FDA批准的适应症是用于转移性EGFR-T790M突变的非小细胞肺癌患者,并且这些患者在应用第一代和或第二代EGFRTKI后出现疾病进展。但随后,奥希替尼获得批为EGFR突变肺癌的一线治疗。其他第三代抑制剂正处于不同的开发阶段,尽管具有抗肿瘤疗效,但尚未证明其优于奥希替尼。
在治疗过程中,也检测到其他EGFR突变。在其他通路中也观察到耐药机制,如EGFR扩增、肝细胞生长因子(HGF)过度表达、FGF2-FGFR1环路突变、MET扩增、PIK3CA突变(E545K和E542K)、PTEN缺失、KRAS突变、NRAS突变、BRAF突变、MAPK1/AKT3过度表达、HER2扩增,IGF1R激活、融合事件和RB1/p53丢失,这些突变伴随着肿瘤向小细胞癌的组织学转变。
图2.EGFR突变肺癌在治疗过程的克隆进化历程
间变性淋巴瘤激酶(ALK)基因重排发生在约5%的非小细胞肺癌患者中,通常不依赖于EGFR和KRAS突变,具有脑转移的高风险。三种碱性酪氨酸激酶抑制剂(TKI),包括克唑替尼、色瑞替尼和阿来替尼,已被FDA批准用于治疗ALK重排的非小细胞肺癌患者。克唑替尼是第一种ALK抑制剂,通过多种机制获得对克唑替尼的耐药性是不可避免的。开发了第二代(色瑞替尼,阿来替尼,布加替尼)和第三代(劳拉替尼)ALK抑制剂.阿来替尼是第二代ALK抑制剂具有很高的入脑效率,在治疗脑转移瘤方面具有很好的疗效。在携带ALK重排突变的患者中,使用克唑替尼和其他ALK抑制剂治疗后,可能会出现多种ALK耐药突变。为了优化治疗效果,ALK抑制剂与其他靶向药物的联合治疗、ALK抑制剂与免疫治疗的联合,是进一步的临床前和临床研究的方向。
3.2 检查点抑制剂
免疫治疗改变了癌症患者的治疗格局。免疫检测点目前包括程序性死亡细胞-1(PD-1)、程序性细胞死亡配体-1(PD-L1)和细胞毒T淋巴细胞相关抗原-4(CTLA-4)。以这些免疫检查点为靶点的治疗方案,已在包括非小细胞肺癌在内的多种肿瘤中获得批准。在2015年,CheckMate017试验首次将抗PD-1/PD-L1的抗体用于治疗转移性非小细胞肺癌。随后,帕博利珠单抗和阿替利珠单抗也获得FDA的批准,用于非小细胞肺癌患者的治疗。CheckMate032的临床试验结果显示,纳武单抗和纳武单抗/伊匹单抗对于治疗复发性小细胞癌的响应率令人印象深刻。然而,免疫治疗仅对一小部分癌症患者有效,这可能是由于肿瘤免疫微环境的复杂性。必须寻求PD-1/PD-L1之外的其他免疫检查点和其他疗法,以便更多患者从免疫检查点疗法中获益。
其他免疫检查点抑制剂治疗肺癌的若干临床试验正在进行中,并针对不同的靶点,例如针对淋巴细胞活化基因-3(LAG-3)、T细胞免疫球蛋白和含粘蛋白蛋白3(TIM-3)、T细胞活化的V域Ig抑制物(VISTA)、人内源性逆转录病毒H长末端重复序列相关的治疗试验蛋白2(HHLA2)、T细胞免疫球蛋白和免疫受体酪氨酸基抑制基序结构域(TIGIT)。
3.3 联合治疗策略
如上所述,免疫检查点的临床益处有限且不令人满意,单药治疗的总有效率(ORR)约为10–20%。目前,为了克服这一限制的尝试包括,开发预测性生物标记物和将免疫检查点抑制剂引入联合疗法中。为了提高免疫检查点抑制剂的疗效,目前正在开展许多与之相关的联合治疗的临床试验。(图3)
图3.肿瘤免疫联用疗法临床试验的全球分布图
3.3.1检查点抑制剂联合化疗
对于那些缺乏驱动基因突变和高PD-L1表达的患者,以铂为基础的化疗仍然是标准治疗。化疗的效果是适度的。化疗可诱导肿瘤细胞表达PD-L1,进而促进免疫细胞浸润。免疫检查点抑制剂疗法,利用免疫系统,在与化疗联用的情况下显示出治疗前景。
kEYNOTE-189试验报告了一项帕博利珠单抗联合化疗的双盲III期研究结果。这项研究显示帕博利珠单抗组的疗效有显著改善:中位PFS:8.8月vs. 4.9月(HR,0.52;95%CI,0.43-0.64);OS:69.2% vs. 49.4% (12个月)(HR,0.49;95%CI,0.38-0.64)。无论年龄、性别、疾病状态、吸烟情况、脑转移、PD-L1表达和所用铂的种类,所有应用联合用药的亚组患者都显示出生存率获益,尽管毒性轻微增加。双盲、III期临床试验KEYNOTE-407研究针对未经治疗的转移性鳞状非小细胞肺癌患者,其结果也有类似的发现。标准化疗联合免疫检查点抑制剂可能是晚期非小细胞肺癌一线治疗的新策略。
3.3.2 检查点抑制剂联合放疗
有证据表明,放射治疗(RT)结合免疫治疗不仅能影响局部肿瘤微环境,而且能改善全身疾病的控制。放疗引起肿瘤相关抗原的释放,并诱导一些危险信号的释放,如HMGB1、ATP和HSP90。有一些临床试验探索PD-1/PD-L1抗体与放疗联合治疗非小细胞肺癌。在KEYNOTE‐001的I期临床中,在使用帕博利珠单抗的患者中,先前接受放疗的患者的PFS显著长于未接受放疗的患者。但作为一项I期试验,帕博利珠单抗的给药剂量和给药方式不同。RTOG3505的临床1/2/3期以及后续的研究已经释放了一些研究结果。局部晚期非小细胞肺癌患者在放疗后使用纳武单抗或者安慰剂的试验结果,包括OS、PFS和毒性正在评价中。
3.3.3 免疫检查点和EGFRTKI联用策略。
接受EGFR-TKI治疗的患者最终会产生获得性耐药性。据报道,在小鼠模型中,EGFR通路的激活增强了肺癌对PD-1抗体的敏感性,提示PD-1抗体与EGFR-TKI联合应用可能是一种很有前景的治疗策略。作为CheckMate012研究的一部分,纳武单抗联合厄洛替尼在19%的患者中表现出3级毒性。在治疗前或未接受化疗的非小细胞肺癌患者中,联合应用奥希替尼和Durvalumab(Ib期TATTON试验(NCT02143466))显示出令人鼓舞的临床活性;然而,这种联合用药的副作用发生率较高,奥希替尼组发生腹泻(53%等级≥3级)和联合用药组发生皮疹(67%)。联合用药组观察到与治疗相关的3-4级不良事件。鉴于EGFR-TKI联合免疫治疗相关治疗毒性的发生率相对较高,EGFR-TKI联合免疫治疗应需要进一步研究。
3.3.4 检查点抑制剂(抗PD-L1/PD-1)与抗CTLA-4的联用。结合检查点抑制剂和其他免疫调节剂的策略是很有前景的治疗方法。PD-1抗体与CTLA-4抗体的联用治疗正在探索NSCLS的一线和二线治疗。CheckMate012试验评估了纳武单抗联合伊匹单抗作为晚期非小细胞肺癌患者一线治疗的安全性和有效性。在这些患者(n=77)中,每12周接受一次伊匹单抗治疗的患者中,37%(14名患者)出现3-4级治疗相关的不良事件。经过12.8个月的随访,ORR值分别为47%和38%。随访2年后,这两个队列的汇总结果显示,无论EGFR状态、吸烟状态或组织学,包括肿瘤的PD-L1表达≥1%和50%的在内的所有患者,纳武单抗联合伊匹单抗治疗后,可观察到持续的临床益处。PD-L1/PD-1抗体的不同组合联用治疗非小细胞肺癌的临床试验正在进行中。这些联合疗法很有前途。
4. 非小细胞肺癌靶向治疗进展
随着靶向治疗的发展,化疗已不再是晚期和转移性非小细胞肺癌患者最重要的治疗手段。化疗在治疗过程中,不能将肿瘤细胞与正常细胞区分开来,治疗相关的不良反应也极为强烈,因此受到患者的担忧。分子靶向治疗具有较少的不良反应,延长了疾病控制时间,并最终改善了非小细胞肺癌患者的长期生存结果。
4.1一线治疗
4.1.1 EGFR TKI用作一线治疗
EGFR基因敏感型突变是21世纪肺癌临床研究中最重要的发现。EGFR基因是目前研究最多的肺癌分子靶点之一,EGFR靶向治疗已应用于晚期非小细胞肺癌的各个阶段。
日本研究人员首次对16例EGFR基因敏感性突变的患者使用了吉非替尼,有效率为75%。这开启了EGFR基因敏感性突变患者靶向治疗的三期临床研究时代。几项重要的临床试,IPASS、NEJGSG、WJTOG3405、First-SIGNAL、OPTIMAL,EURTAC和LUX-Lung 3的研究结果显示,对于携带EGFR基因敏感突变的患者,TKI的治疗获益比传统一线铂化疗更高。对于EGFR突变的非小细胞肺癌患者,EGFRTKI治疗在PFS、生活质量和耐受性方面具有显著优势,从而确立了EGFRTKI在晚期EGFR突变非小细胞肺癌患者一线治疗中的地位。
奥希替尼是第三代不可逆EGFR-TKI,可同时选择性抑制EGFR-TKI敏感型和EGFR-T790M耐药突变。EGFR-T790M突变是获得性EGFR耐药最常见的机制;然而,在1-8%的非小细胞肺癌患者中,这两个等位基因也存在相同的突变,这可能意味着预后较差。由于AURA临床试验释放阳性结果,奥希替尼已被批准用于治疗EGFR-TKI治疗后出现疾病进展的T790M阳性非小细胞肺癌。在一项三期临床中(FLAURA),比较了在未经治疗的EGFR突变非小细胞肺癌患者的使用吉非替尼和厄洛替尼或奥希替尼的治疗效果。556名患者按1:1的比例接受奥希替尼或标准EGFR-TKI治疗。2018年1月,结果显示与标准EGFR-TKI相比,奥希替尼的疗效更为显著,且与标准EGFR-TKI治疗相比,奥希替尼的中位无进展生存期显著延长(18.9 月vs.10.2月)。NCCN肿瘤学临床实践指南建议奥希替尼用于晚期或转移性EGFR突变的非小细胞肺癌患者(IA)的一线治疗。2018年4月,FDA批准奥希替尼作为转移性EGFR突变非小细胞肺癌患者的一线治疗。FLAURA试验明确表明,奥希替尼作为晚期EGFR突变非小细胞肺癌患者的一线治疗,是有效性、耐受性良好的系统疗法。尽管EGFR-TKI具有强大的一线疗效,但仍需进一步研究,以确定哪种EGFR-TKI用药序列最终能提供最长的疾病控制时间、最长的总生存期和最佳的生活质量。此外,随着对第三代EGFR抑制剂在应对获得性耐药方面的进一步深入研究,奥希替尼在治疗策略中的地位可能会继续发展。
EGFR-TKI可使患者获得更高的生存率,但目前,单一疗法的疗效已达到瓶颈。靶向治疗结合抗血管生成药物可以改善肿瘤微环境,是一种较好的治疗方案。在一项II期试验(BELIEF)中,对先前未经治疗的患者评价了厄洛替尼和贝伐单抗的联合治疗。T790M阳性亚组的中位无进展生存期为16个月。在日本进行了一项II期研究(JO25567),比较了厄洛替尼单用或与贝伐单抗联用作为晚期EGFR突变非小细胞肺癌患者的一线治疗的疗效。本研究发现,联合治疗的PFS比单用厄洛替尼治疗的PFS更长(HR=0.54,p=0.0015)。随后的一项III期临床研究(NEJ026)中,比较了未经治疗的EGFR突变非小细胞肺癌患者中单用厄洛替尼与厄洛替尼联用贝伐单抗的疗效。结果显示PFS中位数分别为13.3个月和16.9个月(HR=0.605,p=0.016)。因此,贝伐单抗与厄洛替尼联用已成为治疗EGFR突变非小细胞肺癌的新标准疗法。
4.1.2 PD-1靶向免疫治疗作为一线治疗
非小细胞肺癌中有驱动基因突变的患者比例并不高。西方人群中,它只占30%左右。中国人群中腺癌的比例高于西方人群,但仍有约40%的患者没有驱动基因突变。以铂为基础的双重化疗方案仍然是治疗复发性或转移性非小细胞肺癌的基石,这些患者没有EGFR突变或ALK易位。
人免疫检查点抑制剂(ICI)抗体能抑制PD-1受体或PD-L1,提高抗肿瘤免疫。PD-1/PD-L1信号通路在非小细胞肺癌中起重要作用。从未接受治疗的晚期非小细胞肺癌患者获得的肺肿瘤组织样本显示约30%的患者PD-L1表达水平较高(TPS≥50%)。,
一项III期研究(KEYNOTE-024)比较了帕博利珠单抗单药治疗与标准铂类化疗对未经治疗的晚期非小细胞肺癌患者(≥18岁)的疗效。305名患者随机分为两组(帕博利珠单抗,n=154;化疗,n=151)。帕博利珠单抗组的中位OS为30.0个月(95%CI,18.3月至未死亡),化疗组为14.2个月(95%CI,9.8-19.0个月)。与化疗组相比,帕博利珠单抗组的3-5级治疗相关不良事件更少(31.2%vs. 53.3%)。由于已证实PD-1抑制具有良好的获益风险比例,FDA和EMA已批准帕博利珠单抗单药治疗PD-L1TPS(肿瘤细胞阳性比例分数)≥50%,且无EGFR或ALK突变的转移性非小细胞肺癌患者的一线治疗。
阻断免疫检查点在癌症治疗中显示出巨大的潜力,并且与传统的晚期非小细胞肺癌治疗方法相比显示出显著的疗效。然而,并非所有患者都能从这些药物中获益。同样重要的是,对抗PD-1/PD-L1免疫治疗产生耐药性可导致晚期非小细胞肺癌患者的失败和预后不良。耐药性的机制还不完全清楚。此外,对于与在PD-1和PD-L1治疗疗效及耐药性相关的肿瘤中PD-L1阳性的阳性水平、潜在的抗原负荷或突变负荷以及遗传定子的作用知之甚少。
4.2 后续治疗
“后续治疗”一词最近已被二线系统治疗、三线系统治疗及其他术语所取代。一线治疗期间或之后疾病进展的患者的后续治疗主要取决于特定的基因改变和组织学亚型。
大多数接受第一代或第二代EGFRTKI初始治疗的患者在10-12个月内出现耐药性和疾病进展。因此,第三代EGFRTKI,如奥希替尼和Rociletinib,可以选择性地靶向T790M突变,可以用于这些患者的二线治疗。奥希替尼的临床试验包括AURAI期、AURA扩展期、AURA2和AURA3研究。这些研究支持其在一代或二代EGFR-TKI治疗后出现疾病进展且T790M阳性晚期非小细胞肺癌患者中的疗效。
纳武单抗是首个被批准用于非小细胞肺癌二线治疗的免疫检查点抑制剂(ICI)。一项II期试验(CheckMate-063)评估了纳武单抗治疗晚期非小细胞肺癌的有效性和安全性。ORR为14.5%,中位OS为8.2月,1年生存率40.8%。另外两个三期临床试验(CheckMate-017和CheckMate-057)对于推荐非小细胞肺癌患者采用免疫治疗的起决定性作用。这些研究证实了纳武单抗在二线治疗中的有效性。,
一项大型随机Ⅱb/III期试验(KeyNote-010)纳入1034名已接受过治疗的晚期非小细胞肺癌患者,这些患者的肿瘤细胞至少有1%表达PD-L1。与多西他赛相比,帕博利珠单抗显著延长OS。这项试验的最新结果显示,未经治疗、先前接受过治疗的病人的36个月的生存率分别为26.4%(95%CI, 14.3-40.1月)和19.0%(15.0–23.4月)。阿替利珠单抗是一种抗PD-L1的人源化IgG1单克隆抗体。POPLAR研究的目的在于比较阿替利珠单抗和多西他赛的疗效。结果显示中位OS是12.6vs. 9.7个月(HR 0.73,95%CI 0.53–0.99;p=0.04)。3年OS率为分别为18.7%和10.0%。此外,OAK研究是一项III期试验,纳入1225名已接受过治疗的非小细胞肺癌患者,这些患者随机接受阿替利珠单抗或多西他赛治疗。中位数为13.8vs. 9.6个月(HR 0.73,95%CI0.62–0.87;p=0.0003)。
4.3维持疗法
维持治疗通常用于减缓晚期癌症在初始治疗后的生长。它包括两种情况:同药维持和换药维持。同药维持选择一种或多种用于一线治疗的药物。换药维持,也称为早期二线,在一线化疗后使用额外的药物。紫杉醇是第一个被研究为维持治疗的化疗药物。
基于随机、多中心、安慰剂对照III期SATURN试验的结果,厄洛替尼被用于局部晚期或转移性非小细胞肺癌患者的维持治疗。在这项研究中,大约2000名患者在铂类化疗后被随机分为安慰剂组和维持组。中位随访11个月后,厄洛替尼在PFS方面显示出统计学上的显著优势,但非常轻微(3.0vs 2.8月)。此外,EGFR突变的腺癌患者的预后获益最大。
INFORM研究证实,接受EGFR-TKI维持治疗或后续治疗的患者比从未接受EGFR-TKI治疗的患者有更长的OS。INFORM试验的阳性结果表明,对于EGFR突变的晚期非小细胞肺癌患者来说,在维持治疗的情况下使用吉非替尼可显著改善预后。
与此相反,一项随机、双盲、III期试验(IUNO)表明,在没有EGFR激活突变的晚期非小细胞肺癌患者中,厄洛替尼维持治疗与二线治疗没有观察到OS益处。基于分层因素、人口统计学或基线特征的OS亚组分析结果与总体人群分析结果一致。由于在试验中未观察到益处,厄洛替尼维持治疗在无EGFR突变的晚期或转移性非小细胞肺癌患者的治疗上不再优先考虑。维持治疗的适应证也在被修正。厄洛替尼维持治疗只应考虑用于局部晚期或转移性EGFR突变的非小细胞肺癌患者。
对于非鳞状非小细胞肺癌患者,若是EGFR突变状态阴性或未知、ROS1重排、ALK重排或PD-L1表达低于50%可选择贝伐单抗或培美曲塞作为维持治疗。一项随机临床研究(ECOG4599)纳入878例复发或晚期非小细胞肺癌患者,比较化疗与化疗加贝伐单抗的疗效。中位生存率为10.3vs. 12.3个月(死亡风险比为0.79;p=0.003)。两组中位无进展生存率为4.5vs. 6.2月(疾病进展风险比为0.66,P<0.001)。POINTBREAK研究比较了贝伐单抗联用培美曲塞与贝伐单抗单用的疗效,联用对PFS有非常轻微的改善(6.0vs 5.6个月)。类似的,AVAPERL研究中,贝伐单抗联用培美曲塞与贝伐单抗单用作为维持治疗,PFS增加(7.4vs. 3.7个月)。一项III期试验(ATLAS)评估了非小细胞肺癌患者在接受贝伐单抗联合化疗的一线治疗后,使用贝伐单抗联用厄洛替尼或单用的疗效。结果显示,在贝伐单抗联用厄洛替尼显著改善PFS(4.8vs. 3.7个月),但是OS没有改善(14.4vs. 13.3个月)。厄洛替尼联合贝伐单抗对生存率的轻微影响,但毒性的增加,这表明这两种药物维持方案不会成为一种新的标准治疗方案。
综上所述,维持治疗是晚期非小细胞肺癌患者除一线化疗外的一种新的治疗选择,无其他明显副作用,无明显并发症,预后良好。应进一步考虑其对患者生活质量和经济方面的影响。需要确定可用于预测的因子,用于选择可能受益于维持治疗的患者。
4.4 辅助治疗
4.4.1 早期非小细胞肺癌的靶向治疗。
近三分之一的非小细胞肺癌患者有可能在早期治愈。以顺铂为基础的辅助双重化疗已被证明能提高I-III期非小细胞肺癌患者的总生存率。一项名为肺辅助铂化疗评价(LACE)的荟萃分析,全面认识了辅助化疗的益处。LACE荟萃分析纳入4584名患者,中位随访时间为5.2年。结果证实,通过5年的观察,辅助化疗的总生存率(OS)获益为5.4%(HR=0.89,95%CI=0.82-0.96)。另一项荟萃分析也证实了辅助化疗在早期NSCLS中治疗中的益处。
为了评估靶向药物在辅助治疗中的作用,一些临床试验正在进行中。RADIANT研究旨在评估厄洛替尼用于非小细胞肺癌切除患者辅助治疗的疗效。结果显示,厄洛替尼辅助治疗有利于无并生存(HR=0.61,CI0.38-0.91,P=0.039)。然而,根据统计设计,这种差异并不显著。RADIANT试验的结果支持,根据患者生物标志物状态确定进一步的辅助治疗的必要性。然而,最近的一项现状分析显示,在EGFR突变的患者中,厄洛替尼辅助治疗对无病生存没有益处,HR为0.75(95%CI0.48–1.16)。在单臂II期试验(SELECT)中,在IA-IIIA期EGFR突变的非小细胞肺癌患者术后给予厄洛替尼辅助治疗2年。在24例复发患者中,只有2例在厄洛替尼治疗期间复发。2年无病生存率为90%,高于预期的72%。作者评论说,疾病复发患者的治疗时间明显缩短。因此,较长时间的靶向辅助治疗可能对术后患者有利。由于这是一项单臂研究,在解释结果时需要谨慎。最近,一项III期试验(CTONG1104)被报道。在这项研究中,被切除的II–IIIA期EGFR突变非小细胞肺癌患者被随机分为两组,一组接受2年的吉非替尼的治疗,另一组接受4个周期的长春瑞滨联合顺铂治疗。中位随访36.5个月后,与长春瑞滨联用顺铂组相比,吉非替尼组的中位无病生存期显著延长(28.7月vs. 18月,HR 0.6,95%CI 0.42~0.87,P=0.005)。在第3年,与长春瑞滨联合顺铂治疗组相比,使用吉非替尼治疗组的无病生存率显著提高(34%vs.27%,P=0.013)。由于数据还不完整,OS结果还没有报道。
总之,现有数据表明,使用EGFR-TKI辅助治疗可以改善PFS,但这一优势尚未转化为延长OS。这一发现的原因可能是EGFRTKI不能消除肿瘤微转移。
4.4.2 正在进行的重要试验
ALCHEMIST试验也被称为辅助性肺癌富集标记物鉴定和测序试验,由国家癌症研究所(NCI)赞助。为了鉴别和筛选早期切除的非鳞状细胞癌中EGFR和ALK突变,该研究采用伞形设计。(图4) 截至2018年8月,共有309名患者参与筛选试验。ALCHEMIST试验将回答靶向治疗能否成为非小细胞肺癌有效治疗的一部分,并将提供更多的肿瘤样本用于基因组分析,这可能是一个提高对疾病生物学认识的机会。
图4.ALCHEMIST的伞状试验设计
4.4.3辅助和新辅助免疫治疗
靶向PD-1/PD-L1的检查点抑制剂,如帕博利珠单抗、纳武单抗和阿替利珠单抗,已经完全改变了晚期或转移性肺癌的治疗格局。鉴于其在晚期或转移性疾病中良好的治疗前景,这些药物正被考虑作为早期非小细胞肺癌的辅助治疗。
ALCHEMIST-nivo(EA5142;NCT02595944)研究是ALCHEMIST试验的一个分支,在这项研究中,没有EGFR或ALK突变的患者将被随机分配到纳武单抗辅助治疗组或者是观察组,时间长达1年。一项全球III期随机试验(IMpower010,NCT02486718)正在进行,针对切除的IB-IIIA期非小细胞肺癌后应用辅助性顺铂化疗的患者,应用阿替利珠单抗与最佳支持性治疗在疗效和安全性上的比较。另一项III期研究(PACIFIC)将针对不能切除的III期非小细胞肺癌患者,在其化疗放疗辅助治疗后,比较PD-L1抑制剂durvalumab与安慰剂的疗效。PACIFIC试验的中期分析报告PFS中位数为16.8vs.5.6个月(安慰剂),HR为0.52(95%CI 0.42–0. 65例,p<0.001)。这项研究结果为检查点抑制剂作为非小细胞肺癌切除患者的辅助治疗提供了希望。
一项II期、开放标签、单臂研究(NCT02927301)旨在确认阿替利珠单抗作为新辅助和辅助治疗的有效性和安全性,其在IB-IIIA期非小细胞肺癌治疗性切除前使用。另一项II期新辅助试验(NCT02259621)招募了IB-IIIA期非小细胞肺癌患者,以评估纳武单抗在手术前使用的疗效。2017年ASCO上公布的初步结果显示,在21名计划切除肿瘤的患者中,1名患者无法切除,9名患者(43%,95%可信区间24–63%)出现主要病理反应(切除标本中存活的肿瘤细胞<10%)。最近,作者报道有18名患者(86%)仍然存活,无复发,术后中位随访9个月。一项III期试验(CheckMate816,NCT02998528)旨在比较纳武单抗和伊匹单抗联用新辅助疗法或化疗和纳武单抗联用新辅助疗法与标准新辅助化疗对IB-IIIA期非小细胞肺癌患者的疗效。这些试验将明确检查点抑制剂作为可切除非小细胞肺癌患者的新辅助或辅助治疗的作用。
5. 结论和未来展望
总之,靶向治疗和免疫治疗改变了非小细胞肺癌的治疗方式。利用分子和免疫学的方法和理论,诊断肺癌已经取得了很大的进展。除了表皮生长因子受体(EGFR)外,新的分子靶点也在不断被发现,如microRNA、HER3和免疫检查点抑制剂等,这促进了新疗法的发展。许多靶向治疗和免疫治疗药物的临床试验正在进行中,迄今已显示出令人振奋的结果。这些试验将有助于明确靶向治疗在肺癌治疗中的角色,包括免疫单一疗法、联合免疫疗法、靶向治疗与免疫疗法的联用,以及应用这些疗法的理想时机,或是否应用于早期和晚期疾病。靶向治疗可能最终改变肺癌的治疗模式,为治疗手段有限的患者带来希望。寻找靶向药物应答的预测因子仍然是临床研究的一个重要课题。在将来,联合治疗(靶向治疗或免疫治疗)加上对分子生物标志物的更为深入的认识,可能将形成最终的治疗方案。
本文来源:
Yuan M , Huang L L , Chen J H , et al. The emerging treatment landscape of targeted therapy in non-small-cell lung cancer[J]. Signal Transduction and Targeted Therapy, 2019.
本文由药事纵横投稿作者翻译,翻译此文仅为学习交流,如无意中冒犯到版权,请联系药事纵横编辑删除
药事纵横投稿须知:稿费已上调,欢迎投稿
药事纵横是一个开放,由自愿者组成的团体,由以下成员组成:Voyager88,雷道安,Herman,梅希,文竹,duke,子炎,ZMJ和曾文亮。欢迎有志之士加入我们团队。投稿、合作、加专业群请加微信437180999,药事纵横二千人QQ群22711855
免疫疗法抗体放射疗法抗体药物偶联物基因疗法
分析
对领域进行一次全面的分析。
登录
或

Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
