|
|
|
|
|
非在研适应症- |
最高研发阶段临床2期 |
首次获批国家/地区- |
首次获批日期- |
靶点- |
作用机制- |
|
|
|
非在研适应症- |
最高研发阶段临床阶段不明 |
首次获批国家/地区- |
首次获批日期- |
|
|
|
|
|
非在研适应症- |
最高研发阶段临床阶段不明 |
首次获批国家/地区- |
首次获批日期- |
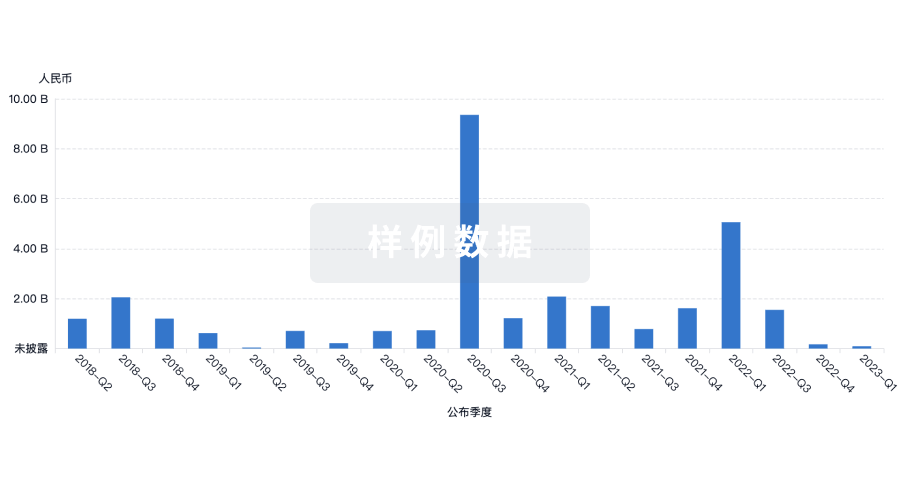
100 项与 上海荣瑞医药科技有限公司 相关的临床结果
0 项与 上海荣瑞医药科技有限公司 相关的专利(医药)
十多年前,最早在中国寻找创新药的HUYA(沪亚)发现:在中国根本找不到像样的、能够买的产品,在2007年时,他们苦心经营多年只做了西达本胺一个项目。当时,诸如默沙东等一些大药企也组建了团队,但也很难找到像样的标的。当时做新药投资的资本也几乎没有。
十多年后的今天,中国生物科技新药研发已经走到了寒武纪大爆发的时刻,各种各样的物种在不断地演化、摸索和生长,无论是基于临床的需求还是行业转型升级的需要,创新技术百花齐放的过程中,资本都起到了不可小觑的推动作用。
流向创新的资本究竟如何让项目绽放?
01 新资本,新生态
2005年夏天,一批由来自硅谷的知名风险投资人组成的旅行团造访中国,被认为是中国VC/PE行业的分水岭。彼时,在风口上的互联网行业,无论新秀还是老将都是如鱼得水。与此同时,中国生物科技市场基本上处于“无风”的状态。
西南证券研发中心的一组数据显示,2005年我国内地生物技术产业资本市场融资额不足5亿元,2006年的融资额甚至不到2005年的一半。
投资机构也并不多。红杉中国几乎是最早开始医疗健康专业投资的机构之一,也才刚刚进入该领域投资。与此同时(2006年),启明创投成立,这家医疗领域的明星机构孵化了甘李药业等多个成功案例。两年后,经纬中国刚成立便在医疗健康领域投下第一笔,与此同时,礼来亚洲基金开始从礼来制药的风险投资部门孵化出来。
对应地,沪亚也发现当时在业内几乎找不到像样的项目。E药经理人调研时,大多数药企创始人那个时期的回忆中做创新药的公司只有:微芯药业及和黄医药两家公司。
直至2011年,创新药投资才真正开始。这一时期也诞生了一批创新药企,并成为了现今的生物新贵,诸如百济神州、信达生物、君实生物等等。医疗健康投资真正进入高潮期,与中国药审改革以及医药产业发展轨迹同步,在2015年之后迎来爆发,并越来越专业。
与此同时,创新药也走出了陡峭的增长曲线,中国自主创新的新药申报和批准数量正持续增加。据官方披露,2017年~2019年CDE分别受理1类创新药注册申请402件、448件、528件,申请总量连续3年保持高速增长态势,其中1类创新药上市注册申请品种数连续3年达到或超过10个(10个、25个、16个)。
资本对医药行业转型升级的推动作用是显而易见的。五年前,港股前四名是国药控股、中国生物制药、石药集团和复星医药;五年后,港股前四名早已更迭。不过,当年的前四除了国药控股市值有所下降外,其余三家都有增长,他们的共性是都在努力转型创新研发。
如果从整个医药产业的结构来看,资本正助推着整个医药行业固有生态的改变。五年前,香港中药、化药两块大约占整体市值的60%,但今天只剩20%;过去连零头都够不到的CXO、生物药以及互联网医疗如今已经占了整个市值的70%。
02 新机遇,新模式
几乎所有投资人都认为整个生命科学的时代已经到了,他们惯用 “寒武纪大爆发”来形容生物科技面临的机遇。
在生物医药新技术发展日新月异的时代,无论是小分子、大分子还是细胞治疗,还是基因疗法等等都有很好的进展。这些生物医药技术都在为医药研发带来一些革命性的变化。
过去几年间,小分子方向首次突破了“不可成药”靶点KRAS,PROTAC(靶向蛋白降解)克服耐药性的同时被寄厚望将“不可成药”的靶点变成“可成药”靶点;大分子领域,单抗逐渐进入成熟期,双抗和ADC双双爆发;细胞疗法、基因疗法成果显现;RNA药物“王者归来”……
技术百花齐放的背后离不开的是资本支持。但在多重因素之下,中国创新药创制走向了畸形发展(同质化),新药红利成为少数人(热门靶点、热门方向)的狂欢,真正的源头创新反而面临着融资难的局面。Cytiva联合金融时报发布的2020全球生物制药弹性指数也显示,67%的中国生物科技企业的首要任务仍然是融资,44%的企业在为资金发愁。
深耕中国的Cytiva,深知中国生物医药创新生态来之不易,秉承着为创新服务的初心,搭建起创业者和投资人之间的桥梁。2021年6月,Cytiva携手E药经理人在上海重磅启动了“Think Big 2.0笃行思远双选平台”项目,接受企业、投资方和园区的报名,持续赋能行业创新,助力中国创新走出国门。
Think Big项目并不是简单的路演,而是从项目征集,专业筛选,全面培训,媒体传播到路演对接的360度创新赋能合作模式。“我们参加Think Big平台项目后,感受到组织方花了非常多的时间和精力。除了组织很多线上线下研讨会外,还邀请了很多投资人来了解我们的项目,辅导我们如何融资、专利申请、法务布局等一系列创业过程中可能会遇到的问题。”主流生物副总裁李风翔回忆道。这是一家领先的拥有PDC技术平台的初创公司,去年入选了Think Big十佳项目。
无独有偶,另一位Think Big的十佳项目入选者上海荣瑞医药对Cytiva也是好评连连,该公司CEO周国庆表示,早在多年前便与Cytiva(原GE医疗生命科学部)结识,有多年的合作,包括试剂、耗材和设备。“加入Think Big平台后,合作变得更加紧密,他们的客户服务也更多、更快了。Think Big平台也为我们增加了很多与投资人交流的机会,让我们的项目得到更多的曝光,并带来合作机会。”
2021年,Think Big 2.0项目在去年的基础上重磅升级,报名项目将有机会与经纬中国、红杉中国、君联资本等150+投资方零距离接触互动,10+产业园区的落地对接。通过苏州、杭州、上海等多场分站路演选出的项目,将被邀请参加封闭式集训融资专业课程辅导,从政策、资本、演讲技巧等多方1V1辅导项目优化,助力其达成融资,并有机会获得产业知名媒体曝光。
“Think Big 2.0笃行思远双选平台”将在各落地环节中,融入导师团等组织机制,增加交互场景和频率,促进创业者与投资人互动更紧密交流更深入,帮助具领先性和投资价值的优秀项目快速成长。
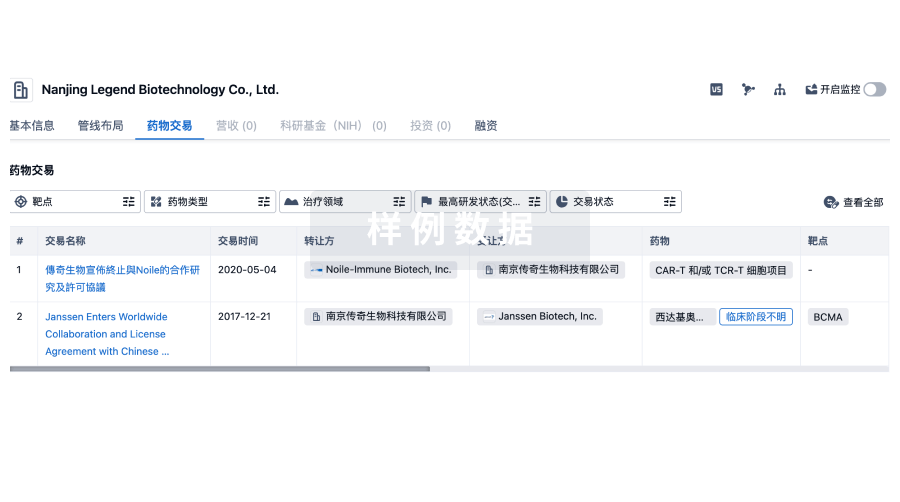
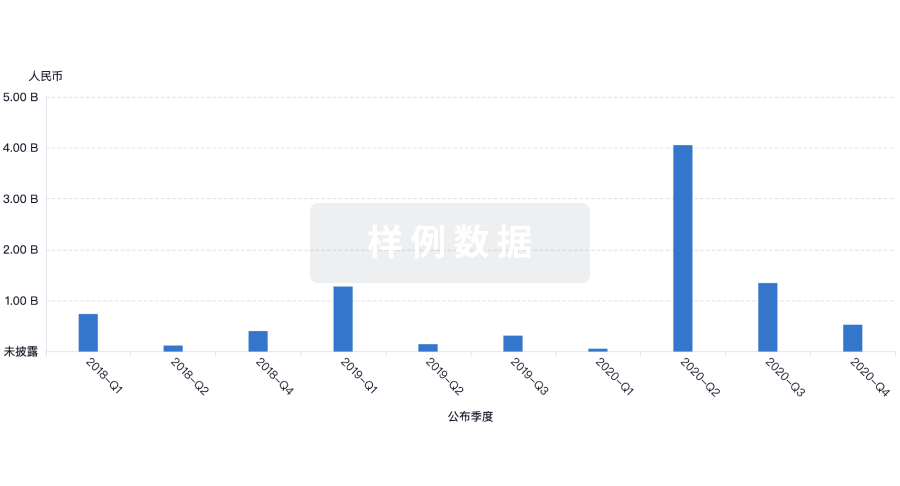
100 项与 上海荣瑞医药科技有限公司 相关的药物交易
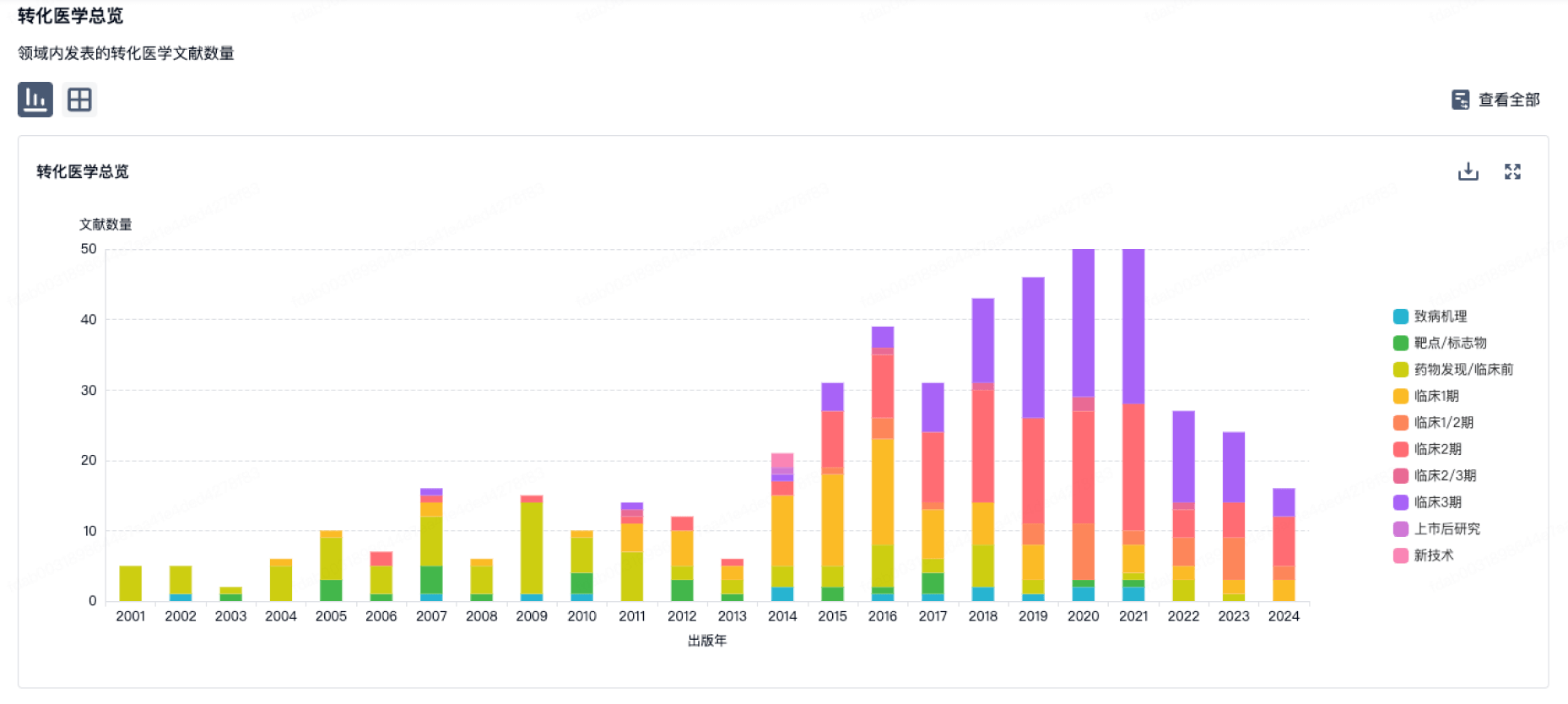
100 项与 上海荣瑞医药科技有限公司 相关的转化医学