预约演示
更新于:2025-06-06

Reyoung (suzhou) Biology Science & Technology Co., Ltd.
更新于:2025-06-06
概览
标签
感染
生物药
关联
1
项与 瑞阳(苏州)生物科技有限公司 相关的药物靶点- |
作用机制- |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床3期 |
首次获批国家/地区- |
首次获批日期- |
4
项与 瑞阳(苏州)生物科技有限公司 相关的临床试验CTR20232147
一项在中国健康早产儿和足月儿中评价RB0026注射液的安全性、耐受性、药代动力学特征和初步有效性的多中心、随机、双盲、安慰剂对照、剂量探索Ⅰb/Ⅱ期试验
Ib期:
主要目的:
1.评价单次肌肉注射RB0026注射液的安全性和耐受性。
次要目的:
1.评价单次肌肉注射RB0026注射液的药代动力学PK特征;
2.评价单次肌肉注射RB0026注射液的药效动力学PD特征;
3.评价单次肌肉注射RB0026注射液的免疫原性。
II期:
主要目的:
1.在正在进入期第一个RSV流行季的婴儿人群中,评价RB0026注射液给药后150天内降低RSV引起的需医学干预的LRTI发生率。
次要目的:
1.评价RB0026注射液给药后150天内降低RSV所致住院发生率;
2.评价单次肌肉注射RB0026注射液后的安全性和耐受性;
3.评价单次肌肉注射RB0026注射液后的PK特征;
4.评价单次肌肉注射RB0026注射液后的PD特征;
5.评价单次肌肉注射RB0026注射液后的免疫原性。
探索性目的:
1.通过基因型和表型分析来描述对RB0026注射液的耐药特征;
评价给药后151-360天内RB0026注射液降低RSV引起的需医学干预的LRTI发生率。
开始日期2023-07-19 |
申办/合作机构 |
CTR20221325
一项评价RB0026注射液在中国健康成人中的安全性、耐受性、药代和药效动力学的随机、双盲、安慰剂对照、单次给药剂量递增I期临床试验
主要目的: 评估健康受试者肌肉注射或静脉滴注RB0026注射液后的耐受性和安全性;
次要目的: 研究健康受试者肌肉注射或静脉滴注RB0026注射液后的药代动力学; 研究健康受试者肌肉注射或静脉滴注RB0026注射液后的RSV中和活性(药效研究); 评价RB0026的免疫原性。
开始日期2022-06-20 |
申办/合作机构 |
CTR20202500
RB0004 注射液用于标准治疗无效或无标准治疗的实体瘤的安全性、耐
受性和药代动力学特征的开放、单次/多次给药I 期临床试验
(1)确定最大耐受剂量(MTD)和/或确定RB0004 注射液的后续研究推荐剂量; (2)评价RB0004 注射液在实体瘤患者中的安全性和耐受性。
开始日期2021-03-18 |
申办/合作机构 |
100 项与 瑞阳(苏州)生物科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 瑞阳(苏州)生物科技有限公司 相关的专利(医药)
登录后查看更多信息
11
项与 瑞阳(苏州)生物科技有限公司 相关的新闻(医药)2025-01-28
·药事纵横
▲3月6-7日长三角新药创新者峰会扫码免费报名
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
新药内循环大交易,产业互动
药融圈获悉:近期,康哲药业与湖南麦济生物技术股份有限公司(“麦济生物”)及其附属公司就1类新药抗IL-4Rα人源化单抗注射液MG-K10(“MG-K10”或“产品”)签订合作协议,获得产品在中国大陆、香港特别行政区、澳门特别行政区、台湾地区及新加坡(“区域”)的协议所约定之共同开发权及独家商业化权利;麦济生物配合商业化活动,并销售、供应产品。合作期限为永久。
IL-4Rα被认为是治疗2型炎症性疾病(如特应性皮炎(AD)、哮喘、结节性痒疹等)的关键靶点,抗IL-4Rα单抗则是目前2型炎症性疾病领域最畅销的生物制剂之一。双方合作产品MG-K10是一种创新的长效抗IL-4Rα人源化单抗,能同时阻断关键2型炎症因子IL-4和IL-13的信号传导,其Fc突变可有效延长半衰期,降低给药频率,有望成为国内首个上市的长效抗IL-4Rα单抗。目前已上市的抗IL-4Rα药物均需要每2周给药一次,而MG-K10只需每4周给药一次,同时呈现良好的疗效和安全性,具有成为同类最优(BIC)的潜力。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
1类新药抗IL-4Rα人源化单抗注射液MG-K10用于治疗2型炎症性疾病,如AD、哮喘、结节性痒疹、过敏性鼻炎、慢性鼻窦炎伴鼻息肉、嗜酸性粒细胞性食管炎、慢性阻塞性肺疾病等,在区域内特定国家/地区拥有物质专利。
麦济生物其他靶点在研
MG-K10的AD、哮喘和结节性痒疹均已进入中国III期临床试验阶段。在已经完成的成人中重度AD的II期临床试验以及成人中重度哮喘的II期临床试验中,MG-K10均呈现良好的疗效和安全性。此外,产品已获得嗜酸性粒细胞性食管炎、慢性鼻窦炎伴鼻息肉、季节性过敏性鼻炎的中国新药临床试验(IND)批件。
IL-4R靶点
IL-4R靶点中第一个获批的产品Dupixent(Dupilumab注射液)由再生元(Regeneron)和赛诺菲开发的一款全人单克隆抗体,其针对IL-4Rα上同时结合IL-4及IL-13的亚基,因此能够同时阻断IL-4及IL-13的信号传导。2024财年该靶点新药预计破130亿欧元业绩。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据 显示:其他在做的本靶点企业还有:荃信生物、智翔金泰、洛启生物(单域纳米抗体)、康诺亚(已经获批上市)、南京融捷康生物(单域抗体)、康方生物(AK120)、康乃德、三生国健(公司研发代号:611)、绿叶制药/博安生物(TS0001)、恒瑞医药(SHR1819)、科济生物(融合蛋白)、北京凯因科技、瑞阳生物等等,欢迎补充多靶点研究企业。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.mabge.com/;
https://www.mabge.com/index.php?c=show&id=18;
Mao, Dandan et al. Prevalence and risk factors of atopic dermatitis in Chinese adults: a nationwide population-based cross-sectional study. Chinese medical journal vol. 136,5 604-606. 5 Mar. 2023, DOI:10.1097/CM9.0000000000002560;
https://mp.weixin.qq.com/s/dkIpUgOkNgIDNtqgfK93Pw;等等。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐。更多药企信息交流可后台留下名片。
临床2期临床申请临床结果
2024-12-17
·循因缉药
「 ADC2025 背景介绍 」
2025年2月 · 苏州
2025年2月18-19日,由触界生物主办的第六届ADC药物开发大会(简称ADC2025)将定于苏州举办,旨在为中国及国际优秀ADC企业搭建展示最新技术及研究成果的学术交流平台,促进国际技术交流、商务合作的线下机会,推动ADC药物快速临床转化服务于患者。
ADC专题峰会是触界生物品牌峰会之一,往届口碑反响较高,ADC2025组委会再次欢迎产业界同仁共聚苏州参与讨论ADC2025之后的新发展问题与解决方案共识。大会支持业务宣讲、研发进展发布、展台布展、各类广告等深度合作。火热招商阶段,期待您的加入!
主办单位
触界生物
会议时间
2025年2月18-19日
会议地点
中国·苏州
会议规模
2000+
会议咨询丨Wilson
联系方式丨18662147488
主论坛:携手并进,破局ADC药物市场蓝海
(2025年2月18日上午09:00-12:00)
ADC 进入大整合发展时代,除了被国际大厂 MNC 关注,国内的买方及新模式尚需挖掘。国际化开发大背景下,无论是产品还是BD 策略都需要具备强差异化。在 2025 年开年,汇集 ADC 企业创始人、BD\ 运营策略负责人、投资人等角色大咖一同探讨 ADC 发展的新挑战、新未来。
09:00-09:05
大会致辞
09:05-09:30
国产 ADC 出海实践与心得
09:30-10:15
圆桌 1:国产 ADC 药物研发趋势及出海探讨
* 癌症治疗方式多、国内靶点内卷、集采等因素,ADC 药物研发现状及趋势演变?
* 面对高昂的研发成本,Biotech 解决现金流的方案?
* 面对陌生市场,国内药企选择出海的调研策略?
* ADC 产品如何做出差异化 & 技术迭代才能在国际化市场中脱颖而出?
10:15-10:40
茶歇&商务交流
10:40-11:05
创新 ADC 药物研发现状及未来展望
11:05-11:30
ADC 药物差异化路径探索及专利策略
11:35-12:05
圆桌 2:ADC 药物的投资与合作
* 大整合趋势下,什么样的 ADC 产品策略及合作形式胜出机会更大?
*ADC 药物技术壁垒高,买卖方谈判怎么把控产品估值、知识产权风险等?
* 资本视角:目前哪些类别的 ADC 药物更具投资价值?
*MNC 视角:对于优质 ADC 资产的评估及合作伙伴选择?
12:05-14:00
午餐及休息
A会场:从ADC发现到临床的桥梁
众所周知 ADC 的复杂结构需要化学、药学、生物学、临床医学等交叉学科共同携手应战开发挑战,如何加快 ADC 从发现到临床转化的脚步,走出实验室到患者应用治疗,需要产学研用端新技术与科研人共同助力。
A1:ADC 药物早期开发及技术平台
(2月18日下午)
14:00-14:30
ADC 药物的早期立项
14:30-15:00
契合 ADC 药物的抗体发现及开发
15:00-15:30
ADC 药物的活性评估方案
15:30-15:50
茶歇&商务交流
15:50-16:20
放大旁观者效应,提高 linker 稳定性的最佳 ADC 分子设计
16:20-16:50
基于 GlycOBI ADC 平台开发双抗 ADC
16:50-17:20
圆桌讨论:
*ADC 药物早期开发阶段攻克 ADC 雏形的挑战及方案?
*ADC 药物分子设计及优化策略?
*ADC 技术平台的迭代?
A2:ADC药物临床前研究
(2月19日上午)
09:00-09:30
ADC 药物的相关毒性及研究对策
09:30-10:00
分析中美 IND 申报中 ADC 药物 CMC 难点及要点
10:00-10:30
ADC 药物生物分析 / 临床前模型 / 非临床评价方案等
10:30-10:50
茶歇 & 商务交流
10:50-11:20
Characterizing ADC Safety & Activity in Preclinical Development
11:20-11:50
Hypothesizing the Current Disconnect Between In Vivo & In Vitro ADC Target Modeling to Prevent Clinical Hold Up
11:50-12:20
圆桌讨论
* 探讨临床前、非临床研究中评估 ADC 药物疗效及安全的基本原
理及优化方案,以提高临床成功率?
* 双抗 ADC,ADC+IO 联合用药等前沿研究给生物分析带来的挑
战与机遇?
12:20
午餐及休息
A3:ADC药物转化医学研究及早期临床
(2月19日下午)
14:00-14:30
转化医学策略应用于 ADC 药物开发
14:30-15:00
ADC 药物的早期临床试验设计与实践
15:00-15:30
应用于 ADC 药物临床 I\II 期临床实验的生物标志物策略
15:30-15:50
茶歇&商务交流
15:50-16:20
早期临床研究中关于 ADC 耐药机制的探索及干预
16:20-16:50
ADC 药物早期临床试验中的剂量优化与给药策略探索
16:50-17:20
圆桌讨论
* 探讨加快 ADC 药物从 POC 验证突破 II 期临床的攻略及工具?
* 以及哪些关键数据及临床表现判断 ADC 临床有效性?
17:20
A论坛结束
B会场:ADC药物临床及工艺、生产
通过 IND,你的 ADC 就成功了吗?新药研发之路九死一生,“大浪淘沙”用临床和生产再去验证你的 ADC 质量,国际化开发背景下,除了 ADC 分子结构带来的多重挑战,从临床到工艺生产也需要考虑更多地域差异、交叉学科、合作伙伴筛选等难题,需要 ADC药企及 CRDMO 合作伙伴共同携手应对解决。
B1:ADC药物的多中心临床及申报策略
(2月18日下午)
14:00-14:30
探讨 ADC 复杂结构对其临床性能的影响
14:30-15:00
ADC 药物的联合用药探索及注意事项
15:00-15:30
ADC 药物多中心临床开发及注册策略
15:30-15:50
茶歇 & 商务交流
15:50-16:20
Nectin-4 ADC 药物临床开发进展
16:20-16:50
从临床成败看 ADC 技术发展
16:50-17:20
圆桌讨论
* 国际化开发背景下,制定更优的 ADC 药物临床及注册策略以促进商业化落地?
*ADC 药物单药治疗未来前景?为什么各家都在做联用?
17:20
第一天结束
B2:ADC药物的工艺及生产
(2月19日上午)
09:00-09:30
基于 QbD 及风险评估等理念的 ADC 药物工艺开发
09:30-10:00
ADC 偶联工艺及杂质去除
10:00-10:30
ADC 药物工艺 / 智能化研发生产解决方案
10:30-10:50
茶歇&商务交流
10:50-11:20
ADC 制剂处方开发要点及稳定性考量
11:20-11:50
ADC 药物生产关键环节及简化生产探讨
11:50-12:20
圆桌讨论
* 国际化开发背景下,ADC 药物研发生产新的挑战及突破?
*CRDMO 合作伙伴选择及分工?
12:20
午休
B3:ADC药物质量及分析
(2月19日下午)
14:00-14:30
ADC 药物研发阶段的质量管理
14:30-15:00
ADC 药物的关键质量属性及表征分析
15:00-15:30
ADC 药物临床试验阶段的质量管理
15:30-15:50
茶歇&商务交流
15:50-16:20
ADC 药物制造及质控策略
16:20-16:50
ADC 药物变更计划的评估及可比性研究思路
16:50-17:20
圆桌讨论
* 从上游原材料开始,探讨 ADC 药物全生命周期的质量分析及质控策略?
17:20
B论坛结束
C会场:“ADC”差异化开发2.0 VS FIC3.0
中国生物医药正在从快速跟随阶段进入差异化 2.0、源头创新 3.0,以中国在研早期阶段的新靶点、新技术、新机制产品透过频繁出海 & 合作等方式表现出来,尤其是 ADC 更为抢眼。ADC 在 2022-2024 年获得非常多 MNC 及国际学术会议的认可,同时 ADC 的可成药性带动了以“ADC”为机制的更多偶联药物迎来增长趋势,尤其资本新宠核素偶联药物被 MNC、Pharma、Biotech 纷纷布局。
C1:ADC药物前沿进展
(2月18日下午)
14:00-14:30
Utilizing the Click-to-Release platform to expand ADC drug targets and develop non-internalized ADC drugs
14:30-15:00
基于纳米抗体的 MET-EGFR 双靶 ADC 的药物研发进展
15:00-15:30
ADC 药物发现的趋势和突破点
15:30-15:50
茶歇 & 商务交流
15:50-16:20
突破肿瘤,ADC 药物在自免领域的研究进展
16:20-16:50
双抗 ADC 药物的研发进展及隐患
16:50-17:20
圆桌讨论
* 国产 ADC 争做 FIC 的出路?
* 双抗 ADC 目前属于风口还是内卷?
* 预测下一波创新 ADC 会是什么方向?
17:20
第一天结束
C2:"ADC"为机制的泛偶联药物开发
(2月19日上午)
09:00-09:30
Bispeciffc-XDC: Novel First-in-Class Cancer Therapies From Concept to Clinical
09:30-10:00
突破“不可成药”:从 Protac 到 DAC 降解剂
10:00-10:30
“万物皆可偶联”新时代,研发生产挑战及破局
10:30-10:50
茶歇&商务交流
10:50-11:20
基于肿瘤微环境的小分子偶联药物开发
11:20-11:50
XDC 药物递送过程的思考
11:50-12:20
圆桌讨论
*“ADC”为机制的 XDC 药物目不暇接,下一个抢眼球的新药是什么?
* 从技术迭代和未满足的临床需求出发,XDC 药物突破肿瘤的机会点?
12:20
午休
C3:"ADC"为机制的潜力股新药:核素偶联
(2月19日下午)
14:00-14:30
核素 + 偶联技术驱动新型靶向放射性疗法
14:30-15:00
RDC 药物药代动力学 / 生物分析等研发解决方案
15:00-15:30
核素偶联药物的独特机制及结构设计
15:30-15:50
茶歇&商务交流
15:50-16:20
基于特定靶点 PSMA 的核素偶联药物研发进展
16:20-16:50
“双面骑士”RDC 药物在抗肿瘤诊断、治疗中的应用
16:50-17:20
圆桌讨论
*RDC 药物研发挑战及趋势?及产业端各角色如何携手突破?
* 核药的特殊性在哪,为什么火爆?未来技术前瞻及商业化可行性展望?
17:20
C论坛结束
1、ADC\XDC\抗体\小分子药物研发企业,如果你正在考虑布局ADC管线并在寻找合作伙伴,或者来自以上企业且想与同行学习交流的研发从业者;
2、自有ADC技术平台展示及想引进ADC技术平台的Biotech/BioPharma;
3、CXO服务商:靶点发现、生物分析、非临床评价、动物模型、生物标志物开发、伴随诊断、临床服务、工艺开发、CMC服务、CDMO等;
4、原料试剂类供应商:工程化抗体、linker、payload等;
5、研发生产解决方案服务商:自动化、智能化、仪器设备等;
6、其他:临床及科研机构、投资、专利服务、法律服务等;
信达生物
启德医药
快序生物
博腾生物
信诺维
宜联生物
上海佑科仪器仪表有限公司
迈博瑞
Ennovabio
上海森松制药设备工程有限公司
映恩生物
糖智药业
拓济医药
烟台迈百瑞
儒百生物
凯莱英
英诺湖医药
大湾生物
岸迈生物
沙砾生物
Lonza
信立达医药
玄刃科技
华抗生物
上海益牧科学器材有限公司
苏州格力美特实验室科技发展有限公司
上海臻格生物技术有限公司
苏州七溪生物硅谷有限公司
太仓生物医药有限公司
科迈生物
英沐生物
宏成药业
江苏金阶律师事务所
苏州说科生物科技有限公司
苏州赛普生物科技股份有限公司
爱科百发
倍谙基
安迪生物
睿智医药
昭衍新药
昂阔医药
瑞普利金
赛生药业
和元生物
集萃药康
安美医药
艾贝泰
asymbio
迈杰转化医学
中科院上海药物所苏州药物研究院
百英生物
智享生物
埃格林医药
华美生物
翰思生物
药明康德
华东医药
格来赛生命科技上海有限公司
君研生物
拓创生物
岛津
上海复旦张江生物医药股份有限公司
武汉智化科技有限公司
苏州三雄生物科技有限公司
CITELINE
Eximmium
昆翎企业管理(上海)有限公司
海通证券股份有限公司
苏州开拓药业股份有限公司
深圳市康桥生物医药有限公司
佰睿壹生物科技有限公司
BioBAY
上海明睿生物技术有限公司
Repligen
约印医疗基金
昆翎
拓创生物科技
晶云星空制药有限公司
艾伦仪表电器有限公司
上海求式生物科技有限公司
常熟苏虞生物医药产业发展有限公司
卡秋生物
北京中盛生物有限公司
东曜药业
基泰生物
诺唯赞
利穗科技
诺和德美
聚明创投
苏州大学附属第四医院
宜明(北京)细胞生物科技有限公司
深势科技
美迪西
国药锦奇
百济神州
苏州工业园区投资促进局
颐坤生物
上海观合医药科技股份有限公司
上海迪赢生物科技有限公司
神州细胞
纽福斯生物
世和基因
复星医药
上海本导基因技术有限公司
药明生物
苏州晶云药物科技股份有限公司
普众发现
瑞诺元生物科技有限公司
厚百生物
弗雷克森精密工业苏州有限公司
和记黄埔医药(上海)有限公司
赛赋医药
普灵医药
常茂生物化学
昆拓
瑞孚迪生物医药(上海)有限公司
依科赛
苏州安赛隆医药科技有限公司
普米斯
致道资本
金斯瑞蓬勃生物
茂行制药
海普洛斯
水木未来(北京)科技有限公司
上海芯超生物科技有限公司
Labcorp
泰州医药城投资促进中心
百因诺
Synaffix
江苏迈威康新药研发有限公司
苏州君盟生物医药科技有限公司
德睿智药
康源博创生物科技(北京)有限公司
Intertek
苏州医工所
太仓市生物医药产业园管委会
杭州奥盛仪器有限公司
中美冠科生物技术(太仓)有限公司
EDDC Singapore
ABL bio
T-E Meds
Allygen Biologics
和铂医药
复旦张江
德琪医药
女王之舟
高田生物
复宏汉霖
凯信远达
百力司康
百凯医药
西岭源
智康弘义
弼领生物
诗健生物
中山大学肿瘤防治中心
浙江省肿瘤医院
诺纳生物
徕特康
汇宇制药
仁济医院
礼新医药
泰诚思生物医药
爱科瑞思
橙帆医药
亿胜生物
三生国健
辐联科技
康源久远
英诺湖
应世生物
华博生物
博瑞创合
祥耀生物
博奥信
中国科学院
约印基金
齐鲁制药
迈威生物
启明创投
多禧生物
上海乐土科技有限公司
上海伟霓生物科技有限公司
丹纳赫
伯桢生物
科望医药
倍而达药业
亲合力生物
博奥信生物
道尔生物
徕博科医药研发(上海)有限公司
溪长生物
益诺思
熙宁生物
英诺维尔
南京药石科技股份有限公司
天津迦楠制药设备有限公司
杭州艾迪康医学检验中心有限公司
苏州国辰生物科技股份有限公司
顾因医药咨询(上海)有限公司
重庆迪纳利医药科技有限责任公司
北京伊诺凯科技有限公司
益世科医药
Bio-Techne
苏州盛德伟业信息科技有限公司
贝克曼库尔特生命科学
安捷伦
苏州美诺医药科技有限公司
博腾股份
SCIEX
上海强生投资有限公司
苏州米特龙科技有限公司
上海博腾智汇生物制药有限公司
联宁生物
沃凯药业
江苏睿捷生物科技有限公司
艾可泰科浙江控股有限公司
浙江中医药大学
同宜医药
泰励生物
苏州珀罗汀生物技术有限公司
国投招商投资管理有限公司
苏州大学附属第一医院
泽璟制药
苏州晶云星空制药有限公司
ACRO
赛诺特生物技术有限公司
武汉宏韧生物医药股份有限公司
诺米代谢
爱康得生物科技(苏州)有限公司
泰诚思(上海)生物医药有限公司
再鼎医药
JITRI IADDT
至本医疗
中科院苏州药物创新研究院
苏工业园区康林肿瘤科技创新研究院
上海科来福生物技术有限公司
吉因加
苏州亚宝药物研发有限公司
苏州科信康恒医药科技有限公司
哈美顿
沪亚生物
创胜集团
动脉网
苏州奎克泰生物技术有限公司
小饭桌创投
杭州中美华东制药有限公司
康弘药业
泰格医药
常州信息职业技术学院
康威(广州)生物科技有限公司
驾玉生物
普洛药业
第一三共
开拓药业
瑞阳生物
无锡市中医院
英赛斯
养生堂
药明合联
长三角G60科创走廊产业赋能中心
Johnson & Johnson Innovation Center
同腾新创(苏州)科技有限公司
奥星衡讯上海科技有限公司
彩科(苏州)生物科技有限公司
南京立顺康达医药科技有限公司
国创中心
艾米能斯
楚天源创生物技术(长沙)有限公司
苏州贝格朗生物科技有限公司
苏州工业园区生物产业发展有限公司
Caidya
维立志博
瑞阳(苏州)生物科技有限公司
斯道资本
安纳吉
复红康合
谱尼生物医药
南京诺和欣医药科技有限公司
山东金城医药股份有限公司
飞凡生物制药有限公司
湃隆生物
上海贺维斯特医药科技有限公司
上海泰槿生物技术有限公司
南京市斑马鱼智能科技有限公司
杭州厚泽生物科技有限公司
苏州锐迪欧医药科技有限公司
苏州智核生物医药科技有限公司
方达医药
澳斯康
保诺-桑迪亚
Henlius
复星诊断
中国平安财产保险股份有限公司苏州分公司
保瑞生技股份有限公司
上海玮驰仪器有限公司
北京爱思益普生物科技股份有限公司
三一创新投资
Bora Biologics
上海祥耀生物科技有限公司
乐普生物
丹丰资本
明济生物
近岸蛋白
宁波倍合德国际贸易有限公司
康朴生物
泽平科技
瀚科迈博生物
上海闵行商务管理有限公司
澎立生物医药技术(上海)股份有限公司
成都康弘药业集团股份有限公司
杉互健康
有济医药
百度健康
上海礼邦医药科技有限公司
国药控股上海生物医药有限公司
翰森制药
北京深势科技有限公司
BOCG蓝海资本
苏州艾博生物医药科技有限公司
江苏世通仪器检测服务有限公司
国信医药
恺佧生物科技(上海)有限公司
医数康成
石药集团
上海泽纳仕生物科技有限公司
江苏百赛飞生物科技有限公司
康德弘翼
再创生物
骁影科技
汉尧仪器
南京方腾医药技术有限公司
吉富创投
零壹人工智能科技研究院(南京)有限公司
上海铁鹰锐士供应链管理有限公司
中国国际金融股份有限公司
强生(中国)投资有限公司
三优生物
呈益投资
方昆医药
苏州康维讯生物科技有限公司
上海泰楚生物技术有限公司
赛默飞世尔科技
缔码生物
上海仁迅科技有限公司
广州威溶特医药科技有限公司
北京久禾科技有限公司
上药国际供应链有限公司
WatsonMarlow
泰锟医药
百奥赛图
南京东默医药技术有限公司
成都药康生物科技有限公司
嘉乐资本
GSK研发中心
Merck
中科创达软件股份有限公司上海分公司
芯潮澎湃生物科技(南京)有限公司
海路生物
北京泰德制药股份有限公司
无锡盛合瑞生物技术有限公司
百图生科
科镁信生物
中科筑奇
拓维生物
药渡
保仕健生物科技有限公司
上海基锘威生物科技有限公司
医药魔方
恒瑞医药
上海子图信息技术有限公司
北京阳光诺和药物研究股份有限公司
苏州君跻生物科技有限公司
百泰派克
上海迈晋生物医药科技有限公司
苏州诺华医药科技研发有限公司
上海酷班生物科技有限公司
博锐生物
佐临生物
苏州诺洁贝生物技术有限公司
芝兰健康
百时美施贵宝
上海达科为生物技术有限公司
珲达生物
杭州拜邦生物科技有限公司
味之素(中国)上海分公司
浙江大学
格进(杭州)生物技术有限责任公司
正大天晴
厦门三冀科技有限公司
康日百奥
康乃德生物
燃石医学
鼎新基因
联想之星
盟科药业
康龙化成
西安蓝晓科技新材料股份有限公司
道扬咨询
苏州代蒙迪医药科技有限公司
上海标度百奥生物技术有限公司
浙江华海生物科技有限公司
博济医药
BMS Integrative Sciences
三生制药
上海艾力斯医药科技股份有限公司
荣昌生物
普米斯生物
New Objective China
康羽生命科学技术(苏州)有限公司
中科院深圳先进院
翰思生物医
军科正源
健新原力
苏州科林利康医药科技有限公司
贝壳社
天津全和诚科技有限责任公司
美雅珂生物
为度生物
Novotech
泰澧生物
普灵生物
PHT INTERNATIONAL INC
上海爱美试医药科技有限公司
苏州爱科仕智造科技有限公司
卡博金艾美斯医药
美通社
睿智化学
中健云康
云检医学
华深智药
宽潭资本
复容投资
浙江同源康医药股份有限公司
科伦博泰
上海逐典生物科技有限公司
晶泰科技
AZENTA
指数资本
顺丰速运
皓阳生物
柏思荟
泉果基金
有诺真生物
康昱盛科技
华东理工大学
普天硕资本
云锋基金
苏州创胜医药集团有限公司
多玛医药
CellCarta
纳微科技
Helixon
策知易咨询
浙工大莫干山研究院
国投招商
天津泰达科技投资股份有限公司
南京融捷康生物科技有限公司
苏州恩泰新材料科技有限公司
东诚医药
Tavotek
恒驭生物
子瞻生物
清池资本
迈哲华(上海)投资管理咨询有限公司
中国药科大学
山东和合私募基金
上海济煜
华润三九医药股份有限公司
上海翰森生物医药科技有限公司
神农投资
康晟生物
东北证券股份有限公司
柏石生物
楹联健康基金
珠海华金创新投资有限公司
信熹资本
英飞尼迪
合肥综合性国家科学中心大健康研究院
江苏省产业研究院
Viroad
SynChem Inc
上海伊米诺康生物科技有限公司
中科院上海药物所苏州研究院
上海澳斯康生物制药有限公司
迈柯唯(上海)医疗设备有限公司
顺丰医药供应链有限公司
成都赛美斯医疗技术有限公司
博蕴生物
上海馨颖生物技术有限公司
澄耀生物
苏州药明生物
智慧流动
君实生物
上海医药
皓元生物
有临医药
科创先锋生物
桦拓供应链科技(上海)有限公司
君齐投资集团有限公司
苏州沪云新药研发股份有限公司
上海药物所苏州研究院
守衡生物
苏州圣苏新药开发有限公司
米度生物
力鼎投资
苏州吉玛基因股份有限公司
泰锟
江苏耀海生物制药有限公司
上海鲲霆生物科技有限公司
正大天晴药业集团股份有限公司
苏州大学
苏州浦合医药科技有限公司
亿腾医药
复百澳
同腾生物
奥星集团
成都古格尔生物技术有限公司
翰思艾泰
浙江博锐生物制药有限公司
全景医药
愿智生物
天演药业
北京东方引擎投资管理有限公司
亲合力
碧博生物
亦康医药
盛涵生物
江苏盛世华为系统科技有限公司
舟渡资本
金赛药业
华金资本
北京先为达生物科技有限公司
勃林格殷格翰
帕母医疗
艾力特
西交利物浦大学
行远致同
上海鲲霆
先进微球研究所
南京圣和药业股份有限公司
磐谷创投
海思科
北京市金杜律师事务所
东阳光药业
上海醴泽投资管理有限公司
探针资本
Neumann Advisors
ARK Capital
生特瑞(上海)工程顾问股份有限公司
本草资本
五源资本
醴泽资本
维亚生物科技(上海)有限公司
腾讯投资
博岳新相
成都仁域生物技术有限公司
北京汇智泰康医药技术有限公司
英格尔检测技术服务(上海)有限公司
普瑞基准
南洋高科技创新中心
Biocity Biopharmaceutics Co., Ltd.
杭州泰格医药科技股份有限公司
华大基因研究院
Amgen
瀚海新酶
礼来
江苏云朴医药新材料科技有限公司
南京云桥璞瑞生物科技有限公司
吉凯基因科
康朴生物医药技术(上海)有限公司
中美瑞康核酸技术(南通)研究院有限公司
翊博生物
浙江瑞奥生物科技有限公司
南京江北新区生物医药公共服务平台有限公司
创模生物科技(北京)有限公司
上海交通大学医学院
南京自壹私募股权投资基金有限公司
丹望医疗
华大基因
CCDC
畅溪制药
南京市商务局
上海瀚枢生物医药有限公司
士泽生物
天津市肿瘤医院
浙江工商大学出版社
大连医科大学附属第一医院
Zuellig Pharma
白帆生物
博纳西亚(合肥)医药科技有限公司
阿斯利康
华辉安健
甫康生物
谱尼医药
百趣生物
苏州君达合创建设科技有限公司
深蓝观
百蓁生物
凯理斯医药科技发展(上海)有限公司
安腾瑞霖
三江资本
茂行生物
斯丹姆
北京科林利康医学研究有限公司
祐方生物
步长制药
澳大利亚驻沪领馆商务处
香港大学
博瑞策
康明永瑞生物科技(苏州)有限公司
上海宏成药业有限公司
华兴资本
景杉医疗
若泰医药
北京热景生物技术股份有限公司
坤煜医药
深圳市康桥生物医药有限责任公司
上海禧耀医药科技有限公司
桦冠医药
皓元医药
精翰生物
奥来恩医药(苏州)有限公司
阿诺医药
Illumina
楚天微球生物技术(长沙)有限公司
香港科技大学
上海生物芯片有限公司
上海泰锟医药技术有限公司
凯惠睿智生物科技(上海)有限公司
百斯医学
阿克曼病理
北京星亢原生物科技有限公司
爱博泰克
TSC
勤智资本
Phastar
mProbe
溥思生物
长江润发(苏州)医药科技有限公司
永道致远
Daiwa Capital Market
普方生物
会议回顾推文
• 首日千人到场!第五届ADC药物开发峰会火爆开幕
• 第五届ADC药物开发峰会在苏州圆满闭幕
抗体药物偶联物引进/卖出
2024-08-24
·药融圈
▲10月26-27日成都中国临床试验产业发展大会免费报名
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
01
2024年2月1日,赛诺菲发布2023年财报,2023年全年业绩430.7亿欧元,同比增长5.3%。
制药业务领域,特药销售额180亿欧元,同比增长14.2%。
赛诺菲公司最大单品,当家花旦:度普利尤单抗/Dupixent (Dupilumab注射液)2023年销售额达107.15亿欧元,同比增加34%。2023年第4季度销售额为29.9亿欧元;全年美国市场81.45亿欧元。全球范围内获批适应症有:特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉、结节性痒疹和嗜酸性食管炎(EoE)等。赛诺菲年报以及CEO Paul Hudson表示,度普利尤单抗的2024年销售额将达130亿欧元。(2017 年 3 月 28 日, 获美国 FDA 批准上市,成为首个治疗中重度特应性皮炎的生物制剂。仅上市7年即获得超高收益)
Dupixent(Dupilumab注射液)由再生元(Regeneron)和赛诺菲开发的一款全人单克隆抗体,其针对IL-4Rα上同时结合IL-4及IL-13的亚基,因此能够同时阻断IL-4及IL-13的信号传导。
2024年7月底,赛诺菲半年报告显示:旗舰产品度普利尤单抗上半年业绩共61.38亿欧元。赛诺菲没有调整130亿欧元销售目标指引。
度普利尤单抗于2020 年 6 月首次在中国获批上市,获批适应症有中重度特应性皮炎(6个月至成人)、结节性痒疹和哮喘适应症等。中重度特应性皮炎适应症的注册证号:S20200017。
附,分享:此前,中国CDE公开了度普利尤单抗(治疗中度至重度结节性痒疹)审评报告以及说明书。发送IL-4R(请正确复制)至下方药融圈微信公众号后台可获得原文件。仅供学习交流分享!
结节性痒疹(PN)是一种炎症性皮肤病,其特征为持续≥6 周的慢性瘙痒且伴有反复搔抓、抓挠或摩擦的皮肤病史和/或体征,以及通常对称分布于躯干和四肢部位质地坚硬的结节性病灶。临床特征为重度瘙痒,患者会长期、反复且通常无法控制地搔抓或揉搓皮肤,最终导致皮肤出现角化过度的结节。PN 流行病学数据有限,美国 18-64 岁成人每 10 万人约有 72 人患有 PN。主要见于 50 岁以上老年患者,男性和女性均可能发病,但女性发病率更高。患者瘙痒感强烈,瘙痒-搔抓恶性循环会加重皮损处的细胞损伤并诱发继发性感染。持续性瘙痒导致长期睡眠不足、受累部位持续性烧灼感、刺激和疼痛,对患者的生活质量产生严重影响。PN 相关合并症包括心理健康疾病、肥胖、内分泌/代谢疾病、自身免疫性/自身炎症性疾病、心血管疾病、肾脏疾病、 HIV、恶性肿瘤和特应性疾病。
02
药品信息
受理号:
JXSS2300021
药品名称:
度普利尤单抗注射液
药品类型:
治疗用生物制品
注册分类:
3.1
承办日期:
2023-03-07
公示日期:
2024-03-07
企业名称:
Sanofi-aventis groupe;Sanofi Winthrop Industrie;赛诺菲(中国)投资有限公司
相关附件信息
附件1:度普利尤单抗注射液(JXSS2300021)申请上市技术审评报告.pdf
附件2:度普利尤单抗注射液(JXSS2300021)说明书_.pdf
药融云数据(www.pharnexcloud.com)显示,目前本靶点领域在做的部分企业有:
麦济生物长效IL-4R单抗治疗中重度哮喘II期试验结果积极;部分适应症开启3期临床中;
荃信生物:抗IL-4Rα单抗拟纳入突破性治疗品种;
首付1.5亿,先声药业:引进康乃德生物医药IL-4Rα单抗;
智翔金泰也处于3期阶段、洛启生物(单域纳米抗体)、康诺亚(CM310,递交新药上市申请审评中)、南京融捷康生物(单域抗体)、康方生物(AK120)、三生国健(公司研发代号:611)、绿叶制药/博安生物(TS0001)、恒瑞医药(SHR1819)、科济生物(融合蛋白)、北京凯因科技、瑞阳生物等等。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.dupixent.com/;
https://www.sanofi.com/;
https://www.regeneron.com;
https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=69978fcd7e0f421b2088d705a5a7253b;等等。
本文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐
【关于药融圈】
药融圈PRHub旨在帮助生物医药科技型企业进行品牌推广及商务拓展服务,针对客户的真实需求制定系统化解决方案,通过“翻译-降维-场景化”将客户的品牌信息以直白易懂的方式被公众知悉,同时在流量渠道覆盖100万+垂直用户基础上实现合作目的,帮助合作伙伴完成从品牌开始到商务为终的闭环营销服务。我们已经完成了数十场线下1000人规模的生物医药研发类会议,涵盖小分子新药,大分子新药,改良型新药,BD跨境交易等多个领域,服务了百余家上市/独角兽/生物技术/制药企业。
财报上市批准临床研究
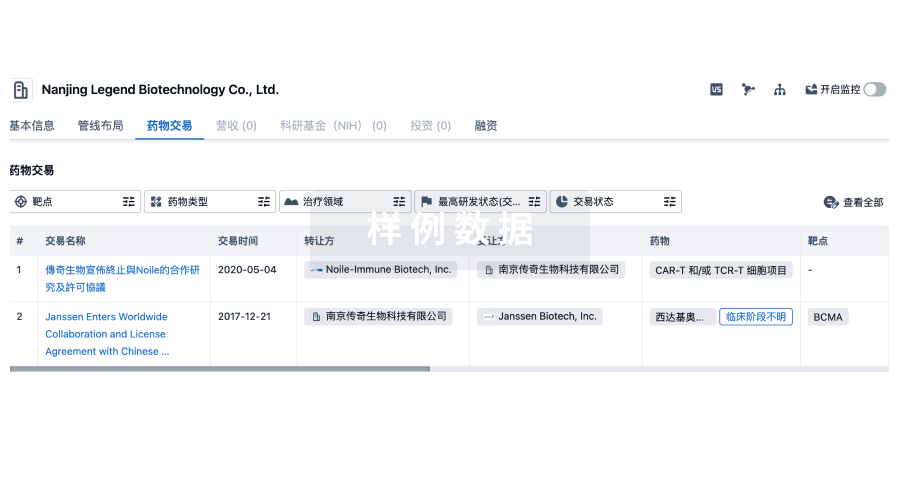
100 项与 瑞阳(苏州)生物科技有限公司 相关的药物交易
登录后查看更多信息
100 项与 瑞阳(苏州)生物科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年06月30日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
临床申请批准
2
1
临床3期
其他
2
登录后查看更多信息
当前项目
| 药物(靶点) | 适应症 | 全球最高研发状态 |
|---|---|---|
RB-0026 | 呼吸道合胞体病毒感染 更多 | 临床3期 |
RB0021 ( CD38 ) | 复发性慢性淋巴细胞白血病 更多 | 临床申请批准 |
RB0011 ( CLDN18.2 ) | Claudin 18.2阳性 / HER2阴性的实体瘤 更多 | 临床申请批准 |
RB-0004 ( PD-1 ) | 淋巴瘤 更多 | 无进展 |
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
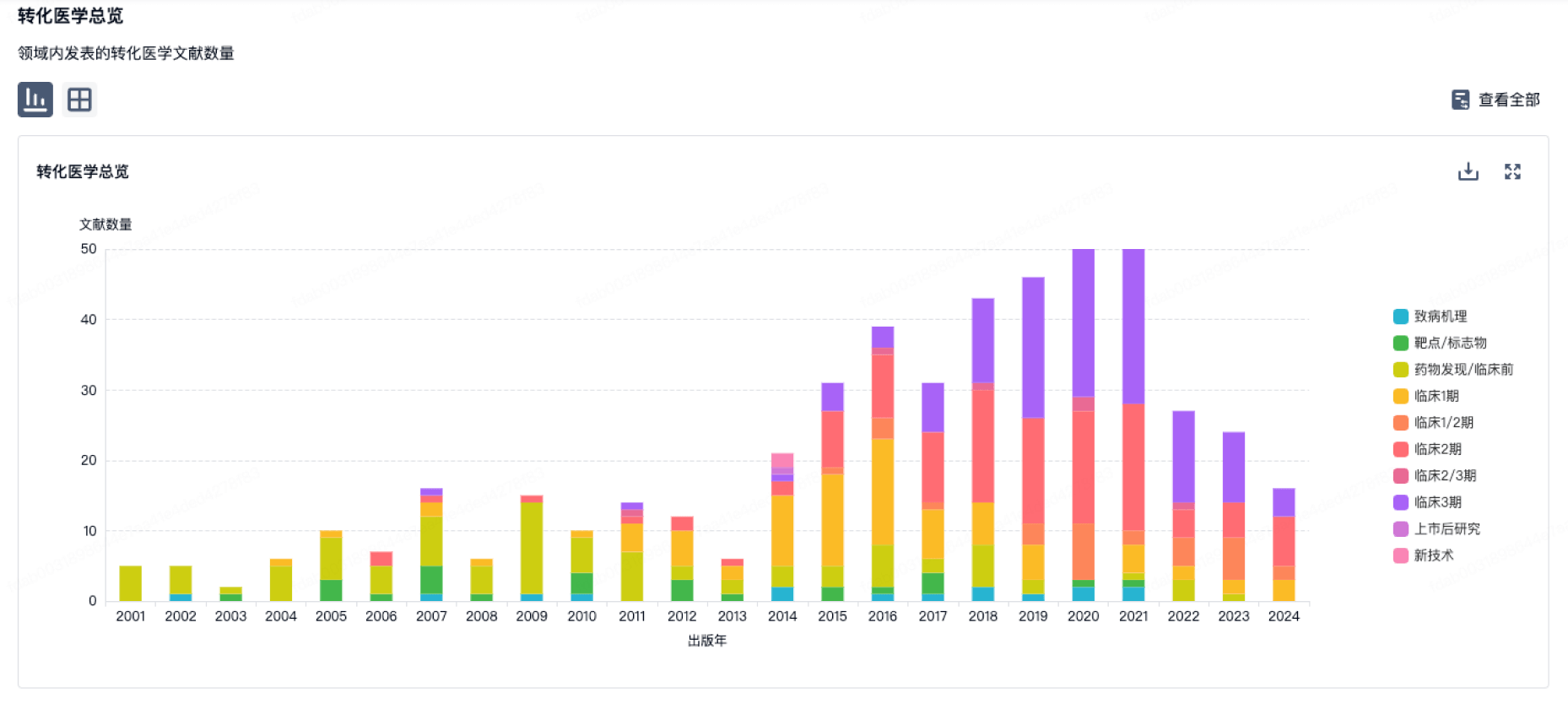
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用