预约演示
更新于:2025-05-07

iCell Gene Therapeutics, Inc.
更新于:2025-05-07
概览
标签
血液及淋巴系统疾病
免疫系统疾病
肿瘤
CAR-T
自体CAR-T
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| CAR-T | 4 |
| 自体CAR-T | 2 |
关联
19
项与 iCell Gene Therapeutics, Inc. 相关的药物作用机制 BCMA抑制剂 [+3] |
在研适应症 |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
靶点- |
作用机制 基因转移 [+1] |
非在研适应症- |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
靶点 |
作用机制 CD4调节剂 [+1] |
在研适应症 |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
15
项与 iCell Gene Therapeutics, Inc. 相关的临床试验NCT06787989
Treatment of Refractory Immune Thrombocytopenia
This is a phase I, interventional, single arm, open label, treatment study to evaluate the safety and tolerability of BCMA-CD19 cCAR T cells in patients with refractory ITP associated with autoimmune disease.
开始日期2024-08-31 |
NCT06071624
CD4CAR T Cell Therapy for CMML
This study is designed as a single arm open label traditional Phase I, 3+3, study of CD4-directed chimeric antigen receptor engineered T-cells (CD4CAR) in patients with relapsed or refractory CMML. Specifically, the study will evaluate the safety and feasibility of CD4CAR T-cells.
开始日期2024-02-21 |
申办/合作机构  Indiana University Indiana University [+2] |
NCT05212584
CD7 CAR-T Cell Treatment of Relapsed/Refractory CD7+ T -Acute Lymphoblastic Leukemia/ Lymphoma
This is a phase I, interventional, single arm, open label, treatment study to evaluate the safety and tolerability of CD7 CAR-T cells in patients with relapsed and/or refractory, high risk hematologic malignancies.
开始日期2022-07-01 |
申办/合作机构 |
100 项与 iCell Gene Therapeutics, Inc. 相关的临床结果
登录后查看更多信息
0 项与 iCell Gene Therapeutics, Inc. 相关的专利(医药)
登录后查看更多信息
1
项与 iCell Gene Therapeutics, Inc. 相关的文献(医药)2024-10-01·Annals of the Rheumatic Diseases
BCMA-CD19 compound CAR T cells for systemic lupus erythematosus: a phase 1 open-label clinical trial
Article
作者: Shah, Darshi ; Li, Fugui ; Pinz, Kevin ; He, Shanzhi ; DeStefano, Vincent M ; Zhang, Wenli ; Liang, Yingwen ; Wang, Min ; Zhang, Hongyu ; Hagag, Nabil ; Zeng, Ronghao ; Ma, Yu ; Ma, Yupo ; Wada, Masayuki ; Lan, Ting ; Guo, Zhencong ; Yuan, Yong ; Deener, Greg ; Zou, Chanjuan ; Ding, Ling ; Wang, Weijia ; Hong, Ming ; Wang, Mingxia
17
项与 iCell Gene Therapeutics, Inc. 相关的新闻(医药)2024-12-03
The lupus nephritis market is poised for growth, driven by rising disease prevalence, advancements in therapeutics such as biologics and targeted therapies, and increased investment in R&D. Heightened awareness and robust support from governments and key industry players further create a dynamic environment for innovation and better patient outcomes.
LAS VEGAS, Dec. 3, 2024 /PRNewswire/ -- DelveInsight's
'
Lupus Nephritis Pipeline Insight 2024
' report provides comprehensive global coverage of pipeline lupus nephritis therapies in various stages of clinical development, major pharmaceutical companies are working to advance the pipeline space and future growth potential of the lupus nephritis pipeline domain.
Key Takeaways from the Lupus Nephritis Pipeline Report
DelveInsight's lupus nephritis pipeline report depicts a robust space with
30+ active players working to develop
35+ pipeline therapies for lupus nephritis treatment.
Key lupus nephritis companies such as
AstraZeneca, Hoffmann-La Roche, Novartis, Qilu Pharmaceutical, Vera Therapeutics, Conduit Pharmaceuticals, Amgen, Johnson & Johnson, BeiGene, RemeGen, Argenx, Kyverna Therapeutics, Cabaletta Bio, ImmPACT Bio, Alpine Immune Sciences, AlloSite Therapeutics, iCell Gene Therapeutics, Caribou Biosciences, Adicet Bio, Shenzhen Pregene Biopharma Co., Ltd., Resolve Therapeutics, BioAegis Therapeutics, Lepton Pharmaceuticals, Transcenta Holding, and others are evaluating new lupus nephritis drugs to improve the treatment landscape.
Promising lupus nephritis pipeline therapies such as
Anifrolumab, Obinutuzumab, Ianalumab, QLG1074, Atacicept, AZD1656, Daxdilimab, Nipocalimab, Zanubrutinib, Telitacicept, Efgartigimod alfa, KYV-101, CABA-201, IMPT-514, Povetacicept, ONT01, BCMA-CD19 cCAR T cells, CB-010, ADI-001, PRG-2311, RSLV-621, Recombinant human plasma gelsolin, LN-008, TST 008, and others are under different phases of lupus nephritis clinical trials.
In November 2024, Adicet Bio announced that the first LN patient had been dosed in the
Phase I clinical trial evaluating
ADI-001 in autoimmune diseases.
In November 2024, Kyverna Therapeutics announced that it would present updated
clinical data from LN patients treated with
KYV-101 in ongoing Kyverna-sponsored KYSA-1 and KYSA-3 Phase I/II studies and named patient treatments.
In October 2024, Kezar Life Sciences suspended subject enrolment and patient dosing in the
Phase II PALIZADE trial of zetomipzomib for active lupus nephritis.
In June 2024, Nkarta announced the initiation of Ntrust-I, a multi-center clinical trial of
NKX019 in lupus nephritis, with the first patient in screening. The company also announced the clearance by the U.S. Food and Drug Administration (FDA) of its second
Investigational New Drug (IND) application for NKX019 in autoimmune disease.
In June 2024, Adicet Bio announced that the US
Food and Drug Administration (FDA) had granted Fast Track Designation to ADI-001 for the potential treatment of relapsed/refractory class III or class IV lupus nephritis.
In April 2024, Caribou Biosciences announced that it had received clearance of its
Investigational New Drug (IND) application from the U.S. Food and Drug Administration (FDA) for
CB-010, an allogeneic anti-CD19 CAR-T cell therapy with a PD-1 knockout (KO), for the treatment of lupus nephritis (LN) and extrarenal lupus (ERL). The Phase 1, multicenter, open label GALLOP clinical trial of CB-010 in patients with LN and ERL is expected to initiate by year-end 2024.
In March 2024, Artiva Therapeutics is looking to dose the first patient in a
Phase I/II trial assessing its cell therapy AlloNK in
lupus nephritis (LN).
Request a sample and discover the recent advances in lupus nephritis treatment drugs @
Lupus Nephritis Pipeline Report
The lupus nephritis pipeline report provides detailed profiles of pipeline assets, a comparative analysis of clinical and non-clinical stage lupus nephritis drugs, inactive and dormant assets, a comprehensive assessment of driving and restraining factors, and an assessment of opportunities and risks in the lupus nephritis clinical trial landscape.
Lupus Nephritis Overview
Lupus nephritis is a serious complication of systemic lupus erythematosus (SLE), an autoimmune disease that can affect multiple organ systems. In lupus nephritis, the immune system mistakenly attacks the kidneys, leading to inflammation and damage. The exact cause is not fully understood, but it is believed to involve a combination of genetic, hormonal, and environmental factors, including infections and exposure to certain drugs or UV light.
Symptoms of lupus nephritis can vary but often include swelling in the legs and feet, high blood pressure, foamy urine, and in severe cases, hematuria. Patients may also experience fatigue, joint pain, and skin rashes, typical of lupus. Diagnosis usually involves a combination of blood tests, urinalysis, and imaging studies. A kidney biopsy may be necessary to evaluate the extent of kidney damage and guide treatment.
Treatment for lupus nephritis aims to reduce inflammation and prevent kidney damage. It often involves corticosteroids and immunosuppressive medications such as mycophenolate mofetil or azathioprine. In severe cases, more aggressive treatments, including cyclophosphamide or biologic therapies like belimumab, may be utilized. Regular monitoring of kidney function and overall health is crucial for managing the disease effectively.
Find out more about lupus nephritis treatment drugs @
Drugs for
Lupus Nephritis Treatment
A snapshot of the Lupus Nephritis Pipeline Drugs mentioned in the report:
Learn more about the emerging lupus nephritis pipeline therapies @
Lupus Nephritis Clinical Trials
Lupus Nephritis Therapeutics Assessment
The lupus nephritis pipeline report proffers an integral view of the lupus nephritis emerging novel therapies segmented by stage, product type, molecule type, mechanism of action, and route of administration.
Scope of the Lupus Nephritis Pipeline Report
Coverage: Global
Therapeutic Assessment By Product Type: Mono, Combination, Mono/Combination
Therapeutic Assessment By Clinical Stages: Discovery, Pre-clinical, Phase I, Phase II, Phase III
Therapeutics Assessment
By Route of Administration: Oral, Intravenous, Subcutaneous, Parenteral, Topical
Therapeutics Assessment
By Molecule Type: Recombinant fusion proteins, Small molecule, Monoclonal antibody, Peptide, Polymer, Gene therapy
Therapeutics Assessment
By Mechanism of Action: Interferon alpha-beta receptor antagonists, Cell death inhibitors, Cell death stimulants, Antibody-dependent cell cytotoxicity, B-cell activation factor receptor antagonists, Glucokinase stimulants, Dendritic cell inhibitors, Complement factor D inhibitors, Complement C3 inhibitors, Proteasome inhibitors, Natural killer cell replacements, Immunologic cytotoxicity; T lymphocyte replacements
Key Lupus Nephritis Companies: AstraZeneca, Hoffmann-La Roche, Novartis, Qilu Pharmaceutical, Vera Therapeutics, Conduit Pharmaceuticals, Amgen, Johnson & Johnson, BeiGene, RemeGen, Argenx, Kyverna Therapeutics, Cabaletta Bio, ImmPACT Bio, Alpine Immune Sciences, AlloSite Therapeutics, iCell Gene Therapeutics, Caribou Biosciences, Adicet Bio, Shenzhen Pregene Biopharma Co., Ltd., Resolve Therapeutics, BioAegis Therapeutics, Lepton Pharmaceuticals, Transcenta Holding, and others.
Key Lupus Nephritis Pipeline Therapies: Anifrolumab, Obinutuzumab, Ianalumab, QLG1074, Atacicept, AZD1656, Daxdilimab, Nipocalimab, Zanubrutinib, Telitacicept, Efgartigimod alfa, KYV-101, CABA-201, IMPT-514, Povetacicept, ONT01, BCMA-CD19 cCAR T cells, CB-010, ADI-001, PRG-2311, RSLV-621, Recombinant human plasma gelsolin, LN-008, TST 008, and others.
Dive deep into rich insights for new drugs for lupus nephritis treatment, visit @
Lupus Nephritis Drugs
Table of Contents
For further information on the lupus nephritis pipeline therapeutics, reach out @
Lupus Nephritis Treatment Drugs
Related Reports
Lupus Nephritis Epidemiology
Lupus Nephritis Epidemiology Forecast – 2032 report delivers an in-depth understanding of the disease, historical, and forecasted lupus nephritis epidemiology in the 7MM.
Lupus Nephritis Market
Lupus Nephritis Market Insights, Epidemiology, and Market Forecast – 2034 report delivers an in-depth understanding of the disease, historical and forecasted epidemiology, as well as the market trends, market drivers, market barriers, and key lupus nephritis companies, including
NOVARTIS, MORPHOSYS, ASTRAZENECA, ROCHE, KEZAR LIFE SCIENCES, ALEXION PHARMACEUTICALS, CABALETTA BIO, among others.
Systemic Lupus Erythematosus Market
Systemic Lupus Erythematosus Market Insights, Epidemiology, and Market Forecast – 2034 report delivers an in-depth understanding of the disease, historical and forecasted epidemiology, as well as the market trends, market drivers, market barriers, and key SLE companies, including
Biogen, Novartis, MorphoSys, Idorsia Pharmaceuticals, Viatris, RemeGen, UCB Pharma, Genentech, Bristol Myers Squibb, AbbVie, among others.
Systemic Lupus Erythematosus Pipeline
Systemic Lupus Erythematosus Pipeline Insight
– 2024 report provides comprehensive insights about the pipeline landscape, pipeline drug profiles, including clinical and non-clinical stage products, and the key myasthenia gravis companies, including
Yake Biotechnology, UCB, Sorrento Therapeutics, SinoMab Bioscience Ltd, Shanghai Junshi Biosciences, Sareum, Sanofi, Roche, Rheos Medicine, Resolve, Provention Bio, Pfizer, Novartis, Neovacs, Merck, Medsenic, Landos Biopharma, Kezar Life Sciences, Kangpu Biopharmaceuticals, Janssen Research & Development, Janssen, InnoCare, ImmuPharma, I-MAB Biopharma, ILTOO, Idorsia Pharmaceuticals, Horizon Therapeutics, Genovax, Exinda Thearapeutics, Equillium, Eli Lilly and Company, Eisai, Daiichi Sankyo Company, Corestem, Corbus Pharmaceuticals, Citryll BV, Chipscreen Biosciences, Carna Bioscience, Bristol-Myers Squibb, Brickell Biotech, Boston Pharmaceuticals, Biogen, Athos Therapeutics, Asahi Kasei Pharma, Aria Pharmaceuticals, Antengene Therapeutics, Amgen, Alpine Immune Sciences, Akeso Biopharma, AbbVie, among others.
About DelveInsight
DelveInsight is a leading Business Consultant and Market Research firm focused exclusively on life sciences. It supports pharma companies by providing comprehensive end-to-end solutions to improve their performance. Get hassle-free access to all the healthcare and pharma market research reports through our subscription-based platform PharmDelve
.
Contact Us
Shruti Thakur
[email protected]
+14699457679
Logo:
SOURCE DelveInsight Business Research, LLP
WANT YOUR COMPANY'S NEWS FEATURED ON PRNEWSWIRE.COM?
440k+
Newsrooms &
Influencers
9k+
Digital Media
Outlets
270k+
Journalists
Opted In
GET STARTED

临床申请
2024-09-06
TIS2024第四届自免疾病细胞疗法与干细胞疗法论坛重磅来袭,点击图片查看重磅嘉宾,合作详询:王晨 180 1628 8769
(扫码立即报名获取TIS2024免费票)
文章来源:舟渡资本
1.0
安全有效的免疫重置 - 自身免疫疾病的圣杯
1.0
在医学的广阔天地中,自身免疫性疾病如同一位隐匿的侠客,悄然影响着全球约5-10%的人口。这些疾病的起因是体内免疫大军误将自身抗原视为敌军,从而掀起了一场无休止的内战。尽管在某些战役中,我们仍然难以识别出引发冲突的特定抗原表位,但免疫大军的多克隆激活,以及B或T淋巴细胞的选拔缺陷和反应模式的变异,却催生了一支自身反应性的队伍,它们携带着自身抗体在战场上制造着组织损伤与炎症。
事实上,自身免疫疾病是一个约80种疾病的总称,影响着全球约十分之一的人口[1]。尽管其对应分类和治疗手段不尽相同,但对于严重患者来说,传统的治疗方法使用大量的糖皮质激素暴露并持续接受免疫抑制剂,这样的治疗方案副作用较高、感染风险高、对患者的生活质量有较大的影响且无法完全控制病情。
针对部分具有明确自身反应性B细胞的疾病,在如系统性红斑狼疮(systemic lupus erythematosus, SLE)患者体内的B细胞会将身体的一部分误识别为外来物质并进行攻击,因此科学家们试想:如果我们开发出一种能够摧毁自反应性B细胞的药物,患者是不是就能摆脱那些产生狼疮的可怕抗体?
应该说答案是肯定的。早在2002年,后来成为了英国风湿学会主席的David Isenberg及其团队便首次将B细胞耗竭理念推向临床。对于六名20到40岁、患有活动性 SLE 、且对标准免疫抑制治疗耐药的女性患者,Isenberg团队给予两次500 mg 利妥昔单抗输注、两次 750 mg 环磷酰胺输注和大剂量口服皮质类固醇。结果显示,除了1名患者出现神经损伤并导致3个月后失访,其余5名患者的病情评估均实现了大幅改善,且该疗法的安全性整体良好,B细胞的清除似乎并不会引起严重感染[2]。
备注:纵坐标系使用的英国系统性红斑狼疮评估组 (BILAG) 指数是评估 SLE 疾病活动性的一种常用工具,如果 BILAG 总评分超过 10 分,通常认为疾病活动性为中度或以上
治疗初见响应固然使人兴奋,但对于免疫科医生来说,临床的终极目标仍然是让患者100%的进入缓解期,从而避免身体的器官受到进一步的损害。因此,Isenberg团队后续对参与实验并能持续随访的5位患者进行跟踪,在平均随访时间约为12.6个月时发现,2位患者的BILAG评分处于较低水平(5分和3分)并减少了口服泼尼松龙的剂量,但另外两位患者则分别在7个月和8个月时复发。
也就是说,尽管针对B细胞的抗体治疗的效果初见曙光,但并非每位患者均能对单抗类药物响应,理想中像电脑恢复出厂设置般一键进行“免疫重置”并未能如愿出现。
事实上,在后续针对SLE和狼疮性肾炎的两项双盲对照实验中,在维持背景治疗并进行安慰剂对照的基础上,利妥昔单抗治疗组在第52周时均未能达到有效性的主要终点[3],尽管两项试验在部分亚组(如EXPLORER中的非裔和西班牙裔)、部分血清标志物(如LUNAR中的抗dsDNA水平)均有显著改善,且治疗组整体的安全性与对照组相当[4,5]。
备注:通常认为清除B细胞的疗法可能会伴随严重的感染,有意思的是,或许是因为患者疾病本身接受抗体治疗后身体状态改善的原因,安慰剂组的感染和严重感染比例反而在两项双盲对照实验中更高。在下一代CD20单抗药物Obinutuzumab(糖基化修饰增强FcγRIII端效应,可以更有效的耗竭B细胞)的双盲对照试验中也观察到相似的组间安全性数据,即用药组的感染和严重感染比例均低于安慰剂组 (NCT02550652)[6]
基于Isenberg团队工作和EXPLORER研究的阴性结果,2006年仍在攻读博士的Edward M. Vital试图探究是什么原因导致了利妥昔单抗较低的有效率。在其2011年发表的一篇文章中,Edward团队评估了39名活动性的SLE患者并对其B细胞组成进行了分析。
他们发现可能有两个原因导致了这些患者无法得到长期缓解:
(1)CD20单抗无法有效地清除组织中的B细胞。
(2)记忆B细胞和浆细胞的数量对于区分早期复发患者和持续响应患者起到了重大的影响[7]。
简而言之,B细胞清除的深度(从血液到组织)和广度(从成熟B细胞到浆细胞)的不足可能是早期疗法未能实现免疫重置的原因,这也为未来新一代疗法的开发方向做出了提示。
事实上,欧洲和美国均有采用淋巴细胞消融术结合自体或异体造血干细胞移植治疗多种严重自身免疫疾病的案例,试图以更高强度地清除B细胞而实现更佳疗效。在对1300多名患者的观察性研究中,3至5年移植后有43%至71%的自身免疫疾病患者实现了长期无药缓解,但是,高达5%至7%的治疗相关死亡也限制了这类方法的应用前景 [8,9]。
2019年,已成为利兹大学医学院副教授的Edward Vital从David Isenberg手中接过了英国系统性红斑狼疮评估组组长的职位,并仍然致力于寻求更好的新疗法、更理想的免疫重置方法和对系统性红斑狼疮患者的教育。
备注:前排左三David Isenberg 教授,前排左四Edward Vital(图片来源:X/Twitter)
时间快进到2020年,我国成都军区总医院的刘芳医生和北京大学深圳医院张宏宇医生公布了一项采用CD19和BCMA双靶点CAR-T疗法的案例,该案例针对一名41岁新诊断 IV 期弥漫性大 B 细胞淋巴瘤伴随20年SLE病史的患者,医生团队使用了氟达拉滨和环磷酰胺的预处理方案和5.3×106/kg 剂量的CAR-T,成功地在28天时实现淋巴瘤的完全缓解,并且使得患者的各项抗核抗体水平均显著下降[10]。
在后续的跟踪报道中,该名患者的B细胞在260天后恢复,23个月时SLE和淋巴瘤症状缓解,治疗整体安全性良好[11]。虽然这个案例并非单纯地针对自身免疫疾病,但相比于更早期实验的抗体疗法、造血干细胞移植疗法而言,我们似乎距离理想中免疫重置更近了一步。
也许是遵循着业界向更全面地消耗B细胞的共识探索,亦或许是受到中国团队经验的启发,来自德国埃朗根-纽伦堡大学(Friedrich-Alexander-Universität Erlangen-Nürnberg, FAU)的Georg Schett 教授对于探索CAR-T疗法是否可以帮助自身免疫疾病患者重置免疫系统,并实现深度的无药物缓解产生了浓厚的兴趣。
(“So the idea was that when you could deplete B cells as good as in cancer in lymphoma leukemia in autoimmune disease that you could really reset the entire disease and allow a deep drug-free remission in these patients”)
Georg Schett 教授(图片来源:Simone Kessler/Uniklinikum Erlangen)
1.1
一次治疗,长期缓解
2021年8月,Georg Schett教授团队在新英格兰医学杂志上发表一篇病例研究,报告了一位关节、肾脏、心脏、肺部累及的严重SLE的女性患者,在各种标准药物均复发耐药后,该患者接受CD19 CAR-T细胞治疗,并在第44天时SLE疾病活动指数从16分降至0分,未出现明显副作用,患者停用所有药物 4 个月后依然没有复发[12]。尽管只有 1 例患者,且仅仅观察了 4 个月,但“无药缓解”、“血清学指标恢复正常”、“尿蛋白水平快速回落”等关键词迅速吸引了自免领域众多专家的关注。
因为其预示了我们向免疫重置的方向更近了一步:CD19 CAR-T 通过攻击浆母细胞带来抗体水平的快速下降和患者症状的持续缓解,且鉴于B细胞在多种严重自身免疫性疾病中起关键作用,自身免疫疾病在B细胞这个环节被切断后,就如同纸牌屋一样层层塌下,为患者带来长期无药缓解—一种彻底改变自免疾病治疗格局的疗法[13]。
Schett团队很快就为这一激动人心的想象添了一把火:2022年9月其团队在《Nature Medicine》中报道了5名难治性SLE患者(包括4名女性和1名男性)接受CD19 CAR-T细胞治疗的结果,所有患者的狼疮性肾炎均被治愈,血清补体、抗双链DNA抗体恢复正常。此外,CAR-T治疗后SLE相关其他症状如关节炎、疲劳、心脏瓣膜纤维化等消失,在后续随访中所有患者都实现了无药物缓解,最长观察期达到了 17 个月[14]。
已然没有什么能阻挡Schett进一步探索的步伐,SLE 领域接连的成功,让他有信心转向其他复杂的自免疾病。2023年3月,其团队在《Lancent》上报道了 1 例抗合成酶抗体综合症(ASS)的病例报告,该男性患者经历了持续 18 个月的活动性肌炎,口服激素控制不佳后,利妥昔单抗治疗也无法抑制肌炎活动,甚至出现了呼吸困难的症状。
经CD19 CAR-T细胞治疗后,抗合成酶抗体成功被消除,症状得到完成缓解,肌肉、关节的炎症几乎完全消失了,肺泡炎影像学表现完全消失,肌肉力量和耐力也恢复了,CD19+ B 细胞在100天重新出现,患者无药缓解期长达180 天(CAR-T 细胞治疗后)。
2023年12月,作为对Cartesian 有关治疗重症肌无力mRNA工程化自体CAR-T疗法的1b/2a期临床研究结果的回应[15],Schett团队又在《The Lancet Neurology》上发表了CD19靶向CAR-T细胞疗法成功治疗了重症肌无力(MG)的病例报告。
在各类免疫抑制治疗均无法控制患者病情的情况下,该患者接受CD19靶向CAR-T细胞治疗2个月后,肌力和疲劳状况得到显著改善,患者能够水平伸出手臂的时间稳步增加,在没有任何辅助设备的情况下行走能力显著增强,医生计划停用维持剂量的免疫抑制剂[16]。
七名成功参与CAR-T疗法实验的自免患者(图片来源:SIMOarts/Simone Kessler)
将自免细胞治疗的热情推向高潮的是Schett在 2023 年 12 月美国血液学年会上的汇报:接受 CD19-CART 治疗的15名自身免疫病患者中包括8名SLE、4名系统性硬化症患者(SSc)和3名特发性炎性肌病患者(IIM),所有SLE患者均达成DORIS标准缓解,所有IIM患者均达到美国风湿病学会/欧洲抗风湿病联盟制定的主要临床缓解标准,所有SSc患者的欧洲抗风湿病联盟硬皮病试验研究组(EUSTAR)活动指数评分下降。
在15个月的中位随访期内,所有患者体内的自身抗体消失,且成功停用包括糖皮质激素在内的免疫抑制药物。该结果随后发表在新英格兰医学杂志上[17]。
今年的2024欧洲风湿病学大会(EULAR 2024)上,Schett团队更新了以上15名患者的随访数据,12名患者的随访时间超过了1年,中位随访时间达18个月。所有患者均保持临床缓解,且并未重启任何免疫抑制治疗。安全性方面,1名患者在治疗120天后出现4级中性粒细胞减少症[18]。
Georg Schett教授在一篇新闻稿中自信的表示:“我们相信我们已经成功地找到了像计算机一样工作的重置按钮,可以毫无错误地重新启动免疫系统”[19]。毫不意外的,细胞治疗用于自身免疫疾病成为了热议的话题,感受到美国医药投资市场复苏春风的投资人都在问:有自免细胞治疗的项目吗?
1.2
工业界的火爆开发热情- A tide will lift all boats
Schett的研究无疑为适应症局限于血液瘤的细胞疗法注入了新的强心剂,一系列成功试验的顺利报道也推动了医学界和投资界对于细胞疗法或者其他相关方案用于免疫重置的疗法的投入热情。
我们也迎来了许多项振奋的并购、大额IPO和应接不暇却不约而同转向自身免疫疾病战场的战略更新,一股“免疫重建”的热潮席卷了工业界和投资界:
信息来源:公开信息
以上仅不完全列举了部分信息,还有更多的细胞治疗(无论自体或异体),以及新一代抗体类药物企业,均以自己独到的理解对“免疫重置”这个目标发起了冲锋。
2.1
2.1
Cell Therapy in Autoimmune is
a well de-risk play
在对第一部分的回顾中,我们得以洞察细胞疗法应用于自身免疫疾病的发展并非一蹴而就。在近两年医疗投资界中,“降低风险的投资”(De-risk)已成为一个热门词汇,投资者在寻求下一个突破性疗法的同时,也渴望尽可能降低药物研发中面临的不确定性,而细胞治疗用于自身免疫疾病也成为了一个风险被充分释放的方案。
站在肿瘤治疗的肩膀上:
由于CD19和BCMA靶点作为均已在肿瘤治疗领域获批,产业链、生产工艺和临床应用逐渐成熟。因此细胞治疗用于自身免疫疾病,更像是一个良好的工具终于找到了它的最佳应用场景,并且工业界和临床医生完全可以利用肿瘤领域中学习到的经验进一步提升产品设计、生产工艺、成本控制的能力。
以货架型细胞治疗,如基因编辑CAR-T、CAR-NK等疗法为例,近年来在肿瘤领域披露的临床数据可以说没有达到业界曾经的预期。这其背后的原因可能是因为该类细胞在肿瘤体内存续短暂,在体内面对数量级较高的恶性B细胞时力不从心。但是在自身免疫疾病领域,这类疗法的劣势有可能会转化为一定的优势。
目前已有的临床数据显示,自身免疫疾病患者体内的B细胞最早在6周时即可重建,且似乎B细胞的耗竭深度比耗竭的持久度更加重要。通用型细胞治疗公司Poseida Therapeutcis在最新的业绩展示时的表示也许代表了业界对于开发自身免疫疾病的普遍态度:“not so much whether we will do it, but how”。
考虑到现货型 CAR-T、CAR-NK疗法可以制成货架商品,且药物相关不良反应或许可以更加温和,未来有望拓展到门诊场景使用。如果该类疗法疗效和安全性得到验证,预计将会有广阔的应用空间。
跨国大药企纷纷展示出浓厚兴趣:
“功能性治愈的潜力以前从未实现过,(细胞治疗用于自身免疫疾病)可能会改变游戏规则”,在2024年4月份发表于Nature Reviews Drug Discovery的观点文章中,百时美施贵宝研究主管Robert Plenge分享了BMS对于细胞治疗用于自身免疫疾病的独到见解[28]。
Plenge博士曾担任风湿科医生,他治疗的患者们常常因为无法摆脱长期服药的枷锁而感到失望。由于CAR-T疗法应用于自身免疫疾病的临床数据涌现,Plenge博士认为自身免疫疾病领域的治疗或许已经到达了一个历史性的转折点。
在中国,巨诺的CD19 CAR-T瑞基奥仑赛也在EULAR2024公布了SLE的初步临床数据,低剂量的3例受试者在6个月随访时临床指表仍在改善并停用了传统的激素和免疫抑制药。所有剂量组中,出现了1例的3级CRS和2例3级感染,没有神经毒性的报道 。[29]
遵循这一创新的研发逻辑,BMS公司正致力于推进CD19 NEX T产品的开发进程。BMS在2024年JP Morgan大会上展示了这一产品:一款通过工艺创新和得到的进阶版Breyanzi。
BMS相信CD19 NEX T有潜力应用于治疗包括系统性红斑狼疮、肌炎、多发性硬化症在内的一系列由B细胞介导的自身免疫性疾病。相较于血液肿瘤领域,这些自身免疫性疾病的患者群体预计将扩大5至10倍。
信息来源:2024 JPM BMS Investor Deck
在细胞治疗领域的竞争赛道上,BMS的竞争对手诺华公司展现出不屈不挠的研发势头。诺华正致力于开发一款创新的CD19 CAR-T产品——YTB323(rapcabtagene autoleucel),该产品采用了与已获批的Kymriah相同的CAR结构,并借助诺华的T-Charge平台进行制造,预期将缩短生产周期并提升T细胞的干性(“T-Charge preserves T cell stemness, the ability to self-renew and mature” [30])。
2023年美国风湿病学年会上,诺华展示了YTB323在治疗三位严重SLE患者(NCT05798117)的主要疗效和安全性数据。这些患者均接受了环磷酰胺和氟达拉滨的预处理,随访时间从28天至106天不等。结果显示,三位患者的SLEDAI-2K评分均有所下降,医生的总体评估评分从约75分降至15至40分,前两名患者的抗双链DNA(anti-dsDNA)抗体水平显著降低。
安全性方面,研究中未报告严重不良事件或死亡案例,患者1和2出现了细胞因子释放综合征(CRS,1级或2级),患者1和患者2出现了低丙种球蛋白血症(2级或3级)。这些初步数据为YTB323在SLE治疗中的潜力提供了积极的信号,同时也展示了诺华在推动CAR-T疗法应用于自身免疫疾病方面的坚定决心和科研实力。
信息来源:An Open-label, Multicenter, Phase 1/2 Study to Assess Safety, Efficacy and Cellular Kinetics of YTB323, a Rapid Manufacturing CAR-T Cell Therapy Targeting CD19 on B Cells, for Severe Refractory Systemic Lupus Erythematosus: Preliminary Results
在华尔街享有盛誉的Andrew Baum博士一直是采用细胞疗法治疗自身免疫疾病的坚定支持者。在其分析师生涯中的一次季度电话会议中,他曾公开鼓励诺华公司加快其细胞治疗产品在自身免疫疾病领域的研发进程。
Baum博士的报告中曾表达过这样的观点:“我们认为对于难治性自身免疫疾病而言,CAR-T细胞疗法是自2011年免疫肿瘤学重新兴起以来最具颠覆性和商业潜力的机会[31]”最近,Baum博士加盟辉瑞公司担任首席战略和创新官,这一新角色无疑让我们对辉瑞在细胞治疗自身免疫疾病领域的积极布局充满期待。
3.1
领域内的头部玩家一览
3.
简介:Kyverna Therapeutics是一家成立于2018年的企业,公司在上市前完成了共计1.8亿美元的融资,并于2024年2月份实现在纳斯达克的上市(Ticker:KYTX),募资3.19亿美元。
技术特色:KYV-101使用由美国NIH在Gilead/Kite的Yescarta结构基础上优化的CAR结构,差异化特点是采用了全人源CD19 CAR 结构域和优化的铰链和跨膜域(CD8α hinge and TM domains vs. CD28 hinge and TM domains),目标是提高提高药物的安全性。
同时,Kyverna也在和基因编辑企业Intellia公司合作,开发下一代的通用型基因编辑CAR-T疗法。目前, KYV-101处于临床一期阶段,公司开展了四项临床试验,分别针对系统性红斑狼疮、狼疮性肾病、重症肌无力和多发性硬化。
信息来源:2024 May Investor Deck,
KYV-101的药物结构和前20位患者临床数据展示
简介:Cabaletta Bio是一家成立于2017年的生物技术公司,公司最初是基于宾夕法尼亚大学的Aimee Payne博士和Michael Milone博士的(chimeric autoantibody receptor T cells)CAAR-T技术,致力于选择性的靶向和消除表达特异性自身抗原的B细胞,从而降低非特异性B细胞杀伤的风险。
然而,由于首发管线DSG3-CAART用于粘膜性天疱疮(mPV)的疗效欠佳,且全球各地CAR-T疗法用于自身免疫疾病案例的积累,Cabaletta Bio在2022年10月与驯鹿生物达成了合作协议,“驯鹿生物授予 Cabaletta其全人源CD19序列的全球独家开发、生产及商业化权利,应用于Cabaletta在自身免疫性疾病领域开发修饰T细胞的产品中[32]”。
而驯鹿则将获得1.62亿美元的首付款以及潜在开发和商业化里程碑付款和销售分成,至此,Cabaletta Bio也将公司的资源全力倾斜至CD19-CAR-T管线CABA-201上。资本市场方面,Cabaletta Bio在上市前完成了共计8800万美元的融资,并于2029年10月份实现在纳斯达克的上市(Ticker:CABA),募资7480万美元。
管线情况:Cabaletta 正在推进 CABA-201的临床1/2 期试验,用于治疗系统性红斑狼疮、天疱疮(探索无需清淋方案)、自身免疫性肌炎、系统性硬化症和全身性重症肌无力。
IR Deck中展示了产品的来源以及投资人应当关注的要点,值得学习:
信息来源:2024 May Investor Deck
公司简介:驯鹿生物成立于2017年,是一家致力于细胞治疗、全人源抗体等领域的产品研发、生产和销售,开发治疗癌症和自身免疫性疾病的突破性疗法的生物制药公司国内领先的细胞治疗企业。驯鹿的首发管线伊基奥仑赛注射液(福可苏®)已与2023年6月份获批上市,获批用于成人复发或难治性多发性骨髓瘤患者。
得益于全人源的靶向端CAR结构,福可苏®的疗效和安全性优异,目前处于高速的商业化销售阶段。在自身免疫疾病领域,驯鹿是国内最早将细胞治疗应用于自身免疫疾病的企业之一。公司的BCMA-CAR-T产品已积累了大量的IIT临床数据,ADCC增强的全人源CD19单抗产品应用于自身免疫疾病也处于临床1期。
管线情况:根据公开信息,驯鹿生物在该领域的布局非常全面:从靶点布局角度,公司拥有的全人源BCMA-CAR-T,全人源CD19单抗和CD19/CD22双靶CAR-T均已积累了较多的临床数据。从技术角度出发,公司的BCMA-CAR-T产品已于2023年6月获得NMPA批准上市,目前正在进行商业化销售,因此可以说公司在生产工艺成熟度生产和稳定性方面处于整个细胞治疗领域的前列。
同时,驯鹿生物也拥有较强的BD合作能力,公司的全人源CD19序列已成功授权了领域的龙头公司Cabaletta Bio,成为Cabaletta公司的市值核心支撑水平(实际上,自从Cabaletta获得驯鹿的授权,公司的股价已上涨十几倍);除Cabaletta外,公司还先后和海外细胞治疗公司Sana Therapeutics以及Umoja Biopharma达成了全球BD授权或研发合作,积极探索下一代细胞治疗产品的开发。
同时,公司已在内部搭建了下一代的iPSC-CAR技术平台,与外部的Sana Biotechnology、Umoja Biopharma包括体内CAR-T技术方面也和美国领先的的Umoja Biopharma
信息来源:公司官网
目前,根据驯鹿公司已发表的多篇临床报告,公司与其合作方已经在包括系统性红斑狼疮、狼疮性肾炎、免疫性血小板减少症、重症肌无力、免疫介导坏死性肌病和视神经脊髓炎谱系障碍、温抗体型自身免疫性溶血性贫血(wAIHA)等多个临床需求显著的自身免疫性疾病中布局。
简介:在2023年第四季度的电话会上,Nkarta管理层表示公司将降低NKX019(CD19 CAR-NK)项目在急性髓系白血病(AML)适应症研发的优先级,进而转向用于自身免疫性疾病。受到Schett团队工作的启发,公司认为自身免疫疾病中实现免疫重置相较于持久性更为关键“depth but not the duration of B-cell killing is key to driving clinical benefit in auto-immune disease”
技术特色:Nkarta公司为NKX019做了多方面的探索,包括针对NK细胞的药代动力学差异化设计的清淋策略、膜结合IL-15的持续刺激和新型共刺激域设计等等。NKX019的IND已于2023年第四季度获批,这项剂量递增试验将评估 NKX019 用于难治性狼疮性肾炎 (LN) 患者,患者在接受仅含环磷酰胺 (cy) 的清淋 (LD) 治疗后,接受三剂 NKX019 治疗,Nkarta公司预计将于2024年上半年提供临床进展的更新。
信息来源:2024 March Investor Deck, Nkarta的CAR-NK产品使用了不同的共刺激域设计,并在膜表面表达IL-15以促进细胞在体内的存续
简介:Cartesian Therapeutics(Ticker: RNAC)是全球第一家基于mRNA技术应用细胞疗法用于自身免疫疾病治疗的公司,目前正在推进其核心产品Descartes-08处于临床2b期开发。Cartesian在2023年11月通过反向合并Selecta Biosciences完成上市,也许是因为采用了不太传统的上市路径,其因此目前的市场关注度还相对较低,2024年5月份的市值约为5亿美元。
有意思的是,哈佛医学院医学知名教授、Selecta Biosciences和Moderna公司的联合创始Timothy Springer个人对Cartesian投资了6000万美元。Timothy教授已经成功参与了多家企业的创立和孵化,根据其在哈佛官网的个人简介,2008-2016年间刨去创始人干股,其个人投资的IRR达到惊人的78%[33]。
技术特色:公司的核心管线Descartes-08是一款使用自体的、mRNA编码的、靶向BCMA的CAR-T细胞疗法(也被称为rCAR-T)。或许由于mRNA改造的CAR-T细胞天然的存续期较短的原因,Descartes-08在临床上安全性较好,展现出来的CRS和ICANS风险似乎更低,并且目前已经做到门诊15分钟的给药。但是,也同样归咎于较短的存续期原因,Descartes-08需要每周一次、连续6周给药,目前小样本的数据中超过70%的患者持续性可达1年。
简而言之,Descartes-08的特别之处在创造了一种更像生物制剂的细胞疗法。努力在疗效和给药便利性中平衡。Descartes-08目前处于临床2期,临床1期中初步治疗后在7名重症肌无力患者在治疗后9个月疾病持续改善,无CRS/ICANS迹象。5名患者在第12个月保持了临床改善,12个月时病情反弹的患者中,1名接受重新治疗后临床评分迅速改善。公司预计于2024年中期提供随机双盲、安慰剂对照的2b期数据更新(N=30)。
投资者交流中的临床数据展示:
信息来源:2024 May Investor Deck, 首篇7例患者文章已于2023年7月份发表在Lencet Neurology (https://doi-org.libproxy1.nus.edu.sg/10.1016/S1474-4422(23)00194-1),该同试验的12个月跟踪文章预印版已于2024年1月份公开(https://doi-org.libproxy1.nus.edu.sg/10.1101/2024.01.03.24300770)
公司简介:ImmPACT Bio是美国加州的一家临床阶段的细胞治疗公司,公司基于加州大学洛杉矶分校Yvonne Chen 副教授和Sarah Larson 医生的工作成立,其致力于打造差异化的CAR-T疗法以使得产品可以有效的区分癌变细胞和健康细胞,从而实验更精准的靶向治疗。公开信息显示,ImmPACT Bio在2024年初完成了由Foresite Capital, Decheng Capital和venBio领投的B轮融资,融资规模达1.4亿美元。
技术特色: 2023年8月,IMPT-514获得FDA一项开放标签 1b/2 期剂量递增试验IND申请的批准用于治疗活动性、难治性SLE,ImmPACT Bio预计首例患者将在2024年初给药[34]。
IMPT-514是公司的一款双特异性CD19/CD20 CAR-T疗法,其CAR结构和该公司的肿瘤治疗产品IMPT-314相同,而IMPT-314的最初开发目标是通过双靶点的覆盖以解决肿瘤中的抗原丢失/免疫逃逸问题。根据公司发表的数据,相同结构的IMPT-514在B细胞淋巴瘤实验中优异的安全性数据(无ICANS、1例CRS)[35]。
信息来源:ImmPACT Bio公司官网
公司简介:iCell Gene Therapeutics成立于2014年,公司是基于约州立大学石溪分校Yupo Ma病理学教授开发的技术发展而成。公司官网显示,iCell的适应症开发方向包括T细胞淋巴瘤、急性髓系白血病、SLE、多发性硬化和实体肿瘤。
iCell团队开发的产品被称为compound CAR-T(cCAR-T),其在一个结构中具有两个独立靶向功能的 CAR。公司的首款自身免疫疾病的产品靶向BCMA和CD19两个靶点,旨在通过两个靶点的覆盖在短期内快速实现完全的免疫重置“transient depletion of B-cells and plasma cells”。
管线情况:在2024年5月份 Annals of the Rheumatic Diseases期刊中,iCell公司报告了其BCMA-CD19 cCAR-T应用于SLE/LN的IIT试验的积极结果。该项试验在我国中山市人民医院和北京大学深圳医院开展,并进行了长达46个月的随访。
具体来说,所有患者在治疗前停用了所有药物,10名LN患者接受单次剂量为3x106 /kg 的cCAR-T疗法,并在接受治疗10天和42天后观察到外周血B细胞和免疫球蛋白耗尽。在治疗2-6个月后,患者的B细胞和IgM实现了恢复。
临床有效性方面的报道中,所有接受目标剂量的狼疮患者(12/13)在接受 cCAR 治疗 3 个月后,自身抗体(包括来自长寿浆细胞的抗体)均呈阴性,补体恢复正常水平。患者在接受 cCAR 治疗后随访 46 个月后达到无症状和无药物缓解 。
平均SLEDAI-2K指数从 基线9.9降至 3 个月2.3。业界关心的安全性问题上,cCAR疗法表现出良好的耐受性,仅出现轻度细胞因子释放综合征(无CRS >1),没有出现ICANS和1例一级尿路感染。下一步,iCell计划在中国和美国开展临床试验研究。
信息来源:公司官网
3.2
3.2
领域未来的催化剂
2024 年注定是细胞免疫治疗飞速发展的一年,让我们来看一下上市公司中有哪些有望进一步引爆关注的「重要催化剂」,望你我都赶上“时代前沿”。
信息来源:公司官网
4.1
4.1
Take Away-该领域值得关注的问题
在本篇报告的撰写过程中,我们团队不可避免地面临了一系列的疑问。为了深入探讨这些问题,我们计划从技术和临床的角度出发,进行了一波自问自答。
期望这一探索的过程不仅能够澄清我们自身的疑惑,同时也能够为投资者在这一领域的某些疑问提供精确且详实的答案。
Q1:用细胞治疗这个治疗模式时,面对CD19、BCMA 或其他B细胞靶点甚至B细胞双靶点,哪个靶点或组合会最终胜出?
A1:目前还没有完美的答案,但我们知道的是相比与 CD19,BCMA 能更深度的清除骨髓中的浆母细胞、浆细胞等长寿细胞,如果患者使用 CD19 细胞疗法无法达到长期的无药缓解,或许说明进一步清空浆细胞更为合适。
目前,Schett团队的CD19CAR-T治疗组中一位自免性肌炎患者已在1.5年后发现复发,并且对于再次使用CD19CAR-T治疗无响应,预计该患者将可适用于BCMA CAR-T进一步治疗。关于不同疾病人群靶点选择,还需要进一步数据增加帮助建立筛选体系以及更深刻的疾病生物学理解。
Q2:自免领域会不会是NK细胞或者异体T细胞弯道超车的赛道?
A2:根据目前的临床数据,我们可以观察到CAR-T 在自免患者体内的 PK明显短于肿瘤患者,有些患者在 6 周的 B 细胞耗竭之后就开始重建,但是目前的随访数据并没有类似肿瘤的疾病复发。
由于自免疾病长期缓解的关键在于B 细胞耗竭的深度和广度,耗竭的持久性在自免疾病中可能没有那么重要,所以我们或许可以期待在肿瘤领域耗竭持久性不佳的 CAR-NK和异体CAR-T疗法可以在自免治疗中也许会取得不错的表现,目前也已经有许多临床前的数据可查阅,我们也期待相关企业进一步的临床数据披露。
尽管目前以海外Schett团队、国内驯鹿生物和iCell为代表的多项临床数据为领域树立了很高的标准,我们不认为细胞治疗将100%地使患者实现长期缓解。事实上,如果一款新型的药物可以使得超过50%的自免患者均实现至少3年的长期无复发率,将对于相关患者来说非常有吸引力。
Q3:自免细胞治疗热潮下,如何看抗体治疗自免疾病的未来?
A3:前文提到的一些早期失败案例主要是利妥昔单抗,而利妥昔单抗作为一个融合抗体,它的亲和力一般,通常无法有效清除淋巴内的 B 细胞。尽管目前还没有足够的证据显示“多深”的 B 细胞清除可以达到免疫重置,但从目前已有的数据来看似乎抗体药物无法达到CAR-T 治疗的B细胞耗竭水平。然而,从患者人群、给药便利性和卫生经济学等角度考虑,对于非复发难治、多系统累及的自免病人,一款可在一定程度上耗竭 B 细胞的抗体产品是一个合适的选择。
另外,以CD3细胞连接器为例的双功能抗体可能也会在自身免疫疾病发挥一定的作用。近期,Schett团队采用CD19/CD3T细胞连接器Blincyto成功治疗了6例类风湿性关节炎患者的案例在Nature Medicie发布,由于患者并没有展现出CRS、ICANS、中性粒细胞减少等在肿瘤中令人担忧的安全性问题,且初步临床疗效较好,该实验的涟漪效应使得刚刚改名为Cullinan Therapeutics的股价大涨。
然而,实验显示受试者在接受双抗治疗后的持续性不足,已有多例患者重新的炎症反应卷土重来并不得不用其他生物制剂以控制疾病,因此我们不认为双抗疗法可以替代细胞疗法展现出的强大免疫重置能力。
Q4:CAR-T 治疗在肿瘤治疗中的最新黑框警告是否会影响其在自免疾病中的应用?
A4:考虑到癌症人群中 T 细胞淋巴瘤的发病率远高于一般人群,且 FDA 关注的案例在输注 T 细胞前就存在 T 细胞肿瘤的突变,后续 CAR-T 治疗引发继发肿瘤的风险仍有待观察。考虑到自免患者更低的平均年龄、更少的化疗暴露、更低的突变风险,CAR-T治疗在自免领域的安全性担忧可能比肿瘤领域轻。
另外,已有研究显示清淋方案似乎会一定程度的提高继发性淋巴瘤的可能,因此,包括Cartesian Therapeutics和Cabaletta Bio 在内的许多领域玩家均在探索减少甚至消除在自免患者中清淋或预处理的使用,但该类尝试是否会导致“免疫重置”疗效的损失仍需更长期的数据来验证。
5.1
5.1
结尾
图片来源:BMC Blog Chimeras: from Greek myth to scientific reality?
在古希腊神话的叙事传统中,奇美拉(Chimera)作为一种融合多种生物特征的神话生物,象征着自然界的混沌与破坏。然而在现代医学的领域,我们目睹了一种创新的转变:将奇美拉的混合特性转化为一种治疗策略。
通过在T细胞表面嵌合特定抗体,科学家们巧妙地引导了这一潜在的生物力量,将其驯服为一种精准的CAR-T疗法。我们期待这种现代医疗领域的奇美拉,以其独特的设计和功能,未来在医学史上留下浓墨重彩的一笔。
展望未来十年,我们憧憬在自身免疫疾病领域能够重现肿瘤学界“Emily效应”的奇迹,我们期望见证那些经历新疗法的自身免疫疾病患者,有朝一日也能够健康地手持“10 years clinical remission”的标识,成为激励肿瘤及自身免疫疾病患者战胜病魔的坚定勇气和希望的象征。
本故事旨在提供信息和启发思考,而非医疗指导。在做出任何健康相关的决定时,请务必咨询合格的医疗专业人士。文章中信息均来自公开讲座、文献报道、公司官网和研究报告等渠道。
上下滑动阅读更多内容
数据来源:
1.Sullivan, Keith M et al. “Hematopoietic cell transplantation for autoimmune disease: updates from Europe and the United States.” Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation vol. 16,1 Suppl (2010): S48-56. doi:10.1016/j.bbmt.2009.10.034
2.Farge, Dominique et al. “Autologous hematopoietic stem cell transplantation for autoimmune diseases: an observational study on 12 years' experience from the European Group for Blood and Marrow Transplantation Working Party on Autoimmune Diseases.” Haematologica vol. 95,2 (2010): 284-92. doi:10.3324/haematol.2009.013458
3. Liu F, Zhang H, Wang X, et alTHU0036 FIRST-IN-HUMAN TRIAL OF BCMA-CD19 COMPOUND CAR IN THE TREATMENT OF AUTOANTIBODY MEDIATED DISORDERSAnnals of the Rheumatic Diseases 2020;79:231.
4.Zhang, Wenli et al. “Treatment of Systemic Lupus Erythematosus using BCMA-CD19 Compound CAR.” Stem cell reviews and reports vol. 17,6 (2021): 2120-2123. doi:10.1007/s12015-021-10251-6
5.Dimitrios Mougiakakos et al. CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus. NEJM, 2021, doi:10.1056/NEJMc2107725
.
6.Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus
7.CD19-targeted CAR-T cells in refractory antisynthetase syndrome
8.Safety and clinical activity of autologous RNA chimeric antigen receptor T-cell therapy in myasthenia gravis (MG-001): a prospective, multicentre, open-label, non-randomised phase 1b/2a study. Lancet Neurol 2023
9.Anti-CD19 CAR T cells for refractory myasthenia gravis
10.CD19 CAR T-Cell Therapy in Autoimmune Disease —A Case Series with Follow-up
11.Revolutionary cell therapy: Restarting immune system switches off autoimmune diseases. FAU Erlangen-Nürnberg.
12.Cullinan Therapeutics Announces Strategic Expansion Into Autoimmune Diseases
13. Eliem Therapeutics Announces Agreement to Acquire Tenet Medicines and Concurrent $120 Million Private Placement
14. Kyverna IPO adds to biotech momentum with $319M fundraise
15.阿斯利康将收购亘喜生物,加深肿瘤和自身免疫性疾病领域的细胞疗法布局
16.Selecta Biosciences Announces Merger with Cartesian Therapeutics
17.NKARTA receives FDA clearance of IND application for NKX019 in lupus nephritis.
18.Nkarta Announces Pricing Of $240 Million Underwritten Offering
19.Cabaletta Bio Announces Closing of $100 Million Public Offering of Common Stock
20.Three-step cures for autoimmune diseases?
21.Poltreg公司投资者展示(原文出处未知)
22. 驯鹿生物和Cabaletta Bio共同宣布就经临床验证的CD19序列达成全球独家许可协议
23.Timothy A. Springer, PhD – Harvard University faculty profile
24.An open-label, single arm, multicenter study to evaluate relmacabtagene autoleucel, the CD-19 directed CAR-T cell therapy, for active systemic lupus erythematosus in China
25.Charging towards the next-generation of CAR-T – Novartis website
26.Incidence, prevalence, and co-occurrence of autoimmune disorders over time and by age, sex, and socioeconomic status: a population-based cohort study of 22 million individuals in the UK
2.Leandro, Maria J et al. “An open study of B lymphocyte depletion in systemic lupus erythematosus.” Arthritis and rheumatism vol. 46,10 (2002): 2673-7. doi:10.1002/art.10541
27. Abid, Naushad et al. “The Safety and Efficacy of Rituximab and Belimumab in Systemic Lupus Erythematosus: A Systematic Review.” Cureus vol. 15,6 e40719. 21 Jun. 2023, doi:10.7759/cureus.40719
28.Merrill, Joan T et al. “Efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus: the randomized, double-blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial.” Arthritis and rheumatism vol. 62,1 (2010): 222-33. doi:10.1002/art.27233
29.Rovin, Brad H et al. “Efficacy and safety of rituximab in patients with active proliferative lupus nephritis: the Lupus Nephritis Assessment with Rituximab study.” Arthritis and rheumatism vol. 64,4 (2012): 1215-26. doi:10.1002/art.34359
30.Furie, Richard A et al. “B-cell depletion with obinutuzumab for the treatment of proliferative lupus nephritis: a randomised, double-blind, placebo-controlled trial.” Annals of the rheumatic diseases vol. 81,1 (2022): 100-107. doi:10.1136/annrheumdis-2021-220920
31.Vital EM, Dass S, Buch MH, Henshaw K, Pease CT, Martin MF, Ponchel F, Rawstron AC, Emery P. B cell biomarkers of rituximab responses in systemic lupus erythematosus. Arthritis Rheum. 2011 Oct;63(10):3038-47. doi: 10.1002/art.30466. PMID: 21618204
END
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
TIS2024第四届免疫细胞疗法与干细胞疗法论坛重磅来袭,合作详询:王晨 180 1628 8769
细胞疗法临床结果临床研究
2024-08-31
TIS2024第四届自免疾病细胞疗法与干细胞疗法论坛重磅来袭,点击图片查看重磅嘉宾,合作详询:王晨 180 1628 8769
(扫码立即报名获取TIS2024免费票)
生物技术公司正在使用 CAR-T 细胞来靶向 B 细胞——不是为了治疗血液肿瘤,而是为了治疗多发性硬化症和一系列自身免疫性疾病。
多发性硬化症中的神经元会受到自身抗体和炎症的损害。
2024 年 3 月发表的第一项临床研究结果表明,工程化 CAR-T 细胞可以消除进行性多发性硬化症中的致病性 B 细胞。Kyverna Therapeutics 发布的这些早期结果为这个已经蓬勃发展的领域增添了动力。6 月,iCell Gene Therapeutics 在维也纳欧洲风湿病协会联盟大会上提出的一项针对系统性红斑狼疮 (SLE) 患者的1 期研究表明,CAR-T 疗法消除了 12 名接受治疗的患者中 11 名的所有自身抗体。那些疾病有响应的人在长达 4.5 年内没有疾病且无需药物治疗。受到其他早期临床研究的安全性和结果的鼓舞,一些公司和学术中心正在启动试验来测试这种治疗自身免疫性疾病的新方法(表 1)。
表1 自身免疫性疾病临床试验中的CAR-T细胞疗法统计
CAR-T疗法是活体药物。为了制造它们,通常会从人体中取出 T 细胞,并进行基因改造,以产生识别特定目标的嵌合抗原受体 (CAR)。一旦重新注入,它们就会寻找并摧毁目标。迄今为止,CAR-T细胞已被证明可以通过破坏引起白血病的致病性B细胞来成功治疗血癌。由于 B 细胞也会引发自身免疫性疾病,因此消灭 B 细胞也有可能治疗这些疾病。
多发性硬化症正在受到密切关注。Kyverna 与德国汉堡-埃彭多夫大学医学中心的研究人员合作,测试了自体 CAR-T 细胞是否可以安全地根除中枢神经系统中的 B 细胞。他们的产品 KYV-101被用作同情使用计划的一部分,针对的是 Ocrevus(ocrelizumab,CD20抗体)对疾病无反应的患者,Ocrevus 是一种抗体疗法,可消耗外周 B 细胞,但不会消耗脑组织中的 B 细胞。Kyverna 首席医疗官 James Chung 表示:“与传统的单克隆抗体相比,KYV-101 确实在这种疾病中显示出不同的影响。”
Chung 表示 KYV-101 中的 CAR 结构“非常适合自身免疫性疾病”。其 CD19 抗体结构域完全是人源的,以降低免疫原性,此外其他结构域也经过了安全性优化。尽管 KYV-101 可到达中枢神经系统,但没有证据表明 KYV-101 对两名参与者有神经毒性。为了收集更多数据,Kyverna 正在与斯坦福大学的研究人员合作,在美国进行一项I期试验,并在美国和欧洲进行的II期试验。
为了破坏致病的 B 细胞,CAR-T 细胞靶向 B 细胞上的 CD19 或 BCMA。这些靶标也可以通过单克隆抗体,例如 Rituxan(利妥昔单抗,CD20,单抗),来攻击,这确实是自身免疫性疾病的主要治疗方法之一。但抗体疗法需要长期服用,使患者面临严重感染的风险。相反,公司正在努力寻找能让健康 B 细胞恢复健康的疗法。
Cartesian Therapeutics 正在设计仅在患者体内短暂表达的 CAR-T 细胞。其方法使用 mRNA 转染来驱动 BCMA 导向的 CAR 在患者来源的细胞中表达。一旦这些细胞被注入体内,它们就会分裂,mRNA 被降解,CAR 表达也会丢失。这种策略意味着不需要为输入的 T 细胞创造空间,因此患者在输注前不需要进行艰难的淋巴细胞清除和住院治疗。与永久修饰的细胞不同,它有机会控制剂量并可能减少副作用。Cartesian 首席战略官 Chris Jewell 表示:“我们已经克服了一些传统上将 CAR-T 疗法推向更广泛患者群体的障碍。”
该公司的 mRNA CAR-T Descartes-08(靶向BCMA)正处于治疗 SLE 和肌无力疾病重症肌无力的II 期试验中。这是第一个针对自免适应症进行随机安慰剂对照试验的 CAR-T 疗法,其交叉设计可确保所有患者都能得到治疗。一项针对重症肌无力的开放标签试验结果表明,Descartes-08 可降低疾病严重程度和自身循环抗体水平,预印本研究结果表明这些效果可以持久,在间隔一周注射六次的七人中,有五人可以维持一年。
Descartes-08 的这些早期结果进一步证明了 CAR-T 细胞可以缓解自身免疫性疾病,比 B 细胞靶向单克隆抗体效果更好。CAR-T 细胞可以进入抗体疗法无法到达的地方,例如淋巴器官和发炎组织。意大利米兰圣拉斐尔医院的血液学家 Raffaella Greco 表示:“这就是为什么我们用 CAR-T 细胞治疗自身免疫性疾病取得了如此好的结果。”她是研究自身免疫细胞疗法的多学科团队的成员。与癌症相比,自身免疫性疾病中功能失调的 B 细胞更少,疾病负担也更低。“就目标而言,这是一个完全不同的治疗环境,”Greco说。这种目标设定的差异可能部分解释了为什么 CAR-T 细胞在自身免疫性疾病中迄今为止似乎没有严重的副作用,例如癌症环境中出现的细胞因子释放综合征和神经毒性。
德国埃尔兰根大学的一项研究提供了有关 CAR-T 细胞在自身免疫性疾病中持久作用的线索。他们研究了 15 名患有三种自身免疫性疾病之一的患者的 B 细胞水平,这些患者在接受一次性 CD19 CAR-T 细胞治疗后长达两年内处于无药物缓解状态。CAR-T输入后,患者的B细胞迅速被消除。随后 CAR-T 细胞水平迅速下降。大约3.5个月后,当被消除的B细胞被新细胞取代时,新的B细胞具有幼稚表型。CAR-T 细胞重置了 B 细胞免疫系统,清除了疾病。
对于 Capstan Therapeutics联合创始人兼研究副总裁 Haig Aghajanian 来说,这项研究是验证该公司瞬时 CAR 方法的重要证据。“长期 B 细胞消融是没有意义的,”他说,考虑到免疫系统的重置。这与癌症形成鲜明对比,癌症可能需要 CAR-T 细胞的长期持续存在。Capstan 是宾夕法尼亚大学的孵化公司,正在开发一种 CAR-T 细胞体内方法,采用纳米颗粒传递的 mRNA 促使人体制造自己的 CAR-T 细胞。
到目前为止,体内CAR-T生产策略已在小鼠纤维化模型中发挥作用。该公司还成功生成了 靶向CD19 的 CAR-T,可消除人源化小鼠中的 B 细胞。Aghajanian 说:“T 细胞在体内即转化为 CAR-T 细胞,无需进行淋巴细胞清除、取出任何细胞或处理细胞。”该策略旨在消除离体CAR-T方法的一些缺点。
今年3月底,该公司计划获得一轮 1.75 亿美元的融资,投资方包括包括强生公司等,计划将其核心产品 CPTX2309(一种体内生成的 CAR,经过完全人体和临床验证)用于自身免疫试验。CPTX2309是Capstan tLNP平台的产品,可将编码抗CD19 CAR的mRNA有效负载传递至表达CD8的T细胞,从而有效地在体内改造CAR-T细胞。这种方法的治疗目标是通过快速深度清除血液和淋巴组织中的 B 细胞来实现免疫系统的重置,而不会遇到传统离体CAR-T 的挑战。Aghajanian 表示,公司将在选择适应症之前学习其他 CAR-T 疗法的新数据。
然而,任何针对 B 细胞抗原(例如 CD19 或 BCMA)的 CAR-T 疗法都会耗尽表达该靶标的所有 B 细胞,使患者面临感染的风险,直到 B 细胞恢复。“通常只有一小部分 B 细胞出现异常,但我们只是将它们全部消灭,”哥伦比亚大学皮肤科医生兼研究员Aimee Payne 说道。Payne 的实验室设计了 CAR 工程 T 细胞,称为嵌合自身抗体受体 (CAAR) T 细胞,仅破坏产生自身抗体的 B 细胞。她说:“我们的目标是获得常规 CAR-T 细胞的持久功效,而不会产生整体免疫抑制的副作用。”
CAAR 构建体表达感兴趣的蛋白质抗原,当通过慢病毒载体体外导入患者的 T 细胞时,CAAR-T 细胞仅靶向表达针对该抗原的自身抗体的 B 细胞。临床前研究为寻常型天疱疮小鼠模型提供了 CAAR-T 细胞方法的概念证明,寻常型天疱疮是一种由抗桥粒芯糖蛋白 3 自身抗体介导的水疱性皮肤病;以及一种由针对肌肉特异性酪氨酸激酶 (MuSK) 自身抗体介导的重症肌无力,破坏神经肌肉接头信号传导。为了将该方法应用于临床试验,Payne 与他人共同创立了 Cabaletta Bio,现在担任该公司的科学顾问。Cabaletta 正在进行 CAAR-T 治疗粘膜寻常型天疱疮和MuSK 重症肌无力(伴或不伴淋巴细胞清除)的 1 期试验。
在设计 CAR-T 细胞时,Sonoma Biotherapeutics 专注于一种不同类型的免疫细胞:调节性 T (Treg ) 细胞。Treg细胞抑制免疫系统以恢复稳态,而大多数 CAR-T 疗法中修饰的效应 T 细胞则专注于细胞破坏。
Sonoma 的临床研究表明,使用 Treg细胞预防移植排斥和自身免疫性疾病是安全的,尽管功效有限。其目的是通过 CAR 将 Treg细胞引导至炎症热点来增强细胞的能力。该公司的核心产品 SBT-77-7101 具有可识别瓜氨酸蛋白的载体转化 CAR。这些修饰的蛋白质存在于发炎部位,例如类风湿性关节炎患者的关节和化脓性汗腺炎患者的皮肤结节,在那里它们会诱导自身抗体。该疗法正处于针对这两种疾病的一期试验中,未进行淋巴细胞清除。
Sonoma的首席研究员oseph Arron表示,通过作用于多种细胞类型,包括 T 细胞、B 细胞和巨噬细胞,并可能促进组织修复,SBT-77-7101 应该“使整个系统安静下来……在组织中产生场效应”。其他临床前 CAR-T注册项目包括来自 GentiBio 和阿斯利康支持的 Quell Therapeutics 的项目,用于治疗炎症性肠病和 1 型糖尿病。
现成可获得的 CAR-T 细胞为 CAR-T 细胞的大众化提供了另一个机会,使它们更加方便和容易获得,并有可能用一批细胞治疗数百或数千人。CRISPR Therapeutics 和 Caribou Biosciences 等公司的目标是尽快开始同种异体 CAR-T 细胞治疗自身免疫性疾病的临床试验。Nkarta 正在寻找一种不同的免疫细胞类型:CAR 自然杀伤 (NK) 细胞。这些免疫细胞巡查整个身体,识别异常细胞,而无需之前见过抗原或需要扩增。“这些特性使我们能够开发出更加现成的疗法,”Nkarta 首席医疗官 David Shook 说。该公司认为 NK 细胞非常适合治疗自身免疫性疾病,最近宣布将重点从癌症转移到自身免疫性疾病。“在注重安全性和可及性的情况下,CAR-NK 细胞确实是合适的细胞”Shook 说。
Nkarta 的 NKX019(用人源化 CD19 靶向 CAR 改造的同种异体载体转化 NK 细胞)的狼疮性肾炎临床试验即将开始,使用单药环磷酰胺进行淋巴细胞清除术。与此同时,武田于 5 月宣布,其同种异体 CAR-NK 细胞疗法 TAK-007 将从血肿瘤转向自身免疫性疾病,并指出其具有良好的安全性和现成的生产能力。狼疮性肾炎的临床试验预计将于明年开始。
目前,招募参加临床试验的患者患有多种疗法难以治愈的严重疾病。在较轻的疾病中使用 CAR-T 和 CAR NK 细胞是一种诱人的可能性,只要它们的长期安全性被证明是有利的,并且可以消除可及性障碍。多发性硬化症或系统性硬化症等疾病会进展加重,希望细胞疗法可早一步阻断疾病进展并治愈疾病。
https://www-nature-com.libproxy1.nus.edu.sg/articles/s41587-024-02321-0
END
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
TIS2024第四届免疫细胞疗法与干细胞疗法论坛重磅来袭,合作详询:王晨 180 1628 8769
细胞疗法临床1期免疫疗法临床结果
100 项与 iCell Gene Therapeutics, Inc. 相关的药物交易
登录后查看更多信息
100 项与 iCell Gene Therapeutics, Inc. 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年09月02日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
药物发现
1
2
临床前
临床1期
3
13
其他
登录后查看更多信息
当前项目
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
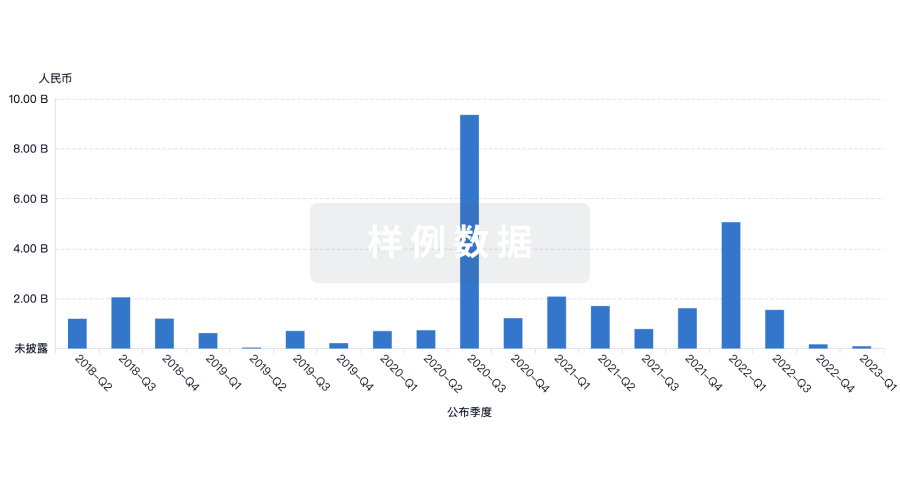
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用