预约演示
更新于:2025-01-23

Beijing Willingjet Science Co., Ltd.
更新于:2025-01-23
概览
关联
1
项与 北京康茂峰科技有限公司 相关的药物靶点 |
作用机制 多巴胺重摄取抑制剂 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期1955-12-05 |
1
项与 北京康茂峰科技有限公司 相关的临床试验CTR20180056
评估盐酸哌甲酯缓释胶囊注意缺陷多动障碍患者中的疗效和安全性的安慰剂对照、双盲、多中心研究
主要目的:
根据4周稳定剂量治疗后ADHD-IV父母评定量表总评分相对基线期的变化,证明个体化滴定剂量的MPH HCl缓释胶囊 (Medikinet® retard)在治疗中国儿童和青少年(6至<18岁)ADHD患者方面相对于安慰剂的优效性。
次要目的:
研究Medikinet® retard对比安慰剂治疗中国儿童和青少年ADHD患者的安全性。
研究给予 10 mg、20 mg 或 30 mg Medikinet® retard 后,MPH HCl在中国儿童和青少年中的 PK。
开始日期2018-09-22 |
申办/合作机构  北京康茂峰科技有限公司 北京康茂峰科技有限公司 [+1] |
100 项与 北京康茂峰科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 北京康茂峰科技有限公司 相关的专利(医药)
登录后查看更多信息
2
项与 北京康茂峰科技有限公司 相关的新闻(医药)2024-12-27
点击上方DIA发布关注我们
撰稿人:石鹭
随着制药行业的发展,药品的全球同步开发与创新药出海成为了医药界的焦点话题。在全球市场布局的浪潮下,药品注册更加复杂,需要制药公司遵循各国法律法规和监管要求,关注每一个细节。合理的药品注册策略不仅能帮助制药公司有效应对各国的监管挑战,还能显著提升注册效率、加速新药上市、更早地惠及患者。
在药品注册过程中,申报资料的准备尤为关键。安全性、有效性、质量等方面的数据和信息,都需要按照监管要求进行严谨的组织和撰写。高质量的申报资料不仅能提高申报成功率,还能降低后续沟通成本。
对于跨国制药公司和本土生物医药企业而言,翻译在药品注册过程中扮演着举足轻重的角色。精准而专业的翻译能确保申报资料在目标国家易于理解和接受,而AI技术的应用更是为这一过程提供了新的动力。
12月13日,辉瑞亚洲区药品注册文件出版负责人吉申齐主持了 “全球药品注册策略和技术要求及翻译策略研讨会” ,会议特别邀请了药政事务领域和翻译领域的行业资深专家,共同探讨了全球药品注册策略、技术要求及翻译策略。研讨会期间,专家们分享了最佳实践,同时也探讨了如何运用注册策略和翻译策略的双重驱动,推动中国新药走向世界,助力进口药品在中国市场落地生根。让我们携手并进,共创医药行业美好未来!
吉申齐
辉瑞亚洲区药品注册文件出版负责人
东南亚及中东出海策略及要求
谢媛媛 Ph.D.
复星医药国际注册执行总经理
全球医药市场规模在未来5年将持续增长,预计到2029年,市场份额将增长至21930亿美元,其中东盟及中东市场有着巨大的市场发展潜力,是全球许多制药企业都非常重视的出海目的地。然而机遇总是与挑战并存,庞大的市场意味着激烈的竞争,在企业间的出海竞争中,合理的策略能够让企业事半功倍。
谢媛媛博士指出东盟国家人口基数庞大、本土医药研究成果不足、医药大幅依赖进口等特点给中国制药企业的出海提供了机会。然而,中国药品出海东南亚也面领诸多挑战,如市场碎片化严重、监管差异化较大、产品品牌知名度弱等。因此,中国制药企业在产品的出海过程中需要增加更多创新成分、创造更多的跨国医药研究合作机会并充分了解文化差异,总体市场策略应当聚焦重点疾病领域,制定差异化的进军策略。企业应当基于自身优势和特点,结合目标国家的具体情况,明确各地市场需求和产品定位,选择单一或少数国家切入制定最优出海策略。由于东南亚地区各国采取单独审评,企业应当参考ICH、ACTD及当地政府政策,落实一国一策。
中东北非(Middle East North Africa-MENA)地区有超过18个国家,多数国家都参考了FDA体系,与国际接轨。此外,中东各国出台了激励政策推动制药业本土化发展。针对中东地区,总体的出海策略可以从以下六个方面综合考量:市场标准、市场准入、本土化、“一带一路”政策、生物制药优势和产品选择。沙特是中东最大的市场,也是目前为止申请和获批药品最多的中东国家,药品出海到中东应当以沙特为切入点。
总而言之,东南亚和中东的市场有共性也有差异。企业的出海应当以市场战略为主导,同时将下游市场准入做到极致。此外,如果企业有条件实现全产链的国际化,即市场立项-研发-转移-生产-质量-非临床-临床-注册-上市后全生命周期管理的国际化,将有助于加快产品的出海进程。
临床期间生物制品药学在中美欧
注册申报差异及变更差异
王培瑛
夏尔巴生物药政事务副总监
如今,生物制品的研发与市场拓展日益国际化,中国、美国和欧盟作为世界主要经济体,在生物制品的监管政策上存在显著差异。企业在开展生物制品临床试验申请及进行临床药学变更时,必须充分了解并适应这些差异,以提高申报的效率和成功率。
王培瑛老师深度剖析了生物制品临床试验申请在中美欧三大区域的申报差异。首先,在申请时限方面,三个地区的规定各不相同,企业需根据不同的规定进行合理规划,及时确认申请状态以确保尽早顺利地开展临床试验。其次,在M3物料章节中,各地区对原辅料和包材的选择与使用有不同的标准和规范。企业需对供应商进行严格筛选,确保所使用的物料符合相应区域的要求。再者,针对M3 Cell Line,王培瑛老师强调了History of host cell、稳定性及EPOC等方面的差异。企业在选择细胞系时,需充分考虑这些因素,以满足不同区域的监管要求。此外,在工艺和质量方面,无论是原液还是制剂,中美欧都存在一系列具体的规定和指导原则。王培瑛老师详细对比了返工、VC研究、CIU/PUPSIT等工艺环节,以及外观、鉴别、稳定性时间点等质量指标的差异。
除了上述申报过程中的差异外,王培瑛老师还介绍了NMPA(中国国家药品监督管理局)、FDA(美国食品药品监督管理局)和EMA(欧洲药品管理局)对不同等级变更的定义及上报要求,并且强调了充分评估变更及其影响的重要性,确保按照相应区域的规定进行上报和审批。
总之,企业需要充分了解中美欧在生物制品临床试验申请及临床试验期间变更方面存在的差异,在申报过程中关注申请时限、物料选择、细胞系稳定性、工艺细节及质量指标等多方面的差异,并根据这些差异制定针对性的策略和计划。
“Navigating Dossier Translation: Challenges and Innovations” 注册资料翻译:挑战与革新
吕海婷
拜耳医药保健有限公司注册总监
语言在跨国企业运营中起着重要的桥梁作用,翻译在其中扮演着不可或缺的角色。注册资料翻译是很多官方机构的明确要求,其中涉及的专业术语繁多,能否准确翻译直接影响申报资料的专业度和可信度。药品说明书、标签等敏感申报资料的翻译质量,更是与用药安全和批准文件内容息息相关。
吕海婷老师分享了她在实际工作中遇到的翻译挑战。首先,术语的专业性是一大难题,尤其在临床、非临床、药学等领域,术语翻译与法规及指导原则不一致是个大问题。其次,翻译过程中确保同一产品在不同文档中或同一文档内术语的一致性又是一个难题。另外,格式和风格问题也需注意,错翻、漏翻及数据誊写错误时有发生;页眉页脚、页码设置以及中英文标点符号的使用习惯等也是不可忽视的细节,特别是在eCTD格式要求下,这些问题都需要引起重视。
在注册资料翻译中,项目管理与时间挑战同样重要。吕海婷老师提到了滚动翻译策略,但该策略也不是万能的,在应用时还需注意方式方法。在遇到全球同步递交或紧急递交文件的情况时,需充分考虑沟通成本与效率并进行合理安排。
企业在管理翻译供应商时也面临挑战,如确保质量、效率及建立稳定合作关系等。吕海婷老师分享了最佳实践,包括设定KPI评估供应商质量,定期回顾反馈;供应商应有专门译员团队及对接人,保证翻译质量与时效性;与供应商保持及时沟通,提前预告任务,商定加急文件处理方案;内部沟通与合作,共同制定指导原则并培训供应商等。
值得一提的是,AI在翻译领域的应用给以上的难题提供了新思路。吕海婷老师对比了多款AI引擎,发现AI确实能助力翻译工作,但仍存在专业性欠缺、翻译不一致性等问题,人工干预不可或缺。未来AI翻译技术有望提升,但对于注册资料这类专业性强且需关注细节的资料,短期内人工校对和优化仍是必要环节。
AI 助力 PV 文件翻译及管理
樊为国
北京康茂峰科技有限公司总经理
在药物警戒(PV)领域,保障药品安全性和有效性至关重要。随着全球医药市场蓬勃发展,药物警戒工作挑战不断。在跨国药企日常运营中,PV文件翻译必不可少,如今AI技术为PV文件翻译与管理带来了前所未有的机遇。相较于一般文件,PV文件时效性极高、专业度强、译前处理复杂且格式要求严格,给翻译工作带来了更多的挑战。AI技术在PV文件翻译中展现出了强大潜力,由自然语言处理(NLP)、机器翻译(MT)、翻译记忆库(TM)和计算机辅助翻译工具(CAT)联合驱动,能实现快速、准确、一致的翻译,极大地提高了翻译效率和质量。
北京康茂峰科技有限公司深耕医学翻译领域多年,紧跟技术发展步伐,将AI技术应用于实际翻译工作。通过语料创建、机器训练、评估、调优及云服务集成等措施优化了AI翻译功能,建立了完备的AI-人工协同翻译体系。樊为国老师介绍了其所在公司处理PV文档翻译的流程:文件分析、调整格式、机翻、人工审校、排版,这五个步骤共同确保了文档翻译的准确性和一致性。
在文档管理方面,AI技术同样重要。其智能化数据处理分析能实现自动化分类存储、版本控制及数据提取分析。有了AI技术的助力,文档管理效率得到了极大的提升,整体文档管理流程得到了极大的优化。
最后,樊为国老师分享了两个通过AI提升翻译效率的成功案例。在时间紧任务重的情况下,通过合理安排及应用AI翻译,均实现了准时的高质量交付。
在翻译的过程中中,AI技术让文档的翻译和管理更高效、更准确。未来,我们期待AI 在药物警戒文件及其他注册资料的翻译中发挥更大作用,帮助企业更好、更快地递交资料。
圆桌讨论
药品出海的策略——医药注册及翻译机遇和挑战
主持人:
徐娜
思路迪医药企业战略发展部和药政事务部总监
DIA中国药品法规事务社区工作组核心成员
讨论嘉宾:
谢媛媛 Ph.D
复星医药国际注册执行总经理
王培瑛
夏尔巴生物药政事务副总监
吕海婷
拜耳医药保健有限公司注册总监
樊为国
北京康茂峰科技有限公司总经理
吴蕾
中国生物制药/正大创新药政事务副总经理
问题1:在众多出海的成功案例中,是什么因素造就了成功?其中有哪些坑可以避免?
谢媛媛老师分享了两个成功案例,第一个是泽布替尼--中国第一个出海并跻身“十亿美元分子”俱乐部的PD-1抑制剂。泽布替尼在澳大利亚做了一期临床,在中国做了三期临床,最终先在美国上市后才在中国上市。在这个案例中,因为有一期的白人数据,它在美国的申报上市就比较容易成功。另外,它获得了美国的优先审评资格。从这个案例中,大家可以学习其中的国际化视野,也是我们之前提到过的:制药各个环节尽可能的国际化是有利于出海的。第二个例子,绿叶公司,团队总六十多人,七八年前在东南亚地区展开了布局,每年团队中BD的人均Marketing营收均达几千万美元,这给我们的启发是医药公司的领导者能否尽早地看到商机并付诸实践是非常重要的。
吴蕾老师指出出海本身绝非易事,目前中国制药企业成功出海的案例并不多。在公司层面,管理层要做好布局,资金方面也需要谨慎考量。目前中国药企正在探索多种多样的出海模式,包括与当地的企业合作等等。各个国家的要求差异比较大,我们要在布局好的前提下,去了解目标国家或地区的要求,每个环节的相关人员都要对自己负责的部分有全面的了解并把工作做到极致,这样才能增加成功的概率。虽然目前出海的成功案例不多,但吴蕾老师认为大家在未来都还有机会,我们要开拓视野,在自己擅长的领域作出成就,提升竞争力。
樊为国老师指出,当中国产品出海时,竞争对手来自全球各地,一个产品在中国国内的成功并不能确保其出海的成功,好的产品和充足的资金是出海的基础,但我们还要充分了解国际规则,比如FDA、EMA的规则。出海时,管理层的国际化观念和认知水平非常重要,目前中国企业的管理层在这方面还有所欠缺,我们要从失败案例中吸取教训,从成功案例中汲取经验。樊为国老师建议,选定出海目的国之后,可以对目的国的成功同行进行研究,按照他们的特点制定自己的策略,这样方能提升出海竞争力。
吕海婷老师建议中国的企业在出海时可以考虑与当地充分了解法规的代理机构合作,这可能会成为出海成功的制胜法宝。
问题2:产品出海/引进的成功案例中,在注册策略和技术要求方面有哪些重点值得关注?
谢媛媛老师指出,药品归根结底是一种特殊的商品,在引进和出海的过程中,首先要考虑市场导向,从全局出发分析一个项目是否值得开启。在项目执行过程中,从研发到销售都要有全局意识,各个环节之间要加强沟通、及时复盘纠偏,同时还要对外部市场环境进行实时的追踪分析以实现效率效益的最大化。
吴蕾老师认为在出海方面,中国企业首先可以以国际化的标准开展工作,另外更多地寻求与当地企业或机构的合作。在产品引进方面,以往采取的注册策略都是先申请进口药的国内批件。出于成本考虑, 大部分进口药品之后都是要实现地产化的,这样一来,本土生产的产品还需要重新申请国内的注册批件,因为境外的产品在研发期间没有变更的路径把它变成境内版本。现阶段我们会更多地根据具体情况开展利弊分析,决定在哪个阶段进行境外转境内的转产。目前,中国监管当局对境外临床试验的接受度比较高,比如,有企业在国外做了二期临床用于在中国开展的三期,那么只要国外的临床数据符合要求并有对种族差异的科学论述,一般都是可以得到中国监管认可的。另外,有些品种的进口和国产基本是并行的,那有没有可能进口版的三期数据可以直接用于国产版申报呢?这种比较激进的做法能否成功目前还没有答案。
吕海婷老师指出近几年中国的法规有较大的变化,比如分段生产生物制品相关的法规就在进行探索试点,未来,我们会看到上述问题的答案。
吴蕾老师补充到,中国药监目前在鼓励全球同步创新,政策的开放度和包容度越来越大。在引进和出海的过程中,企业无法忽视地缘政治和整体经济的影响,但可以充分利用政策优势。
针对上述提到的激进申报策略,谢媛媛老师鼓励企业进行尝试,但是需要尽早将CMC转移到国内,后续再做Run-in Test证明等效性。这样操作,企业会面临较大的压力,因此需要管理层尽早做决定、下决心。
吴蕾老师指出,医药生态系统涉及各方的紧密合作,其中必然存在不合理和值得优化的部分,每个从业者都应该去发现可优化的地方。另外,药监部门也在提升效率,所以从效率为先的角度出发,我们要敢想敢干,在有保底方案的前提下去尝试激进的方案也无妨。
问题3:如何平衡申报资料的准备效率和质量(包括翻译质量)?
樊为国老师指出,与二三十年前相比,现在的注册资料需要翻译内容更多、留给翻译的时间更紧,好在现在有AI的辅助。由于时间紧,很多资料又在不断更新,很多时候在拿到终版资料之前就要把资料翻译好,最后只修改更新的部分,在这个过程中,AI能够很好地确保一致性,包括术语的一致性和风格的一致性。另外,之前有老师提到的数据错误,现在也能够通过文档的预处理解决。具体来说,数字在预处理时就会被处理为不需要改动的部分,因此在最终资料中呈现的就是原始文件中的数字,从源头上避免了数字错误的问题,很好地确保了资料的准确性。目前,樊为国老师也在尝试做大数据模型,用它来检查低级错误,丰富机器的学习资料使识别功能更智能、更完备。
吕海婷老师从申报资料撰写的角度提供了她的看法,采用先用中文写框架,等有数据再填入相应位置的策略,在一定程度上提高了效率。此外,她的团队正在尝试进行ChatGPT的相应开发来辅助申报资料的撰写以提高效率。
吴蕾老师分享了她的三点建议。首先,RA对外要在自己可控范围内设定timeline,不要一味设置紧急的timeline让自己压力太大;其次,讲究方式方法,在开始工作前先思考如何以最高的效率开展工作,能借力的部分尽量借力;最后,在交出资料之前,通读一遍,确保交出去的资料是好理解的。
谢媛媛老师认为,申报资料应该尽量少写,去繁化简,并在撰写初期就有良好的分工,不能把撰写压力都留给RA。
点击了解详情
关于DIA
DIA是一个全球化、跨学科的国际性学术平台,在中立的环境中,融合医药研发领域全行业的意见领袖,探讨当前研发的技术问题,提升专业能力,以及催化行业共识,在全球医药研发领域享有很高的声誉。
扫码关注我们
微信号|DIA发布
长按识别左侧二维码即可关注
我们努力为你提供有内容的内容。
医药出海
2024-11-21
点击上方DIA发布关注我们
药品的全球同步开发和创新药出海是近期医药行业讨论的热门话题,在全球市场布局上,药品注册是一个复杂且严格的过程,需要遵循各个国家和地区的法律法规和监管要求。制定合理的药品注册策略可以帮助制药公司有效地应对各国监管要求,提高注册效率和成功率,从而更快地将药品推向市场,造福患者。
药品注册需要提交一系列申报资料,包括药品的安全性、有效性、质量等方面的数据和信息。这些申报资料需要严格按照监管要求进行组织和撰写,确保其准确性和完整性。合适的申报资料准备可以提高申报质量和效率,并减少后续的沟通和改动成本。
对于跨国制药公司和正在出海进行全球化发展的本土生物医药公司而言,翻译是药品注册和申报资料准备过程中不可或缺的重要环节。在这一过程中,需要精准而专业地将药品相关的术语、数据和信息翻译成目标国家的语言,以确保申报资料的可读性和易理解性。尤其是AI技术的合理应用,会给当今注册资料的翻译工作带来很大的助推作用。合规高效的翻译策略不仅能提升申报资料的可信度和专业度,还能够增强目标国家监管机构对药品的认可和接受程度,从而加快药品在全球的同步开发和上市进程。
DIA中国药品法规事务社区(RAC)在去年11月成功举办首场“全球药品注册策略和申报资料准备及翻译策略研讨会”的基础上,今年将对全球药品注册策略和技术要求(东南亚,中东地区和欧美市场)以及翻译策略方面继续展开深入讨论,特邀产业界和翻译界等相关领域的专家、学者以及医药企业的相关代表,共同探讨中国医药发展全球化背景下的药品注册策略和技术要求及翻译所面临的新机遇、新挑战,互享药品注册策略制定和申报资料准备的最佳实践和规范要求,以及如何运用翻译策略提升药品研发和上市的效率,助力中国新药走向海外以及进口药品在中国落地。
主题
全球药品注册策略和技术要求及翻译策略研讨会
时间
13:00-17:00, 2024年12月13日(周五)
地点
上海张江
日程安排
13:10-13:20
开场主持
吉申齐
辉瑞亚洲区药品注册文件出版中心负责人
13:20-14:00
药品出海策略和技术要求(东南亚+中东)
谢媛媛 Ph.D
复星医药国际注册执行总经理
14:00-14:40
药品出海策略和技术要求(欧美)
王培瑛
夏尔巴生物药政事务副总监
14:40-15:00
茶歇
15:00-15:30
注册资料翻译:挑战与革新
吕海婷
拜耳医药保健有限公司注册总监
15:30-16:00
AI 新技术在医药翻译的应用
樊为国
北京康茂峰科技有限公司总经理
16:00-16:50
圆桌讨论:药品出海的策略——医药注册及翻译机遇和挑战
主持人
徐娜
思路迪医药企业战略发展部和药政事务部总监
讨论嘉宾
谢媛媛 Ph.D
复星医药国际注册执行总经理
王培瑛
夏尔巴生物药政事务副总监
吕海婷
拜耳医药保健有限公司注册总监
樊为国
北京康茂峰科技有限公司总经理
吴蕾
中国生物制药/正大创新药政事务副总经理
16:50-17:00
闭幕及退场
关于 药品法规事务社区(RAC)
DIA中国药品法规事务社区(DIA RAC)致力于提供一个具有行业影响力、领导力和社交的中立平台,分享和交流与药品法规事务(RA)相关的法律法规、指导原则和标准、以及行业发展动态,以增强药品RA的实践和专业知识,促进药品上市及监管,从而保障公众安全,并推动中国药品RA的发展。
请长按识别左侧二维码,申请活动名额,人数有限,先到先得
关于DIA
DIA是一个全球化、跨学科的国际性学术平台,在中立的环境中,融合医药研发领域全行业的意见领袖,探讨当前研发的技术问题,提升专业能力,以及催化行业共识,在全球医药研发领域享有很高的声誉。
扫码关注我们
微信号|DIA发布
长按识别左侧二维码即可关注
我们努力为你提供有内容的内容。
医药出海
100 项与 北京康茂峰科技有限公司 相关的药物交易
登录后查看更多信息
100 项与 北京康茂峰科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年02月19日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
其他
1
登录后查看更多信息
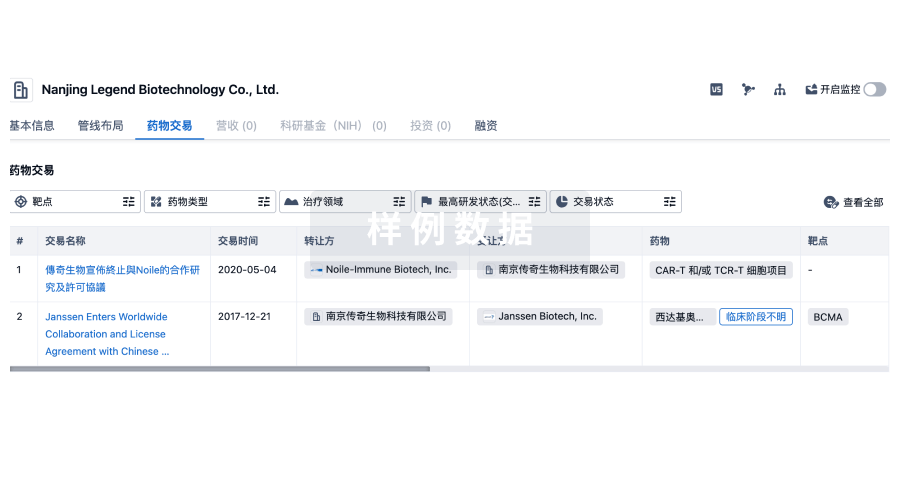
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
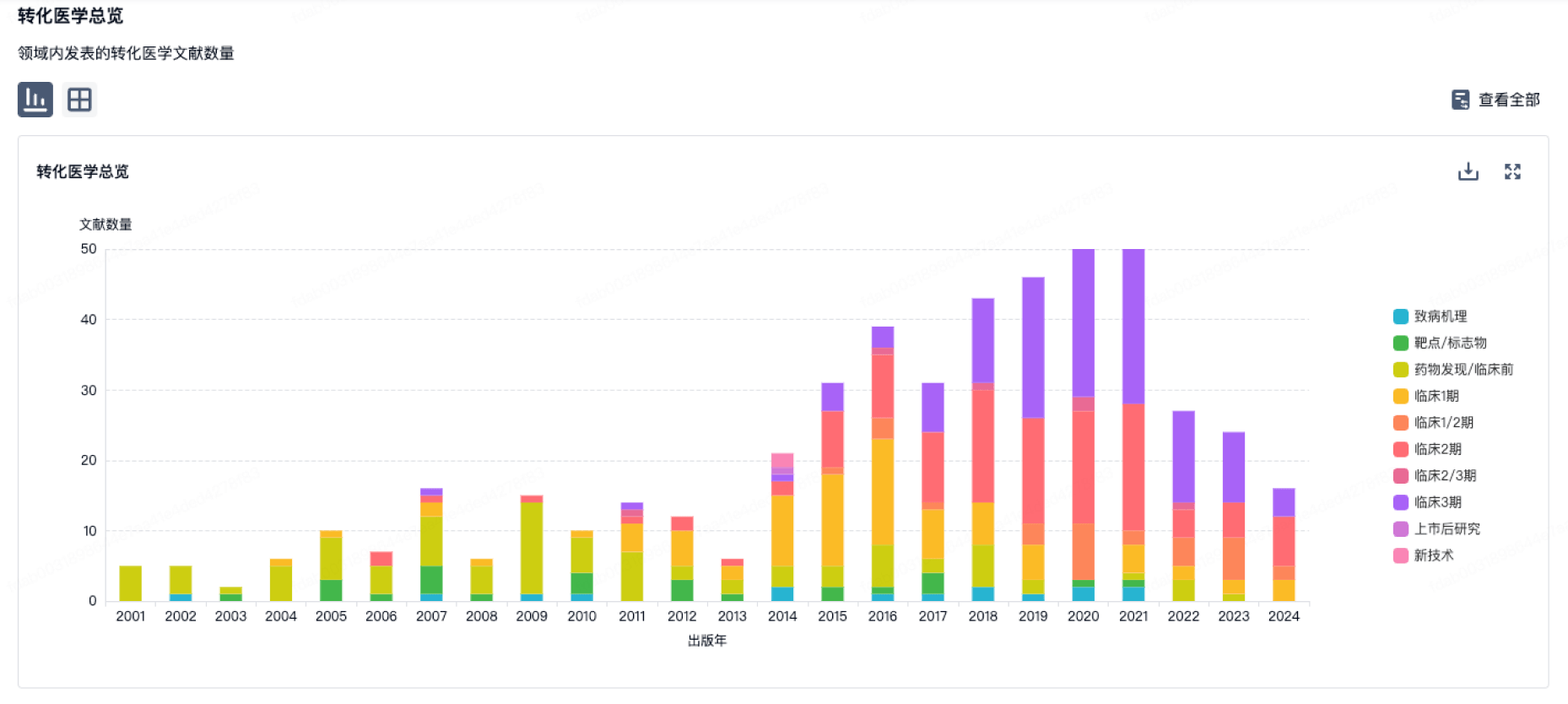
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
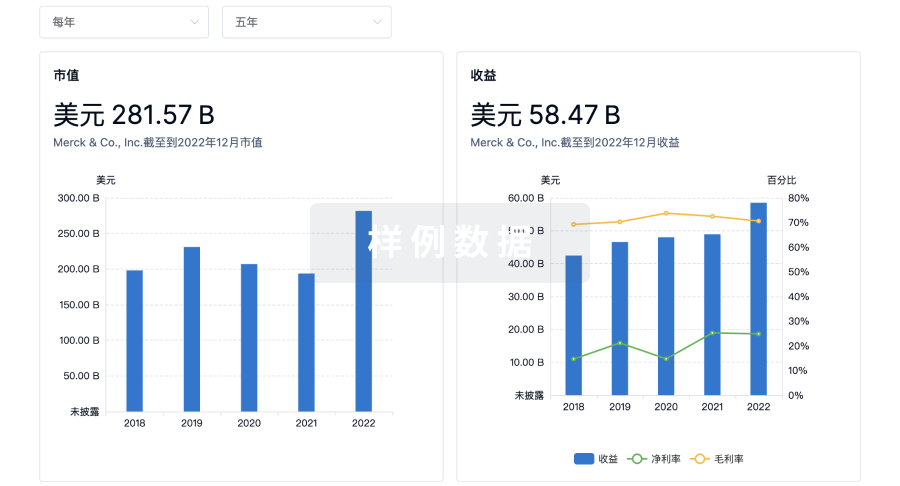
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
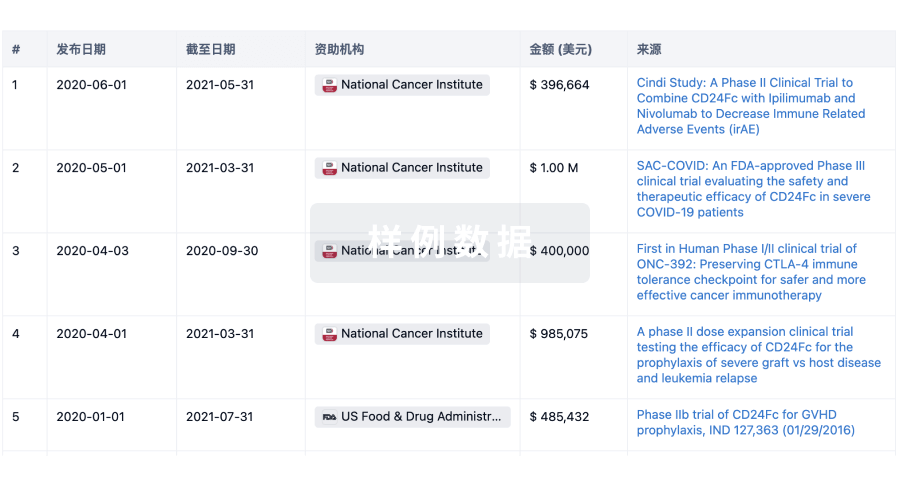
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
