预约演示
更新于:2025-08-29

Shanghai BDgene Therapeutics Co., Ltd.
更新于:2025-08-29
概览
标签
眼部疾病
遗传病与畸形
感染
基因编辑
基因疗法
DNA编码的单抗
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 基因编辑 | 9 |
| 基因疗法 | 2 |
| 治疗性疫苗 | 1 |
| DNA编码的单抗 | 1 |
| CRISPR/Cas9 | 1 |
| 排名前五的靶点 | 数量 |
|---|---|
| VEGF(血管内皮生长因子) | 1 |
| HTT(亨廷顿蛋白) | 1 |
| RPL35(ribosomal protein L35) | 1 |
关联
12
项与 上海本导基因技术有限公司 相关的药物靶点- |
作用机制- |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床2期 |
首次获批国家/地区- |
首次获批日期- |
靶点 |
作用机制 VEGF刺激剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床2期 |
首次获批国家/地区- |
首次获批日期- |
靶点- |
作用机制 细胞替代物 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
12
项与 上海本导基因技术有限公司 相关的临床试验NCT06474442
A Multicenter, Single-blind, Single-dose, Randomized, Phase Ⅱa Trial to Evaluate the Safety, Tolerability and Efficacy of Intrastromal BD111 Gene Editing Therapy in Adults With HSV-1 Stromal Keratitis
This study aims to compare the clinical efficacy and safety of BD111 injection in combination with standard therapy vs. standard therapy in herpes simplex virus type I stromal keratitis (HSK), providing preliminary confirmation of the clinical effectiveness of BD111 in combination with standard therapy.
开始日期2025-04-28 |
申办/合作机构 |
NCT06465537
A Clinical Study on CRISPR/Cas9 Instantaneous Gene Editing Therapy to Primary Open-angle Glaucoma With Elevated Intraocular Pressure and MYOC Gene Mutation
This study is intented to evaluate the safety, tolerability and preliminary efficacy of CRISPR/Cas9 Instantaneous Gene Editing Therapy (BD113 virus-like particle, also BD113vLVP) in patients with primary open-angle glaucoma (POAG) with elevated intraocular pressure and MYOC gene mutation. The main objectives to evaluate the safety and tolerability BD113vLVP) in POAG patients with intraocular hypertension and MYOC mutation, and secondary objectives is to explore the preliminary efficacy and the metabolism characteristics of BD113vLVP in participants.
开始日期2024-06-10 |
申办/合作机构  上海本导基因技术有限公司 上海本导基因技术有限公司 [+1] |
CTR20240322
BD211静脉输注治疗输血依赖型β-地中海贫血患者安全性和有效性的I期临床研究
主要目的是评估编码人βA-T87Q-珠蛋白基因的BD211慢病毒载体体外转导修饰自体CD34+造血干细胞(BD211注射液)静脉回输到输血依赖型β-地中海贫血(TDT)受试者体内后的安全性和耐受性。次要目的是评估BD211静脉回输到TDT受试者体内后的有效性和BD211静脉回输到TDT受试者体内后的药效学特征。
开始日期2024-01-26 |
申办/合作机构 |
100 项与 上海本导基因技术有限公司 相关的临床结果
登录后查看更多信息
0 项与 上海本导基因技术有限公司 相关的专利(医药)
登录后查看更多信息
1
项与 上海本导基因技术有限公司 相关的文献(医药)2025-01-01·Frontiers in Cell and Developmental Biology
Preclinical efficacy and safety evaluation of BD211 autologous CD34+ hematopoietic stem cell injection for transfusion-dependent β-thalassemia in NCG-X mice.
Article
作者: Dai, Xuedong ; Wang, Quanjun ; Chen, Shuang ; Li, Zike ; Wang, Qi ; Ling, Sikai ; Huang, Ying
Introduction:
Autologous CD34+ hematopoietic stem cell-based therapies have shown promise in addressing therapeutic needs. However, a comprehensive evaluation of their efficacy and safety is crucial before clinical application. This study aimed to assess the efficacy and safety profile of BD211 autologous CD34+ hematopoietic stem cell injection in NCG-X mice.
Methods:
NCG-X mice were administered BD211 intravenously at doses of 4.0 × 105 and 1.2 × 106 cells per mouse, followed by withdrawal and observation for 13 weeks. Efficacy was evaluated by monitoring the engraftment and differentiation of BD211 into human erythroid cells within the mouse bone marrow and blood. Safety was assessed through clinical observation, pathology, organ weight measurements, and histopathology. Toxicokinetic studies and distribution of BD211 were determined via validated quantitative PCR.
Results:
Mortality was observed in all groups of mice with no correlation to dose or BD211. No abnormal effects related to BD211 administration on clinical responses, body weight, or food intake were observed. BD211 successfully engrafted and differentiated into human erythroid cells within the mouse bone marrow and blood.
Conclusion:
The no observed adverse effect level of BD211 was established at 1.2 × 106 cells per mouse. BD211 shows potential as a safe therapeutic approach for treating transfusion-dependent thalassemia.
109
项与 上海本导基因技术有限公司 相关的新闻(医药)2025-08-21
·药事纵横
基因疗法是一种通过将外源正常基因导入到靶细胞内,来纠正或补偿由基因缺陷或基因表达异常所致的疾病,从而实现治疗疾病目的的生物医学手段。根据国际人类基因组组织(The Human Genome Organization, HUGO)的研究表明,基因疗法可以克服传统小分子和大分子抗体药物调控蛋白质水平的局限性。随着基因编辑技术、基因治疗技术和细胞治疗技术的飞速发展,以及人们对健康需求的增加,未来几年全球基因药物市场将继续保持高速增长。本文将结合最新数据,深入解析基因疗法的商业行情及其发展前景。
一、千亿蓝海的市场格局
1)全球市场概况
自2015年起,全球基因治疗行业迅猛发展,市场规模从2016年的5040万美元跃升至2020年的20.8亿美元,预计到2025年,该市场规模将逼近305亿美元。就区域分布而言,北美地区在全球基因治疗市场中占据最大份额,约为60%,该地区拥有超过600家致力于细胞和基因疗法产品研发的公司。紧随其后的分别是欧洲和亚太地区,市场占比分别为23%和12%。拉丁美洲在全球市场中的占比为3%,而其他地区则占2%。
图1.全球基因治疗市场规模(图片来源:中国生物工程杂志)
自1998年全球首款基因治疗药物问世以来,基因治疗药物的获批数量一直较为稀少,每年仅有一款药物获得批准。然而,自2016年起,基因治疗药物的全球商业化进程开始加速,平均每年约有四款基因治疗药物获批上市。截至2022年底,全球范围内已有45款基因治疗药物获得上市批准,这些药物主要针对罕见病,并以CAR-T疗法为主导。2024年上半年,全球共有3款细胞和基因疗法首次获批上市,获批数量保持近年来的积极趋势。其中,首款肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifleucel)获得美国FDA批准,用于治疗晚期黑色素瘤,这是首款获批的TL疗法,也是首款获批治疗实体瘤的T细胞疗法,标志着细胞疗法领域的又一里程碑。从市场规模来看,贝哲斯咨询预测,2023-2029年全球基因治疗药物市场将保持较高的复合年增长率(CAGR),市场规模将从数亿美元增长至数十亿美元。
图2.基因治疗上市药物数量年度分布(图片来源:中国生物工程杂志)
2)中国市场概况
尽管中国在基因治疗领域的起步相对较晚,但已迅速崛起成为全球最重要的基因药物研发市场之一,累计进行的临床试验数量仅次于美国,位居全球第二。截至2023年,中国基因治疗药物市场规模已达数亿元人民币,已有多款国产基因治疗产品成功上市,包括重组人p53腺病毒注射液(商品名:今又生)、重组人5型腺病毒注射液(商品名:安柯瑞)、倍诺达以及西达基奥仑赛(商品名:CARVYKTI)等。预计到2025年,中国基因治疗行业市场规模将达到数百亿元,其中临床试验和产品上市将是主要增长动力。目前,国内布局细胞与基因治疗(CGT)业务的公司超过100家,其中复星凯特和药明巨诺均有产品上市。其他在研发管线数量上领先的企业还包括纽福斯、本导基因、锦篮基因、新芽基因、辉大基因、康弘药业等。
图3.部分中国基因治疗上市药物(图片来源:中国生物工程杂志)
二、基因疗法的主要技术与产品
基因疗法是一种前沿的医学技术,主要通过引入、修复或编辑患者体内的基因来治疗疾病,其主要技术包括基因编辑技术(如CRISPR/Cas9)、CAR-T细胞治疗和病毒载体疗法等。目前,市场上主要的产品包括用于治疗血液癌症的CAR-T细胞产品(如Kymriah和Yescarta),以及用于治疗Leber先天性黑蒙(LCA)的体内AAV基因治疗产品Luxturna。
1)基因治疗的主要技术
基因治疗的核心原理主要包括:
l基因替代:用健康的基因替代缺陷基因,使细胞能够产生正常功能的蛋白质。
l基因修复:通过基因编辑技术直接修复体内的突变基因,恢复其正常功能。常用的基因编辑工具有CRISPR-Cas9、ZFNs和TALENs。
l基因沉默:使用RNA干扰(RNAi)或反义寡核苷酸(ASO)技术抑制有害基因的表达,防止其产生病理性蛋白质。
l基因补充:为患者提供缺乏的基因产物(如特定酶或蛋白质),以补偿体内的生理缺陷。
2)基因治疗的产品
已研发出多类型的基因治疗产品,主要包括:
l质粒DNA:环状DNA分子可通过基因工程将治疗基因携带到人体细胞中。
l病毒载体:病毒具有将遗传物质传递到细胞中的天然能力,一些基因治疗产品源自病毒。一旦病毒被修饰以消除其引起传染病的能力,这些修饰的病毒就可以用作载体,将治疗基因携带到人类细胞中。
l细菌载体:细菌可经过改造以防止其引起传染病,然后用作载体将治疗基因携带到人体组织中。
l患者来源的细胞基因治疗产品:从患者体内取出细胞,进行基因改造(通常使用病毒载体),然后返回患者体内。
l基因编辑技术:基因编辑的目标是破坏有害基因或修复突变基因。
3)应用实例
lGlybera:由荷兰UniQure公司开发,用于治疗脂蛋白脂肪酶缺乏症,是第一款获得批准的AAV基因疗法。
lStrimvelis:由GSK开发,用于治疗腺苷酸脱氢酶(ADA)缺失导致的严重联合免疫缺陷(SCID)。
lLuxturna:由Spark Therapeutics开发,用于治疗RPE65双等位基因突变导致的遗传性视网膜疾病先天性黑朦症II型(Leber’s Congenital Amaurosis, LCA)。
由此可见,基因疗法作为疾病的“治本”疗法,正成为新药研发的下一个风口,尤其是在遗传性疾病、癌症、罕见病以及某些感染性疾病的治疗中展现出巨大的潜力。
三、基因疗法应用领域
基因疗法是一种前沿的医学治疗方式,通过直接修改患者的基因来治疗疾病。
1)基因疗法的应用领域
l遗传性疾病
基因疗法在遗传性疾病的治疗中显示出巨大的潜力。例如,针对囊性纤维化、地中海贫血、杜氏肌营养不良症等,通过修复或替换异常基因,基因疗法能够显著改善患者的症状。
l癌症治疗
在癌症治疗领域,基因疗法主要通过两种方式发挥作用:一是修复或替换导致肿瘤生长的异常基因;二是通过基因编辑刺激患者免疫系统,增强机体对肿瘤细胞的识别和攻击能力。例如,CAR-T细胞疗法已经成为治疗某些类型白血病和淋巴瘤的有效手段。
l病毒性疾病
对于艾滋病、乙型肝炎等病毒性疾病,基因疗法可以通过编辑病毒基因来阻止病毒复制和感染。这种方法可以直接针对病毒生命周期中的特定基因,提供潜在的治疗策略。
l心血管疾病和其他
基因疗法还应用于心血管疾病,如家族性高胆固醇血症,通过修改低密度脂蛋白受体的基因来降低胆固醇水平。此外,基因疗法也在探索用于神经系统疾病如帕金森病和亨廷顿病的治疗。
2)各大药企的产品布局
基因疗法作为一种新型的生物医疗技术,近年来受到全球各大药企的广泛关注和投资。
lBioMarin
BioMarin在基因疗法领域专注于罕见病治疗,尤其是血友病。他们的产品Roctavian(用于治疗法布雷病)已进入三期临床,并且正在考虑与诺和诺德合作开发用于A型血友病的CAR-T疗法。BioMarin还在持续优化其基因疗法策略,以降低治疗成本和提高治疗效果。
lModerna
Moderna以其在mRNA技术方面的领先地位,开发了多种疫苗和疗法。其产品mRNA-1273用于COVID-19疫苗,而mRNA-4157则用于联合Keytruda(帕博利珠单抗)治疗皮肤癌。此外,Moderna正在开发一种“通用型”流感疫苗,旨在提供对不同流感病毒的广泛保护。
lBluebird Bio
Bluebird Bio曾是基因治疗领域的先锋,专注于开发针对严重遗传疾病和癌症的基因疗法。其核心产品包括Zynteglo、Skysona和Lyfgenia,这些产品主要用于治疗地中海贫血、脑肾上腺脑白质营养不良和镰状细胞病。尽管面临高成本和安全性问题,Bluebird Bio的产品在市场上获得了一定的关注。
l赛诺菲
赛诺菲通过收购Bioverativ进入基因疗法领域,重点发展血友病的基因治疗产品。此外,赛诺菲与Oxford BioMedica合作开发基于慢病毒载体的基因治疗产品,预计将于2022年进入临床阶段。赛诺菲还在与多家公司和研究机构合作,扩展其在基因疗法领域的布局。
l其他药企巨头
除此之外,辉瑞布局了包括A型血友病、B型血友病、杜氏肌营养不良症等多个基因治疗领域;罗氏收购了Spark Therapeutics,获得了多项基因疗法技术,如Luxturna,用于治疗特定遗传性眼疾;吉利德科学则在T细胞治疗领域有着广泛的布局,其Yescarta和Kymriah是市场上的知名CAR-T产品;强生还收购了Hemera生物科学公司的基因疗法专利权,专注于眼部疾病的基因治疗。
四、抢滩AAV基因疗法
基因疗法根据涵盖范围的不同,可分为广义与狭义两种,涉及多种治疗项目。在广义上,细胞和基因治疗被统称为细胞基因治疗(CGT),这是我们通常所说的广义基因治疗。例如,辉瑞的Beqvez就是一种基于腺相关病毒(AAV)的基因疗法,而蓝鸟生物目前拥有三款获批的基因疗法产品,包括两款慢病毒载体(LVV)基因疗法和一款CAR-T细胞疗法。狭义的基因疗法则专指基因递送治疗,其中以病毒和质粒DNA为载体的基因治疗产品较为常见,常用的病毒载体包括腺病毒(AdV)、腺相关病毒(AAV)、逆转录病毒(RV)和慢病毒(LV)。近年来,以AAV为载体的基因治疗因其技术优势逐渐成为研究热点之一,尤其是自2017年FDA批准罗氏/Spark Therapeutics的Luxturna以来,该领域的发展开始加速,截至目前,全球已有超过10款基因治疗产品获批上市。
图4.全球获批的基因治疗产品(图片来源:沙利文分析)
2012年获批的Glybera是第一个基于AAV载体的基因疗法。2017年,FDA批准Luxturna在美国上市,成为获批的首款体内给药式基因疗法。2022年FDA批准蓝鸟的体外基因改造细胞疗法Zynteglo用于需要输血的成人和儿童地中海贫血症患者的治疗,这是针对这一患者群体首款批准的基因疗法。值得一提的是,目前国内药企已有多个研究管线推进至关键临床阶段,预计近期将有产品获批上市。例如,天泽云泰利用其自主知识产权的ViVec® AAV载体筛选平台,研发了多款创新基因治疗产品,其中VGB-R04和VGM-R02b等三款产品已陆续进入临床阶段,并荣获FDA的罕见儿科疾病认定(RPDD)和孤儿药认定(ODD)。这些成就不仅彰显了中国在基因治疗领域的研发实力,也为全球罕见病治疗提供了新的希望。
五、国内企业加速布局基因疗法产品
作为全球生物医药产业竞争最重要的“新赛道”之一,国内各大药企在细胞与基因治疗领域展现出了强劲的创新活力。近年来,国内药企在基因疗法产品布局方面近年来显示出积极的态势,在基因疗法领域的布局正在加速,尤其是在基因编辑、细胞疗法和病毒载体治疗等领域。
1)基因编辑技术
国内药企如博雅辑因和纽福斯等技术领军企业,专注于利用CRISPR/Cas9和单碱基编辑技术开发治疗血液疾病、遗传性疾病及癌症的创新疗法。这些公司通过自体和异体细胞疗法实现疾病的一次性治愈潜力,覆盖广泛的疾病领域,包括血液瘤、实体瘤和遗传代谢性疾病。
2)细胞治疗
细胞治疗是基因疗法的另一重要领域,国内药企如复星医药、恒瑞医药和百济神州等已在癌症基因疗法领域加大研发投入。这些企业的研发总投入在2023年超过80亿元人民币,预计到2025年将突破120亿元人民币,显示出对基因疗法的高度重视和长期看好。
3)市场价值和应用
基因疗法市场价值极高,尤其是在特定罕见病和难治性癌症的治疗上。例如,CAR-T细胞疗法在血液瘤和淋巴系统肿瘤的治疗上已显示出显著效果,市场规模持续增长。随着技术进步和监管体系的逐步完善,基因疗法的商业化速度和市场接受度预计将进一步提高。
国产基因治疗产品在适应症覆盖上展现出广泛性,涉及眼病、血液病、代谢病、神经系统疾病等多个领域。在技术探索上,国内企业勇于创新,许多产品凭借坚实的技术基础和数据分析,成功走出国门,获得了美国FDA的孤儿药认定、儿童罕见病疗法认定以及突破性疗法等资质。目前,国内已经推进到临床试验阶段的国产基因治疗产品已经超过80款,绝大多数仍然处于早期临床试验阶段,少数已经进入确证临床试验(III期)。值得注意的是,信念医药的B型血友病基因治疗已在2024年7月向国家药品监督管理局(NMPA)递交上市申请,成为首个申请上市的国产基因治疗产品。
六、商业化前景与投资机会
商业化前景方面,基因疗法技术不断发展,如高通量测序、全外显子测序、无创产前检测等,提高了对遗传病、基因组学的认知,为基因疗法的商业化提供了基础。同时,基因治疗为遗传性疾病和难治性疾病提供了新的治疗选择,具有巨大的市场需求。尤其是在中国,随着经济增长和对医疗健康需求的增加,为基因疗法提供了更广阔的患者样本和市场空间。此外,多个国家和地方政府出台支持和规范基因治疗发展的政策,例如中国出台了《“十四五”规划和2035年愿景目标纲要》等相关政策,为基因疗法的发展提供了良好的政策环境。
投资机会方面,技术创新主要关注基因编辑技术如CRISPR-Cas9的持续优化,以及新型基因载体系统的开发,如腺相关病毒载体(AAV)的改进。此外,投资于早期基因疗法产品主要集中于遗传性疾病的治疗,如血液疾病、免疫系统疾病等,并逐步扩展至神经性疾病、癌症以及罕见病领域。同时,基因疗法研究的投资热度不断升温,全球范围内,众多生物技术公司、医药巨头以及投资机构纷纷布局基因疗法领域,推动该领域的快速发展。
依据中商产业研究院发布的《2017-2027全球及中国细胞和基因疗法药物输送装置行业深度研究报告》数据显示,全球基因治疗行业市场规模自2016年开始飞速增长。全球基因治疗市场的增长主要受到个性化医疗需求的增加、慢性疾病和罕见病的高发率以及细胞与基因治疗研究和开发的持续投入等因素的推动。根据最新的市场研究,全球基因治疗市场的规模在近年来呈现快速增长的态势。此外,中国市场也在积极发展基因治疗业务,依据中商产业研究院发布的《2024-2029全球及中国细胞和基因疗法药物输送装置行业深度研究报告》显示,2023年中国基因治疗行业市场规模达到约33.81亿元,较上年增长113.64%。据预测,到2025年,中国的基因治疗市场规模将超过100亿元人民币。这表明,中国在全球基因治疗市场中占据了重要的位置,并预计将持续扩大其市场影响力。这些数据显示出基因治疗领域的全球产业正在迅速扩张,预示着该行业未来在这一领域将继续保持强劲的增长势头。
图5.中国市场规模及预测(图片来源:中商产业研究院)
七、总结
总的来说,基因治疗作为医疗领域的璀璨新星,正以前所未有的速度改变着我们对疾病治疗的认知与实践。基因疗法药物市场正处于快速发展阶段,技术创新和政策支持为市场的发展提供了强大的动力。各大药企在基因治疗领域的布局,推动了行业规模的不断扩大。未来,随着技术的不断进步和市场需求的增长,基因疗法药物市场将迎来更加广阔的发展前景!
参考资料:
[1] 企业研发日报告、年度报告、季度业绩报告、研发管线报告.
[2] 冯雪娇,衡超,于新语,等.基因治疗行业市场分析及展望[J].中国生物工程杂志,2023,43(06):102-112.
[3] 中商产业研究院,《2017-2027全球及中国细胞和基因疗法药物输送装置行业深度研究报告》
[4] 中商产业研究院,《2024-2029全球及中国细胞和基因疗法药物输送装置行业深度研究报告》
立即扫码加入药事纵横交流群
细胞疗法基因疗法上市批准免疫疗法ASH会议
2025-08-19
·创药网
随着核酸药物、mRNA疫苗、基因编辑和细胞治疗等前沿技术不断突破,药物递送系统已成为创新疗法走向临床的关键一环。2025年上半年,多个国际顶刊密集发布新型递送系统的重大进展。同时,资本市场也高度关注递送技术赛道,相关平台交易频现,进一步凸显该领域在全球医药创新生态中的战略地位。
药物递送被誉为药物开发的“最后一公里”,其核心作用在于决定药物能否有效、安全地到达靶向部位,从而发挥应有的治疗效果。随着现代生物医药的迅猛发展,尤其是在核酸药物、mRNA疫苗、基因编辑与细胞疗法等前沿技术不断突破的背景下,传统递送系统已难以满足其复杂的递送需求。如何通过开发新型递送平台,提升药物的生物利用度、靶向性与安全性,已成为创新药研发中亟待解决的核心瓶颈。
近年来,新一代递送技术层出不穷,从脂质纳米颗粒(LNP)在mRNA新冠疫苗中的成功应用,到GalNAc偶联技术、类病毒颗粒(VLP)、智能响应材料与蛋白纳米颗粒等递送平台的快速发展,均显示出递送系统已从简单的药物载体演进为决定治疗成败的关键变量。本文系统梳理了2025年上半年在一些国际重要期刊中发布的新型药物递送技术成果,并汇总了全球药物递送平台的产业交易情况,展示出该领域的技术创新趋势与商业化潜力。
递送技术研发亮点与前沿成果
RNACap
2025年7月,哈佛医学院团队在Science Translational Medicine上发表突破性研究,他们开发了出一种名为RNACap的工程化胶囊系统,首次实现了液态mRNA纳米药物(NP)的高效口服递送。该胶囊能保护mRNA免受胃酸破坏,在肠道中响应中性pH、胶囊帽溶解后的压力释放及肠道蠕动快速释放内容物,通过NP介导mRNA进入肠道细胞实现转染。这项研究首次实现了液态mRNA的口服高效递送,成功突破胃肠道屏障,在急慢性结肠炎模型中展现出显著疗效与良好安全性。RNACap的出现不仅为mRNA药物的非注射给药开辟了新路径,更有望推动肠道疾病及系统性疾病治疗模式的革新。
TMAB3/RNA复合物
2025年7月,耶鲁大学研究团队在Science Translational Medicine上发表的一项突破性研究,为RNA疗法的系统性递送带来了新希望。他们开发了一种名为TMAB3的单克隆抗体,能够通过非共价结合方式与RNA形成稳定复合物,经静脉注射后可靶向递送治疗性RNA至胰腺癌、髓母细胞瘤、黑色素瘤等多种小鼠肿瘤模型,显著抑制肿瘤生长并延长生存期。
该研究的核心突破在于解决了RNA疗法系统性给药后的靶向递送难题,TMAB3对RNA具有高亲和力(KD达纳摩尔级),可形成直径约15.4nm的稳定复合物,不仅能保护RNA免遭降解,还可依赖癌细胞高表达的ENT2转运蛋白穿透细胞膜,实现在肿瘤组织的特异性富集,其递送效率较正常细胞高出1500倍。
RIDE
2025年2月,本导基因创始人、上海交通大学蔡宇伽教授联合本导基因、复旦大学眼耳鼻喉医院洪佳旭教授和阿斯利康Pinar Akcakaya团队在Nature Nanotechnology上发表一项突破性研究,展示了一种名为RIDE(Ribonucleoprotein delivery)的新型基因编辑递送工具。该技术通过VLP递送CRISPR/Cas9核糖核蛋白(RNP),实现了神经元细胞特异性的基因编辑,为亨廷顿病等难治性疾病的治疗提供了全新的思路。
研究团队开发的RIDE系统通过将CRISPR/Cas9 RNP封装在病毒样颗粒中,实现了细胞类型特异性的基因编辑递送。在编辑效率上,RIDE展现了与传统慢病毒载体递送系统不相上下的编辑效率,但具有瞬时性存在、脱靶风险低的特点,体现了在基因编辑治疗中的优势。RIDE递送的CRISPR/Cas9工具能够精确靶向亨廷顿HTT基因,成功在小鼠和非人灵长类动物中实现了高效的基因编辑。在亨廷顿病小鼠模型中,通过敲除CAG重复序列,降低突变亨廷顿蛋白的表达,显著改善了疾病症状。
ENVLPE
2025年4月,发表在Cell上的一项研究中,来自德国亥姆霍兹慕尼黑中心和慕尼黑工业大学的一个科学家团队开发出了一种全新的递送技术——ENVLPE(Engineered nucleocytosolic vehicles for loading of programmable editors),可将基因编辑系统以比先前更高的效率递送到活细胞中。ENVLPE基于工程改造的非感染性VLP开发。ENVLPE能够将所有主要的RNA引导的基因编辑工具(CRISPR-Cas9、碱基编辑器、先导编辑器)以RNP形式递送到多种细胞类型中,避免了DNA整合风险,并在人类原代T细胞以及两种遗传性视网膜疾病小鼠模型中展现了卓越的编辑效果,凸显了其治疗潜力。
ENTER
2025年5月,Nature Biotechnology上的一篇论文显示,研究人员开发了一种名为ENTER(Elastin-based nanoparticles for therapeutic delivery,基于弹性蛋白的治疗递送纳米颗粒)的新型递送系统,利用重组弹性蛋白样多肽(ELP)实现核酸和蛋白质的高效胞质递送。
通过四代(V1~V4)迭代设计,研究人员构建了融合阳离子内体逃逸肽(EEP)的ELP多嵌段蛋白聚合物。该系统在酸性内体环境中解体,通过质子海绵效应和膜破坏肽协同作用实现药物逃逸,克服了现有递送载体(如脂质纳米颗粒的肝蓄积、病毒载体的免疫原性等)的局限性。ENTER系统不仅能在体外将蛋白质、siRNA、mRNA和基因编辑工具高效、低毒地递送进多种细胞类型,包括关键的原代细胞,甚至在活体动物(小鼠肺部)中也成功实现了基因编辑。
双靶向SORT LNP
2025年6月,美国德克萨斯大学西南医学中心Daniel J. Siegwart教授团队在Nature Biotechnology上发表了题为“Dual SORT LNPs for multi-organ base editing”的研究论文,该研究主要开发了一种双重靶向的脂质纳米颗粒(Dual SORT LNPs),用于将碱基编辑器同时递送至肝脏和肺部,纠正导致α1-抗胰蛋白酶缺乏症(AATD)的基因突变,并在小鼠模型中实现了长达32周的稳定基因编辑效果,为多器官疾病的基因治疗提供了新的策略。
全球递送技术平台交易概况
近年来,创新药物递送平台成为资本和跨国药企关注的重点。从血脑屏障(BBB)穿越技术、肽类口服递送到人工智能(AI)驱动递送策略,多个前沿技术平台进入高额交易阶段,标志着该领域的商业化价值逐渐释放。以下为2025年上半年部分代表性交易(表1)。
表1:2025年1月~7月全球递送技术平台交易
2025年以来,药物递送技术持续加速演进。新一代递送平台逐步实现“智能化”“靶向化”“可编程化”的趋势,推动核酸药物、蛋白质药物、基因治疗等多类前沿疗法跨越从“可行”到“可及”的技术门槛。未来,随着AI辅助药物设计、组织特异性递送与免疫原性调控等技术进一步融合,药物递送有望从支持手段转变为核心竞争力,重塑全球新药开发模式。
【参考资料】
1. 谢雨礼. 药物递送技术的研究进展. 药学进展, 2024, 48(07): 523-535.
2. Huang X, Liu C, Sharma SN, et al. Oral delivery of liquid mRNA therapeutics by an engineered capsule for treatment of preclinical intestinal disease. Sci Transl Med, 2025, 17(807): eadu1493.
3. Quijano E, Martinez-Saucedo D, Ianniello Z, et al. Systemic administration of an RNA binding and cell-penetrating antibody targets therapeutic RNA to multiple mouse models of cancer. Sci Transl Med, 2025, 17(807): eadk1868.
4. Ling S, Zhang X, Dai Y, et al. Customizable virus-like particles deliver CRISPR-Cas9 ribonucleoprotein for effective ocular neovascular and Huntington's disease gene therapy. Nat Nanotechnol, 2025, 20(4): 543-553.
5. Geilenkeuser J, Armbrust N, Steinmaßl E, et al. Engineered nucleocytosolic vehicles for loading of programmable editors. Cell, 2025, 188(10): 2637-2655.e31.
6. Eweje F, Ibrahim V, Shajii A, et al. Self-assembling protein nanoparticles for cytosolic delivery of nucleic acids and proteins. Nat Biotechnol, Published: 15 May 2025.
7. Kim M, Song ES, Chen JC, et al. Dual SORT LNPs for multi-organ base editing. Nat Biotechnol, Published: 2 June 2025.
8. 丁香园Insight数据库, 检索日期: 2025年7月20日.
9. 医药魔方等网络报道.
本文其它内容请见《全球药物创新快讯》2025年第6期(总第153期)。
信使RNA基因疗法疫苗核酸药物细胞疗法
2025-08-12
·求实药社
中枢神经系统(CNS)一直是医学研发中最具挑战性的领域之一。从阿尔茨海默病到精神分裂症,从神经退行性疾病到罕见脑病,CNS 疾病不仅深刻影响患者生活质量,也持续推动全球医疗科技的创新突破。
为便于行业观察与交流,本文汇总整理了63位深耕CNS领域的企业创始人及CEO(排名不分先后)。所列信息来自公司官网及公开资料,如有更新滞后,敬请谅解。
本次为上篇,下篇将于近期发布。
1、Christophe Weber ,武田制药,代表董事 - 总裁兼首席执行官Christophe Weber是武田的总裁、首席执行官(CEO)兼代表董事。他于2014年4月加入公司担任首席运营官,于2014年6月被任命为总裁兼代表董事,随后于2015年4月被任命为首席执行官。Christophe一直致力于通过全球化和研发转型来确保公司的竞争力,同时创造多元化和包容性的工作环境,并加强武田的道德价值观和公司治理。通过这一转型,武田已成为全球领先的生物制药公司之一。
在加入武田之前,Christophe在葛兰素史克工作了20年,在欧洲、亚洲和美国担任高级领导职务。
Christophe 是美国商业理事会、世界经济论坛国际商业理事会、纽约证券交易所纽约证券交易所董事会咨询委员会、马萨诸塞州竞争伙伴关系董事会、麻省理工学院首席执行官顾问委员会和新加坡人类健康与潜力国际咨询委员会的成员。他还在东北大学董事会任职。
Christophe 拥有法国里昂大学药学和药代动力学博士学位、药品营销和会计与金融硕士学位以及统计学学位。
2、Robert A. Michael,艾伯维,董事会主席兼首席执行官
Rob Michael 是艾伯维的董事会主席兼首席执行官,艾伯维是一家全球生物制药公司,在全球拥有约 55,000 名员工,已为超过 175 个国家/地区的 6000 多万人提供创新药物和产品。
Michael 先生于 2024 年被任命为首席执行官,此前曾担任艾伯维总裁兼首席运营官,并且一直是艾伯维执行领导团队的长期成员。从建立艾伯维的第一个财务规划组织,到制定其多元化业务战略,再到在美国修美乐失去独家经营权后的两年内成功使公司恢复收入峰值,迈克尔先生多年来一直是艾伯维成功和发展不可或缺的一部分。在担任总裁兼首席运营官期间,Michael 先生负责公司的全球商业运营、财务、企业人力资源、全球运营、业务发展和企业战略。他曾于 2022 年被任命为副董事长兼总裁,于 2021 年被任命为财务和商业运营副董事长,并于 2018 年被任命为首席财务官。Michael 先生拥有 30 多年的经验,包括在制药、美容、诊断、糖尿病护理和营养等多个业务中担任领导职务。他的职业生涯始于雅培,是金融发展计划的成员。
Michael先生在印第安纳大学凯利商学院获得会计学学士学位,在加州大学洛杉矶分校安德森管理学院获得工商管理硕士学位。
3、包杨欢,普百思生物创始人、CEO
创建普百思生物,并带领团队建立大数据驱动的、针对精准患者亚群的CNS“靶向疗法” 技术平台和管线。
归国前,曾在美国冷泉港实验室神经生物学系从事CNS疾病分子遗传学研究多年,并参与创立和运营一家CNS药物研发服务公司。
参与投资30余家生物医药医疗公司,其中包括天使轮或者第一次机构投资纳微科技、纽福斯、康立明生物、优脑银河等。
4、蔡宇伽,本导基因,创始人
基因治疗领域顶尖华人科学家,基因治疗载体技术专家,丹麦奥胡斯大学博士,中国生物工程学会系统生物医学专业委员会委员。长期从事基因治疗病毒载体、基因编辑递送技术的研发以及基因治疗载体与机体免疫系统互作的研究,致力于新技术的临床转化。
5、陈柏州,加立(深圳)生物科技有限公司,联合创始人兼首席执行官
陈柏州先生毕业于麻省理工学院,曾任职多家知名跨国药企,担任研发领导职位,包括新旭生技全球临床研发高级副总裁、联合生物制药公司总经理、PPD北亚区临床管理负责人等。
6、陈晨,璧辰医药,创始人兼CEO
陈晨博士是ABM的创始人和首席执行官。创建ABM之前,他曾担任桑迪亚的总经理,在任期间,公司从200多人发展到了500多人。陈晨博士拥有20多年在中枢神经药物研发方面的经验,其中包括在专注神经系统药物研发的纳斯达克上市公司Neurocrine Bioscience15年的工作经验。陈博士由研究员起步,直至升任该公司的药物化学高级研发主任, 并在新药发现领域取得了多项令人瞩目的成绩。他研发出两个促性腺激素释放激素受体小分子拮抗剂,NBI-42902和 Elagolix,并推进到临床研究。其中 Elagolix 是10多年来,FDA 批准的第一个治疗子宫内膜异位导致的中度到重度疼痛的口服药。
陈晨博士获得厦门大学化学学士学位,随后在中国科学院上海有机化学研究所师从已故黄耀曾院士并获得博士学位。在美国德克萨斯 A & M 大学他跟随诺贝尔化学奖获得者巴顿爵士进行博士后训练。陈博士已在《全美化学学报》、《有机化学学报》、《药物化学学报》、和《生物化学学报》等专业期刊发表了近130篇论文,也是25+项美国专利的共同发明者。
7、陈东浩,杭州畅溪制药,CEO
陈东浩博士在吸入产品开发与制药企业管理方面,拥有25+年的行业经验。
他是 AIR 的联合创始人兼创始科学家,后作为Alkermes的CMC负责人主导了两个早期临床阶段的吸入产品开发,包括与礼来合作开发的吸入胰岛素。2006至2010年,陈东浩博士加入一家位于美国波士顿的全球领先的RNAi公司——Alnylam,担任研发总监,领导建立 siRNA 给药平台,并作为项目负责人带领团队成功完成了世界首例吸入小核酸治疗RSV一期临床实验。随后,陈东浩博士回到中国,出任 Chemo集团(中国)公司总经理,积累了丰富的全面管理,及与国家法规机构沟通的实践经验。
陈东浩博士于1997年获得瑞士苏黎世联邦理工学院(ETH-Zurich)授予的博士学位,并作为访问学者于1998到2000在麻省理工学院 Langer's实验室工作。
8、陈功,神曦生物,创始人、董事长
陈功教授是国家特聘专家,海外高层次人才(A类大千),暨南大学粤港澳中枢神经再生研究院大脑修复中心主任。1987年毕业于复旦大学,1993年获得中科院上海生理所神经生物学博士。1994年赴美国耶鲁大学和斯坦福大学做博士后研究。自2002年起历任宾夕法尼亚州立大学助理教授,副教授(终身教授),正教授,2013年被授予维恩 魏勒曼冠名主任教授(讲席教授)。2020年全职加入暨南大学,担任大脑修复中心主任,推动大脑原位神经再生技术向临床应用的转化。陈功教授领导的团队在国际上首次报导了用神经转录因子NeuroD1将大脑内源性胶质细胞原位高效地转化为功能性神经元这一里程碑工作,被干细胞顶尖杂志Cell Stem Cell评为2014年度最佳论文,为大脑修复开辟了全新的神经再生型基因疗法。2015年再次在Cell Stem Cell上发表小分子化合物诱导培养的人源胶质细胞高效转化为功能性神经元的工作,为开发利用脑内胶质细胞再生神经元的药物疗法奠定了基础。2020年又在国际上首次发表灵长类大脑原位神经再生的里程碑工作。
陈功教授已经获得58项国内国际发明专利授权,覆盖中国,美国,欧盟,日本等主要经济体国家。2021年,陈功教授创办的NeuExcell神曦生物与国际著名药企罗氏制药旗下的Spark达成合作协议。2023年,神曦生物被国际权威机构沙利文授予“亚太基因治疗创新奖”,同年获得全国创新创业大赛总决赛一等奖。2024年,神曦生物的胶质瘤基因治疗产品NXL-004成功完成全球首例恶性胶质瘤患者的NeuroD1 AAV基因治疗给药,实现从基础研究到临床转化的0到1的突破。2025年3月和4月,又相继启动了全球领先的 First-in-Class 原位神经再生疗法治疗脑卒中和阿尔兹海默症的临床试验,为千千万万的患者带来福音。
9、陈泓恺,安立玺荣生物医药,CEO
陈泓恺博士为安立玺荣生医创办人,身兼董事长及执行长,执掌公司营运管理事务及发展策略方向,具有多年於国际药厂新药开发经验,专长于创新型药物之转译医学研究及临床前到临床开发。
在创立安立玺荣生医之前陈博士曾任职於雅祥生技医药股份有限公司担任资深副总裁兼医务长,领导治疗神经疾病新药之临床开发。在此之前曾任职於生物技术开发中心担任转译医学主任,建立跨领域转译医学平台并主导多项肿瘤免疫新药开发计画包括PD-L1及TIM3免疫检查点抑制剂单株抗体及CSF -1R小分子抑制剂等及双特异性抗体开发计划。在此之前陈博士任职於跨国大型药企葛兰素史克(GlaxoSmithKline)上海研发中心,担任神经免疫疾病研究部主任研究员。
期间建立人类干细胞分化神经元高通量药物筛选平台,并主持数项神经免疫疾病之新药开发项目并参与脑中风抗体新药第二期人体临床试验。在加入葛兰素史克之前,陈博士任职於美国加州大学旧金山分校所属格拉斯通研究所转化研究中心担任助理研究员,其间与美国默克药厂合作进行阿兹海默症新药研发,并发现ApoE4造成神经元粒线体功能缺失之分子机制,建立神经元粒线体功能筛选平台,开发出高效调节ApoE4功能之前导药物。
在此之前陈博士曾任职於阳明大学微生物及免疫学研究所助理教授。 陈博士为阳明大学医学士及微生物及免疫学博士,曾於美国贝勒医学院人类分子遗传学研究所博士后进修,并担任霍华德休斯医学研究所博士后研究员。有多项研究发明成果曾发表在包括Cell, Nature Medicine,Nature Communications等国际顶尖科学期刊。
10、陈小祥,元羿生物,创始人,CEO
陈小祥先生在生物医药行业有超过25年的经验,聚焦创新治疗的临床转化和开发,在多家企业成功创建临床研发团队,包括惠氏、勃林格殷格翰和和铂医药。他带领团队成功完成临床开发和法规注册,先后将超过20 种创新药物引入到中国市场。
加入元羿生物前,陈小祥先生自2017年起作为联合创始人参与创建和铂医药,并作为首席开发官全面负责公司的产品研发,包括临床前、CMC、临床开发和法规注册直至产品获批上市。在这之前,陈小祥先生在德国勃林格殷格翰公司曾经分别担任过大中华区以及新兴市场副总裁、医学主管,全面负责在地区内所有国家,包括临床开发、注册法规、医学事务、生物数据管理等等医学研发相关工作。在加入勃林格殷格翰前,陈小祥先生在美国惠氏制药长达12年的工作期间,分别担任过大中华区医学总监、亚太临床开发总监以及中枢神经领域的全球医学监察员等职务。
陈小祥先生从南京医科大学获得临床医学学位。
11、崔霁松,诺诚健华,联合创始人&董事会主席兼首席执行官
• 逾30年医药行业研发和公司管理经验
• 曾任PPD公司BioDuro的首席执行官兼首席科学官
• 默克美国心血管疾病早期开发团队负责人
• 霍华德休斯医学研究所博士后
• 普渡大学分子生物学博士
• 美中医药开发协会(SAPA)第17届主席
12、代红久,南京凯地生物,联合创始人、董事长&CEO
代红久博士为南京凯地医疗技术有限公司创始人、总裁兼董事长。代红久博士以第一发明人身份申报实体瘤CAR相关中美专利数十件,其中授权中美专利15件,2007年代红久博士取得中国科学院研究生院博士学位,次年赴美从事与CAR-T相关的T细胞免疫、GPCR受体功能与癌症发生机理的博士后研究,2013回国加入金斯瑞,先后任高级研究员、部门总监。近年,代红久博士已在《Science》 《PNAS》《Cancer Immunology Research》《Journal for ImmunoTherapy of Cancer》等国际权威杂志发表论文8篇,待发表文章4篇。利用先进合成生物学CAR发现平台已成功开发多款自主知识产权新型实体瘤CAR-T管线,适应症涵盖结直肠癌、肝癌、胃癌、胰腺癌、胶质瘤等多种实体肿瘤,目前多个核心管线进入IIT临床和中美IND申报阶段,公司已完成近亿元融资,正在启动B轮融资。凯地医疗获得2022南京市“培育独角兽称号”并荣登“星耀榜--2021中国生物医药企业最具创新力50强及中国医药创新种子100强企业。
13、董良昶,上海汉都医药,联合创始人、首席科学家、董事长兼总经理
药物递送系统专家
控释制剂和材料科学专家
华盛顿大学生物医药工程博士,师从被誉为“生物材料之父”的美国工程院科学院院士 ProfAllanS.Hoffman全球控释学会(CRS)首届杰出研究生奖获得者
在ALZA和J&J担任技术高管(SeniorResearchFellow)和口服制剂研发部门主任(Director,OralProductsR&D)多年;在药物控制释放理论、
新型药物递送技术及其新药产品开发方面具有很深的造诣和丰富的经验
拥有发明专利100多项,其中获得美国专利约50项
14、杜莹,再鼎医药,董事长&首席执行官
杜莹博士现任再鼎医药创始人、董事长兼首席执行官,她是一名成功的医药研发者、企业家、投资人。
杜莹博士于1994年加入美国辉瑞,参与了不同疾病领域内的多个前期及后期药物项目的研发,其中两款药物获得美国食品药品管理局批准上市。她还曾担任辉瑞全球代谢类疾病项目转让及兼并收购部门的科学主管。之后,她作为联合创始人创立了和记黄埔医药及和黄中国医药科技(现更名为和黄医药),分别担任两家公司的首席执行官及首席科学官。她于2012年加入红杉资本中国基金,担任董事总经理,负责多项医疗健康产业的投资。
杜莹博士于2014年创立再鼎医药,致力于解决全球患者的未满足临床需求。
因其卓越的贡献,杜莹博士被授予多个国际奖项和荣誉称号,包括来自FierceBiotech、福布斯的奖项。杜莹博士在辛辛那提大学取得生物化学博士学位。
15、范靖,浙江霍德生物工程有限公司,创始人&CEO
北京大学生命科学院 学士
加拿大不列颠哥伦比亚大学 博士
前美国约翰霍普金斯大学神经科学及细胞工程所博士后
研究员,入选杭州市521人才计划,浙江省领军型人才计划,2018第二届华侨华人创新创业精英榜30强
入选2022年福布斯“中国科技女性TOP50”
17年中风及神经退行性疾病模型和机制的研究经验,10年多能干细胞培养、iPSC重编程及神经分化经验,带领团队建立了公司iPSC及神经分化技术及产品研发平台
16、管小明,福贝生物科技(苏州)有限公司,共同创始人、CEO
管博士有27年在制药工业界从事研发和领导团队的经验,聚焦神经系统疾病新药开发。在创建福贝生物之前,管博士曾任葛兰素史克(GSK)研发副总裁,神经退行性疾病研发部主任,领导一个多学科的全球团队开发包括阿尔茨海默氏症和帕金森病新药的端至端研发管线。在此之前,管博士在美国默克公司(Merck Research Labs)从事代谢和中枢神经系统疾病新药研发18年,积累了丰富的药物研发、项目管理经验。管博士曾担任AMP-AD(一个国际合作联盟组织)的创始领导小组成员,促进政府、学术界和工业界间的合作创新以推动全球阿尔茨海默氏症新药开发。
管博士毕业于复旦大学上海医学院。考取CUSBEA计划赴美留学并获得美国印第安纳大学医学院生物化学博士学位。随后在美国斯坦福大学及霍华德休斯医学研究所从事博士后研究。
17、韩照中,领诺医药,创始人、董事长兼首席执行官
1991年获武汉大学病毒学学士,1997年获军事医学科学院医学遗传学博士。
2002年在美国国立卫生研究院(NIH)肿瘤研究所(NCI)完成药物发现研究方向博士后训练后,加入能源部Argonne国家实验室(ANL)参与功能基因组研究计划。
2004年加入Vanderbilt University医学院任终身轨助理教授,在NIH基金资助下从事肿瘤生物学的基础与转化医学研究。
2013年加入Alexion医药公司,开发双特异抗体研发平台,参与Strensiq®的BLA申请(2015年获EMA、FDA批准)并领导多个针对严重罕见病特别是靶向补体异常活化的治疗性项目的立项、实施和对外交流,有多个项目进入临床开发阶段。
2017年底回国负责睿智化学(ChemPartner)抗体发现与工程改造技术平台,2019年8月在浦东张江药谷注册成立领诺医药。
18、何志刚,迈巴制药,联合创始人
哈佛医学院神经病学和眼科教授。
波士顿儿童医院病毒核心主任。
轴突再生、神经变性和髓鞘再生研究的世界领导者。
美国国家医学科学院 (NAM) 院士。
克林根斯坦神经科学研究员、约翰默克学者、麦克奈特学者、里夫-欧文研究奖章获得者。
多伦多大学博士,加州大学旧金山分校 Marc Tessier-Lavigne 博士后研究。
Rugen 联合创始人(项目授权给 McQuade 战略研究与发展中心)。
19、洪志,腾盛博药,联合创始人兼首席执行官
洪志博士于2018年作为联合创始人创立了腾盛博药,自公司成立以来一直担任首席执行官。在创立腾盛博药之前,洪博士曾在葛兰素史克(GSK)担任感染性疾病治疗领域高级副总裁和部门负责人。洪博士被认为是GSK在抗艾滋病、抗乙型肝炎病毒和抗生素药物研发领域重塑辉煌并取得成功的关键缔造者。在他的领导下,艾滋病疗法Tivicay、Triumeq、Cabenuva和Apretude获得批准,这使ViiV Healthcare公司(GSK、辉瑞和盐野义制药共同成立的一家合资企业)的艾滋病治疗药物研发业务重新焕发活力。此外,他还领导了Gepotidacin(革兰氏阴性抗生素)和Bepirovirsen(抗HBV新药)的研发,并均进入后期研发阶段。
洪博士同时也是公共卫生的倡导者,他协助美国及欧盟政府(DTRA、BARDA、NIH和IMI)以及慈善组织(盖茨基金会和维康信托基金)建立了多个公私合作伙伴项目。在GSK,洪博士是艾滋病长效治疗和预防疗法的引领者,在他的带领下,艾滋病注射治疗药物Cabenuva和Apretude获得同类首个批准。洪博士还帮助在北京创建了GSK的传染病和公共卫生研究所,并创立了Ardea生物科学公司(后来被阿斯利康收购)。他还曾在Valeant Pharmaceuticals和Schering-Plough研究所(现为默克)担任领导职务。洪博士在药物研发领域拥有超过25年的从业经验,并推动40多种化合物投入研发,其中多种化合物已经获批并商业上市。他还曾担任ViiV Healthcare公司的董事会成员。
20、李锋,天广实生物,董事长、总经理(首席执行官CEO)
负责公司的整体管理、公司战略、监管审批、商业发展和可持续性。
李锋博士拥有逾22年的生物制药行业经验,曾在美国担任Genentech研发部主任工程师与Amgen资深科学家等职务。
21、罗文,杭州索元生物医药股份有限公司,董事长、总经理
罗文博士是索元生物的创始人及董事长,在基因组学、精准医疗、肿瘤及精神类疾病的创新药研发有多年的经验。在创立索元生物之前,Wen Luo博士任职于美国Ligand公司,领导和参与了多个第二代核激素受体调节药物的开发研究,从事激素受体的分子机理、组织器官选择性、药物筛选试验的建立等工作,并负责为在处于不同研发阶段的多种药物制定和执行生物标志物策略。Wen Luo博士还曾在美国Corvas生物科技负责开发新的蛋白酶新药靶点,任职于美国基因公司Incyte Genomics, Inc.参与管理当时全球最大的蛋白质组数据库LifeProt,并从事新型药靶基因及其剪接变异体研发的工作,在美国Sugen生物科技公司从事癌症、免疫疾病、血管生成领域开发和鉴定新药物靶点的工作。Wen Luo博士先后就读于北京协和医学院、印第安纳州印第安纳大学医学院,拥有分子生物学和生物化学博士学位,并在加州大学旧金山分校担任霍华德·休斯医学研究所博士后研究员。
22、李龙,穹顶科技,CEO
李龙,西安交通大学生物医学工程博士、博士后、助理教授,师从中国神经调控领域著名专家王珏教授。
主要研究方向为神经系统功能干预技术、高频超高频信号神经调控技术、穿戴式医疗器械、医疗信息系统、医学信息检测技术。发表相关领域SCI论文多篇,参与国家级、省部级重点课题多项。
曾就职于中兴通讯股份有限公司,主要从事128通道5G基站双工器研发;小型化4G射频天线研发。工作以及宜兴4G基站建设招标项目,具有丰富的产业转化经验。
23、李龙承,中美瑞康,创始人,董事长兼首席执行官
李龙承博士是RNA激活疗法的开创者,他拥有临床医学、基础科学研究、生物信息学和小核酸药物研发等多学科背景,为其开发RNA激活疗法提供了坚实的基础。在美国加州大学旧金山分校(UCSF)担任副教授期间,李博士结合了他的临床经验和科学探索,在RNAa研究领域取得了重要突破。李博士在不同科学领域均卓有建树。他建立了生命科学领域被广泛使用的ProtocolOnline数据库,并开发出了MethPrimer等重要生物信息学工具。自2016年创立中美瑞康以来,李博士一直致力于开发突破性的saRNA疗法,以开创一个全新的成药机制。在创办中美瑞康之前,他曾任中国医学科学院北京协和医院特聘教授和中心实验室主任。李博士多次应邀到国际学术会议、大学和工业界包括AInvlam Pharmaceuticals、Merck、Sigma和Genentech进行专题演讲。
24、李帅,上海赛默罗生物科技有限公司,创始人
中国科学院神经科学研究所博士学位
十五年疼痛研究及神经系统疾病研究经验
前中科院疼痛医学研究中心副主任
25、李翔,士泽生物医药(苏州)有限公司,创始人、CEO
李翔博士,北京大学博士,美国威斯康星大学麦迪逊分校博士后,美国帕金森病基金会研究员,江苏省高级工程师,现任士泽生物医药(苏州)有限公司CEO、董事长。自全职归国创立士泽生物后,李翔博士获评江苏省双创团队领军人才、姑苏重大创新团队领军人才、姑苏创新创业领军人才、国家生物药技术创新中心首席科学家等。李翔博士专注iPSC衍生细胞创新药的科学研发及产业化十五年,以第一或通讯作者在Cell Stem Cell等国际著名期刊发表论文十余篇,引用率千余次,作为第一发明人申请国内及国际专利三十余项。
在李翔博士领导下,士泽生物多款GMP级通用型iPSC衍生神经细胞治疗多项重大或危重神经系统疾病,已获中国药监局及美国FDA正式完全批准的6个注册临床试验批件;获批两项国家级备案干细胞临床研究,包括完成中国首例帕金森病及全球首例渐冻症细胞治疗;通用型iPSC衍生神经细胞创新药用于治疗渐冻症为中国首个自主iPSC衍生细胞药获得FDA认证并授予全球孤儿药资格。士泽生物已完成由著名市场化风险投资机构集体领投的多轮数亿元融资:由峰瑞资本、启明创投、礼来亚洲基金、红杉中国、泰珑/泰鲲资本等多家知名市场化机构领投及多轮持续投资,其中包括2022-2024年在生物医药领域寒冬期的逾3亿元A/A+/B1轮市场化融资。
26、李扬,广州瑞臻再生医学,联合创始人、肿瘤免疫高级科学家、北京大学医学院
受教育经历
2003/09-2007/07, 北京大学,基础医学院,博士,导师:李凌松 教授
2000/09-2003/07, 内蒙古大学,生命科学院,硕士,导师:旭日干 院士
1996/09-2000/07, 内蒙古农业大学,生物工程系,学士
工作经历
2014/08-今, 北京大学基础医学院,副教授
2021年至今,广州瑞臻再生医学科技有限公司 联合创始人 肿瘤免疫高级科学家
2014/09-2016/08, 加拿大多伦多大学,Sunnybrook研究所,博士后,
合作导师:Juan Carlos Zuniga-Pflucker 教授
2007/08-2014/08, 北京大学基础医学院,讲师
研究方向
人多能干细胞(ES,iPS)罕见病模型的构建
人多能干细胞分化的分子调控机制
人多能干细胞定向NK、T细胞分化在肿瘤免疫治疗中的应用
27、李宗海,科济生物,创始人&上海市肿瘤研究所研究员
于2018年2月获委任为董事及于2021年2月获委任为首席执行官兼首席科学官。他于2021年2月获重新委任为执行董事。
李博士亦在科济生物任职。他自2014年10月起担任董事及首席执行官,并自2017年12月起担任首席科学官。
李博士在生物制药领域有约20年工作经验。加入本集团之前,李博士曾于2000年7月至2002年4月在桂林华诺威基因药业有限公司担任项目经理。李博士于2005年7月至2018年6月在上海市肿瘤研究所任职并于该期间在上海市肿瘤研究所癌基因及相关基因国家重点实验室担任生物疗法研究组组长。
李博士致力于为癌症患者开发创新疗法。他早期的研究成果之一是对EGFR的肽配体GE11的识别,GE11已成为目前广泛应用于抗肿瘤研究的非天然肽。他还发明了多种新技术,如Hpd3cell,一种新的噬菌体显示技术;FR806,一种新的T细胞治疗安全开关;CycloCAR技术,以增加嵌合抗原受体(CAR)T细胞的抗肿瘤活性。他发表了全球第一篇针对GPC3、Claudin18.2和EGFR/EGFRvIII的CAR-T细胞疗法论文,在实体肿瘤CAR-T细胞疗法研究方面拥有领先地位。李博士为上海交通大学医学院附属仁济医院上海市肿瘤研究所的教授及上海交通大学医学院附属仁济医院博士生导师。
李博士分别于1997年6月和2000年7月获得中国中南大学(原湖南医科大学)的预防医学学士学位和病理学与病理生理学硕士学位。他于2005年6月在中国复旦大学获得病原生物学博士学位。李博士于2018年被评为上海市领军人物并于2019年荣获上海市青年科技杰出贡献奖。李博士于2019年荣获上海市五一劳动奖章。
28、利民,赛神医药,创始人兼首席执行官
Min 在美国和中国的学术界以及生物制药和风险投资行业拥有 30 多年的领导经验。他在神经科学领域的广泛知识和见解促使 SciNeuro Pharmaceuticals 于 2020 年底成立,致力于中枢神经系统疾病的创新疗法的开发。Min 目前还担任礼来亚洲风险投资公司 (LAV) 的风险合伙人和天基医药(ADAG,纳斯达克)的董事。在加入LAV之前,他曾担任葛兰素史克高级副总裁兼神经科学研发治疗领域负责人,以及研发中国区总经理。在他职业生涯的早期,李博士是约翰霍普金斯大学医学院神经科学的正教授。他拥有约翰霍普金斯大学分子免疫学博士学位;在加州大学旧金山分校接受神经科学博士后培训。
29、梁从新,高光制药,董事长兼CEO
梁博士是世界著名药物设计专家,美国普林斯顿大学博士。他先后在美国的大小公司(Sugen,Pfizer)和著名Scripps Florida研究所担任药物化学部主任,并作为科学创始人于2006年创立Xcovery公司,开创了VIC新药研发模式。
梁博士有30多年新药设计和开发经验,先后发明多个国际著名创新药。主要有:在Sugen(后被辉瑞收购)担任药物化学部主任期间,作为主要发明人,成功研发治疗胃癌和肾癌的抗癌新药舒尼替尼,该药于2006年在欧洲和美国获批上市,上市以来连续十多年都是年销售10亿美元以上。
作为Xcovery首席科学家和恩莎替尼、伏罗尼布化合物的唯一发明人,主导了全球的开发。恩莎替尼成功在中国和美国获批上市,伏罗尼布在中国上市。梁博士作为化合物专利的发明人,设计了世界首个高活性、高选择性并能通过血脑屏障的TYK2/JAK1双抑制剂以及高光制药管线中的其它化合物。
30、梁子才,苏州瑞博生物技术股份有限公司,创始董事长、首席执行官
梁子才博士现担任创始董事长、首席执行官。梁子才博士于2007年作为主要创始人创立瑞博生物。他主要负责公司的发展战略制定、小核酸创新技术的研发战略制定和实施、以及公司筹资事宜,同时承担公司及董事会委托的其他工作。
梁子才博士是中国小核酸技术和制药领域的主要开拓者,深耕小核酸研究领域20余年,为多个国家级研究计划做出贡献,曾任北京大学分子医学研究所长聘教授、研究室主任、教育委员会主任,中国生物化学与分子生物学会核糖核酸专业委员会副主任委员,瑞典卡罗琳斯卡医学院研究室主任、副教授。
梁子才博士于瑞典乌普萨拉大学获得博士学位,于美国耶鲁大学完成博士后研究。
31、林卿,凌意生物,CEO
林卿博士现任凌意生物创始人及CEO,前药明康德罕见病中心负责人。林卿博士本科及博士均在浙江大学生物系获得,毕业后在复旦大学遗传所任讲师。1999年赴美国Vanderbilt大学从事功能基因组研究近10年,从博士后到助理教授。在Nature, Nature Biotech, PNAS等重要期刊上发表论文20多篇。在医药工业界也有十几年的经验,曾在桑迪亚、辉瑞及药明康德等公司担任重要领导岗位。在遗传性罕见病、肿瘤免疫和自身免疫病等领域有丰富的研发成功案例。
32、刘俊文,神桥医学,创始人、精神科主治医师
上海交通⼤学医学院精神医学硕⼠,精神药物临床试验医学审查员、稽查员,中国QA论坛(CQAF)会员。
6年+三甲医院临床⼀线⼯作经验,5年+临床试验医学⽀持经验,拥有2项医学审查(Medical Review)相关发明专利。负责医学支持中心的运营与管理。
往期推荐
RECOMMEND
年度医药人盘点:40位ADC药企CEO盘点
年度盘点:30位小核酸领域CEO资料整理!
年度医药人盘点:70位小分子创新药企CEO盘点
联系我们
ICNS 2025
展位火热预定中!
扫码立即咨询
电话:13816031174
(同微信)
赞助形式包括但不仅限于演讲席位、会场展位、会刊彩页、晚宴赞助、会议用品宣传等。
点击此处“阅读全文”咨询更多!
高管变更
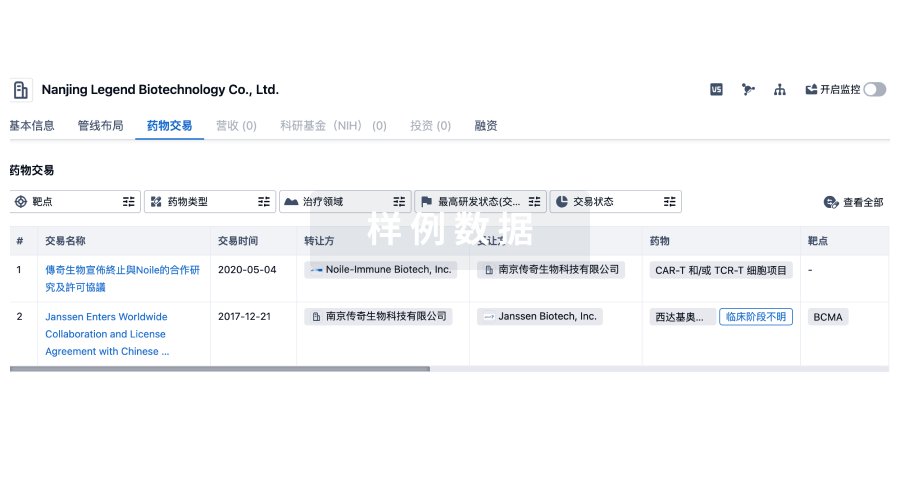
100 项与 上海本导基因技术有限公司 相关的药物交易
登录后查看更多信息
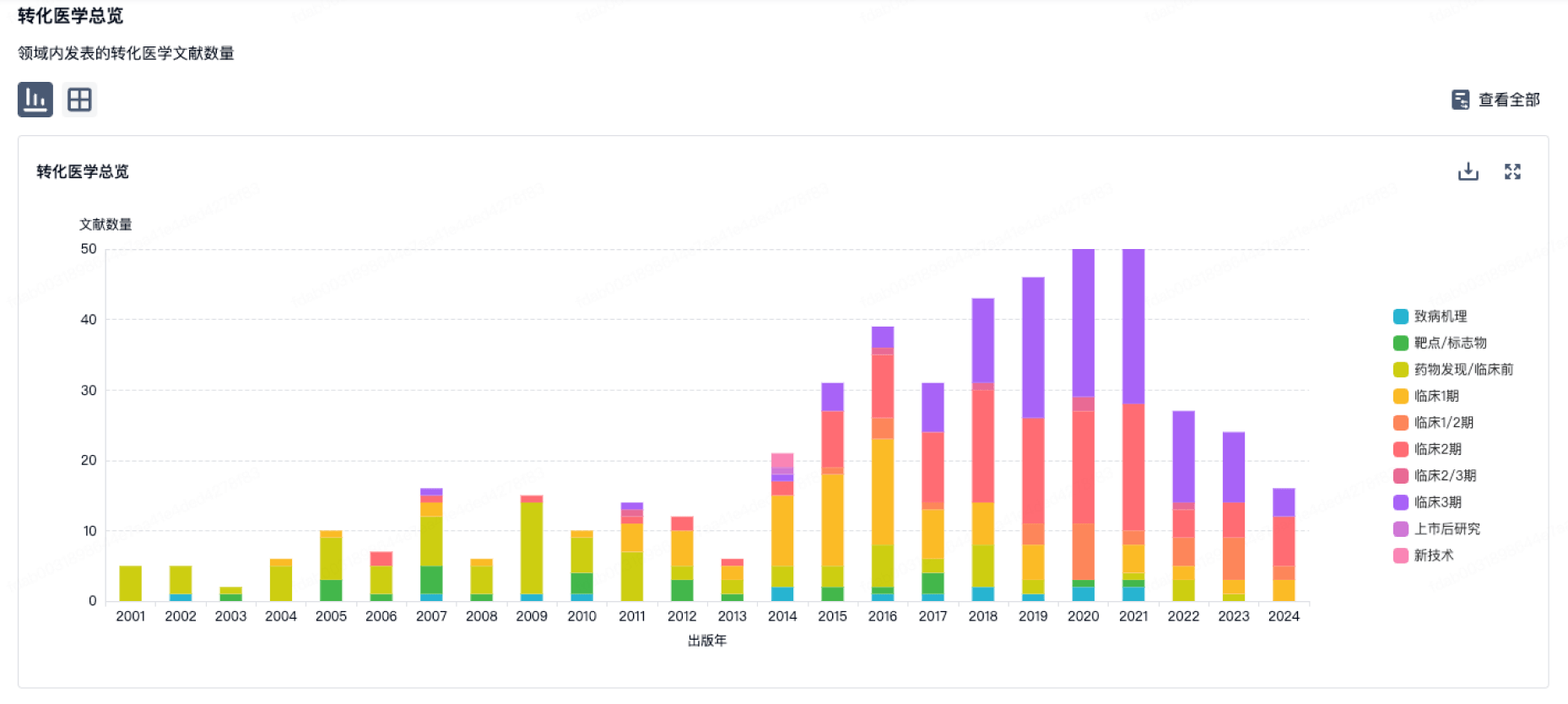
100 项与 上海本导基因技术有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年09月13日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
药物发现
1
7
临床前
临床1期
1
2
临床2期
其他
8
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
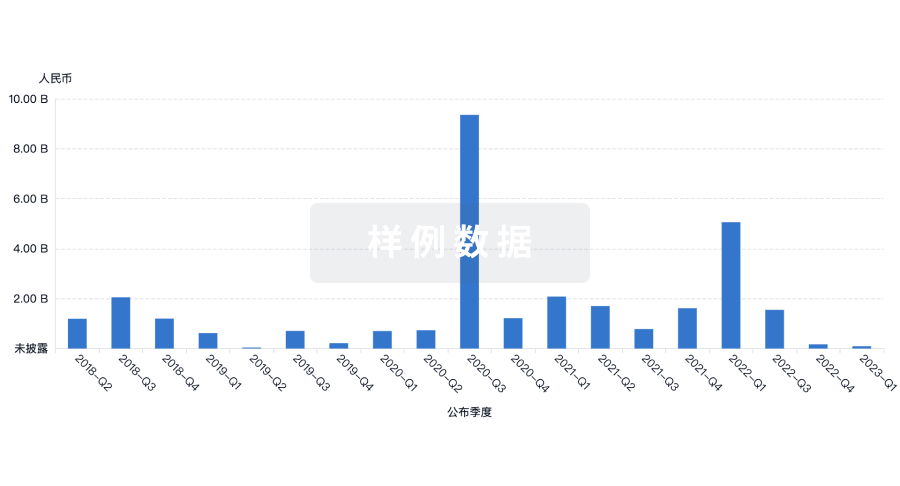
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用