Molecular Cancer: 靶向DDIT4-AS1及其通路可能是治疗胰腺导管腺癌化疗耐药的有效策略
2022-09-22

Preview
来源: 生物谷
图片来源: https://doi-org.libproxy1.nus.edu.sg/10.1186/s12943-022-01647-0
近日,来自天津医科大学肿瘤研究所的研究人员在Molecular Cancer杂志上发表了题为“The m6A demethylase ALKBH5-mediated upregulation of DDIT4-AS1 maintains pancreatic cancer stemness and suppresses chemosensitivity by activating the mTOR pathway”的文章,该研究揭示了ALKBH5介导的m6A修饰导致DDIT4-AS1在胰腺导管腺癌(PDAC)中过表达,DDIT-AS1通过破坏DDIT4的稳定性和激活mTOR通路而增加肿瘤的干性并抑制对GEM的化疗敏感性。靶向DDIT4-AS1及其通路可能是治疗PDAC化疗耐药的有效策略。
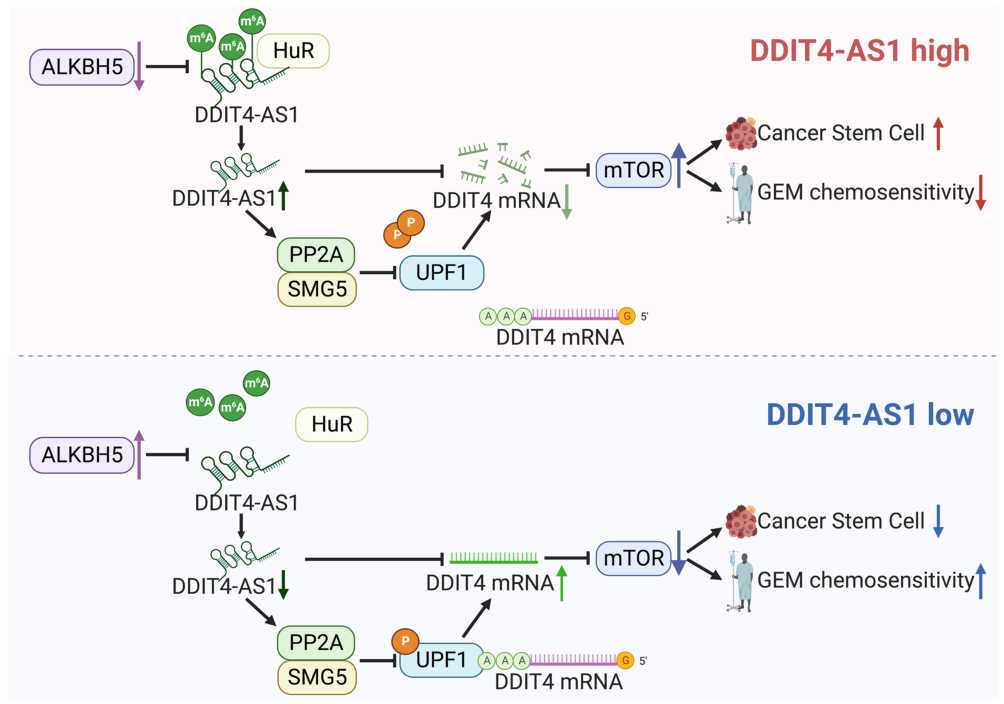
Preview
来源: 生物谷
机制总结示意图
图片来源: https://doi-org.libproxy1.nus.edu.sg/10.1186/s12943-022-01647-0
参考文献
Yi Zhang et al. The m6A demethylase ALKBH5-mediated upregulation of DDIT4-AS1 maintains pancreatic cancer stemness and suppresses chemosensitivity by activating the mTOR pathway. Mol Cancer. 2022 Sep 2;21(1):174. doi: 10.1186/s12943-022-01647-0.
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
机构
-药物
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


