科研人员利用全景实时成像揭示流体力塑造囊胚发育过程
2023-09-11
细胞疗法
该研究首次发现囊胚发育中存在流体力,并利用鉴定到的流体力学报告基因,开发了一套用于连续实时监测流体力和细胞命运的长时程活体成像系统,绘制了早期胚胎发育过程流体力学细胞谱系树。这项研究为机械生物学领域的
“我是谁?我从哪里来?要到哪里去?”是发育生物学探究细胞命运的核心问题。从单个受精卵到形成由200多种不同细胞类型组成的个体,离不开细胞的增殖及细胞命运的分化。囊胚发育过程中,细胞的分布和形态发生显著的变化,产生了第一次细胞命运决定,形成了内细胞团(inner cell mass, ICM)和滋养层细胞(trophectoderm, TE)。第一次命运决定由包括各种分子在内的多因素共同驱动发生,如Hippo通路在ICM和TE细胞中影响不同基因表达状态【1】,分子水平的不对称分布【2】等。囊胚发育中细胞致密化及囊胚腔的形成,生物力学在第一次命运决定中起着推动作用。
2016年,Maitre等人发现顶端区域的不对称分裂导致细胞收缩性的差异,从而促进细胞命运的特化【2】。2019年,Chan等人发现囊胚发育过程中,液腔压力影响TE细胞的分裂模式,进而调控了细胞分化和命运决定【3】。然而已有研究方法仅能测量局部区域或部分细胞(TE),无法探究胚胎内部比如ICM受到的机械力。此外,何种机械力调控ICM细胞命运也尚不得知。早期胚胎发育是一个快速、动态的过程,已有研究的方法尚不能长时程实时报告或检测力与细胞谱系的关系。

Preview
来源: 生物谷
论文截图

Preview
来源: 生物谷
囊胚腔内存在流体剪切力。(A—C) 囊胚腔内注射荧光小球的运动情况。固定胚胎囊胚腔内荧光小球呈现无规则运动;活体胚胎囊胚腔内荧光小球呈现有方向性的运动。(D—E) 体外摇床力学施加实验证明施加液体剪切力后,KLF2水平显著升高
囊胚是早期胚胎发育的重要阶段,由滋养层、内细胞团和囊胚腔三部分结构组成。先前的研究已经指出,囊胚内的液体压力直接影响胚胎的大小,并对内细胞团和滋养层的命运决定起着关键作用【3】。研究者利用长时程体外流体力刺激及细胞移植等实验,确定流体力与细胞命运之间的联系,力的变化可由KLF2的荧光强度测定。
接下来,研究者将KLF2报告检测的发育中的流体力学动态变化,细胞命运和细胞谱系整合在一起绘制了全景力学细胞谱系图。研究者利用自建的高分辨率光片显微镜vLSFM,对Klf2-H2Bmcherry小鼠胚胎从E2.0到E3.5左右的发育过程
Preview
来源: 生物谷
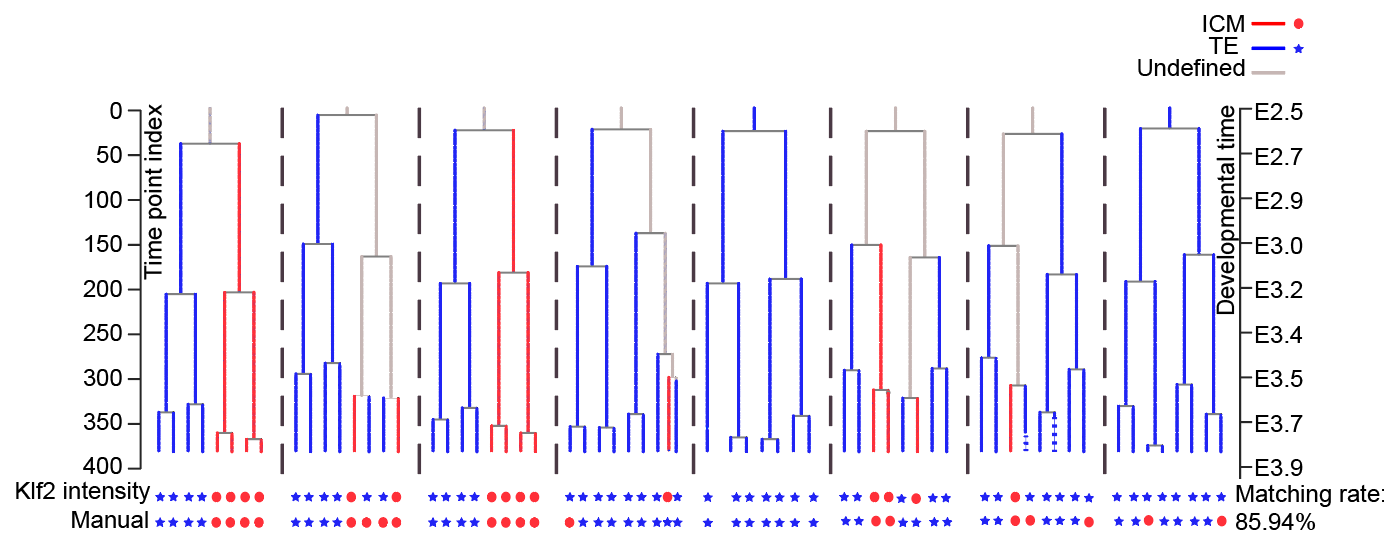
利用KLF2荧光强度推测囊胚形成过程中ICM和TE的细胞命运决定作用
总之,该研究首次发现囊胚发育中存在流体力,并利用鉴定到的流体力学报告基因,开发了一套用于连续实时监测流体力和细胞命运的长时程活体成像系统,绘制了早期胚胎发育过程流体力学细胞谱系树。这项研究为机械生物学领域的研究提供了一种新的思路,利用遗传力学报告系统,未来或许可用于揭示肿瘤转移等过程中的机械力变化和命运决定。
北京大学未来技术学院博士生张幼东、李鑫、高姝和已毕业硕士研究生廖远辉为论文共同第一作者。何爱彬,以及实验室已毕业博士生(现吉林大学第一医院教授)岳晏竹教授为本文的共同通讯作者。北京大学工学院熊春阳教授和生命科学学院杜鹏教授对研这项究提供了宝贵建议。该研究获得了科技部干细胞专项、国家自然科学基金委的和生命科学联合中心的支持。

Preview
来源: 生物谷
利用全景实时成像揭示流体力塑造囊胚发育过程的示意图
1.Sasaki, H. (2015). Position- and polarity-dependent Hippo signaling regulates cell fates in preimplantation mouse embryos. Semin Cell Dev Biol 47-48, 80-87. 10.1016/j.semcdb.2015.05.003.
2.Maitre, J.L., Turlier, H., Illukkumbura, R., Eismann, B., Niwayama, R., Nedelec, F., and Hiiragi, T. (2016). Asymmetric division of contractile domains couples cell positioning and fate specification. Nature 536, 344-348. 10.1038/nature18958.
3.Chan, C.J., Costanzo, M., Ruiz-Herrero, T., Monke, G., Petrie, R.J., Bergert, M., Diz-Munoz, A., Mahadevan, L., and Hiiragi, T. (2019). Hydraulic control of mammalian embryo size and cell fate. Nature 571, 112-116. 10.1038/s41586-019-1309-x.
4.Yue, Y., Zong, W., Li, X., Li, J., Zhang, Y., Wu, R., Liu, Y., Cui, J., Wang, Q., Bian, Y., et al. (2020). Long-term, in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nat Cell Biol 22, 332-340. 10.1038/s41556-020-0475-2.
5.Li, X., Yue, Y., Zhang, Y., Liao, Y., Wang, Q., Bian, Y., Na, J., and He, A. (2022). Continuous live imaging reveals a subtle pathological alteration with cell behaviors in congenital heart malformation. Fundamental Research 2, 14-22.
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
适应症
靶点
药物
-来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。





